铜污染土壤中耐铜微生物的筛选与分离
刘婷婷 滕金浩

摘要[目的] 探索受铜污染土壤的微生物修复方法。[方法]运用单因素分析方法对受铜浓度胁迫的微生物进行筛选分离以及驯化。[结果]分离得到4种不同菌株,其中MD1菌株的铜耐受极限为4 000 mg/L,MD2菌株的铜耐受极限为6 000 mg/L,N1菌株的铜耐受极限为1 000 mg/L,ML菌株的铜耐受极限为8 000 mg/L。经TAS-990F火焰原子分光光度计检测后其对铜离子吸附能力依次为10.420、16.884、9.764、23.309 mg/g。[结论]ML菌株能较好地生成菌胶团,可作为耐铜微生物工业化生产的优良菌种。
关键词耐铜微生物;土壤修复;重金属污染;筛选
中图分类号S154.3文献标识码A
文章编号0517-6611(2019)02-0060-04
doi:10.3969/j.issn.0517-6611.2019.02.018
重金属污染土壤中的的铜多以硫化物、硫酸盐的形式存在,并具有隐蔽性、长期性和滞后性的特性[1]。其主要污染来源为污水灌溉、化工生产、矿石开采及冶炼等[2]。植物可通过根吸收土壤中的铜,在各部分累积分布,且多数为根>茎、叶>果实。但少数植物体内铜的分布与此相反,如丛桦叶则为果>枝>叶[3]。调查发现,在铜污染土壤生长的植物,含铜量为正常植物的33~50倍[4]。被植物吸附的铜可经过食物链进入人体,当人体器官中富集、残存了大量铜之后,容易对脏器产生负担,特别是对肝脏和胆囊伤害,易于产生溶血性黄疸、肾功能衰竭等症状[5]。因此,我国于2008年修订的《土壤质量环境标准(GB 15618—2008)》规定了土壤中铜含量不超过50 mg/kg[6]。目前铜污染土壤修复技术主要为化学试剂改良等化学方法,这些技术成本较高且易引起二次污染,故利用微生物技术治理铜污染土壤已成为研究的前沿和热点[7]。
研究表明,微生物对铜的富集表现在其胞外络合、胞外吸附沉淀。如类脱硫弧菌可以与重金属产生难溶性的硫化物就,并通过自身代谢将硫化物排除细胞外[8]。部分微生物对铜产生耐性的原因是通过细胞内的植物螯合肽和金属结合蛋白与重金属配位结合[9]。微生物的铜耐性也表现在通过与其发生氧化还原反应,改变重金属的价态,降低其毒性,如部分微生物会分泌一些氧化还原酶,催化重金属的氧化还原[10]。
利用微生物治理铜污染土壤的关键在于获得较高耐受性的菌株,因此目前发现的耐铜微生物主要为细菌、真菌和藻类。其种类繁多,吸附能力也有差异,近年来发现的微生物主要有黑色巨藻(Laminaria nigresense)、大杯蕈(Clitocybe maxima)、铜绿假单孢菌(Pseudomon asaeruginosa)、花斑曲霉(Aspergillus versicolor)等[11-14]。这些研究大部分集中在国外,而国内针对铜耐性菌株的研究较少。
笔者以浙江省嘉兴市嘉善地区某工厂富含铜的表层土壤作为试验用土,筛选分离得到铜的耐性菌株,并对其铜耐性机制进行分析,以阐明菌株耐受铜的机制,旨在为耐铜基因和能力的精确定位提供理论依据。
1材料与方法
1.1材料
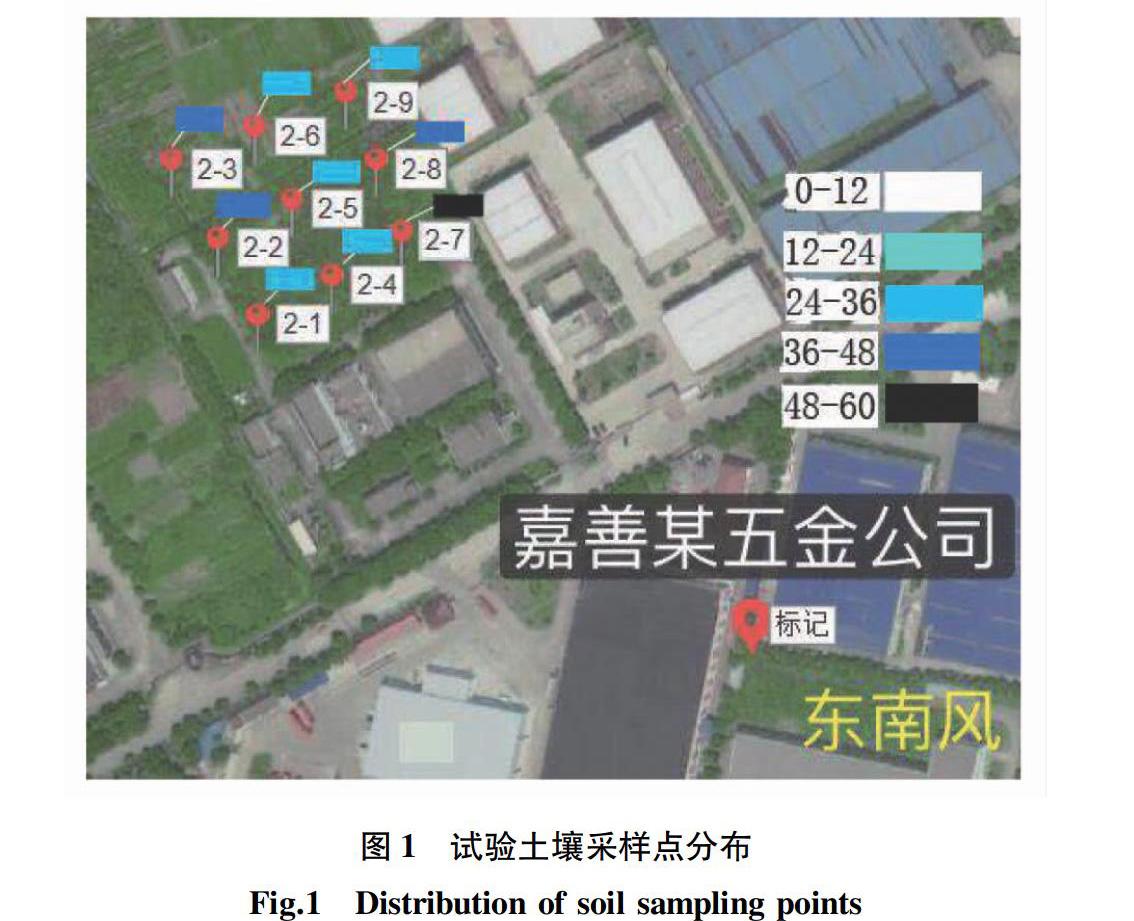
1.1.1土壤。供试土壤来自于嘉兴市嘉善地区典型工厂附近下风向表层土壤(0~10 cm)。采样点分布见图1。分别采集嘉兴市东南风下风向工厂周边9个采样点的土壤,采集后用保鲜袋密封并置于4 ℃冰箱保存。分析各土壤中重金属含量,结果2-7中土壤铜含量最高,为57 mg/kg,故该试验使用该采集点所采的土壤。
1.1.2培养基。
适合霉菌等真菌生长的培养基为马丁氏培养基,其固体培养基配方:蛋白胨5 g,葡萄糖10 g琼脂15~20 g,KH2PO4 1 g,MgSO4·7H2O 0.5 g,1/3 000孟加拉红水溶液100 mL,水800 mL,pH自然。
适合细菌生长的培养基为牛肉膏蛋白胨培养基,其固体培养基配方:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂15~25 g,水1 000 mL,pH 7.4~7.6。
分离出的另一种放线菌使用的为马铃薯蛋白胨培养基,其制法:将含有高淀粉的马铃薯300 g洗净、去皮、切片后于水浴锅中煮沸,边煮边搅拌,将其过滤取滤液,每1 000 mL培养基加入葡萄糖20 g,琼脂20 g。液体培养基取其滤液每1 000 mL培养基加入葡萄糖20 g。各液体培养基配方与上述除不加琼脂外无差异。所有培养基均置于高温高压蒸汽灭菌锅内,121 ℃灭菌20 min。
1.1.3主要仪器。
超净工作台、光学显微镜、培养皿、试管、涂布棒、接种环、灭菌锅、火焰原子分光光度计TAS-990F、铜空心阴极灯等。
1.2方法
1.2.1耐铜微生物的液体初筛。
将稀释度分别为10-1、10-2、10-3、10-4的土壤悬液置于含系列浓度梯度的重金属铜液体培养基(0、1 000、2 000、3 000、4 000、5 000、6 000、7 000、8 000 mg/L)中,并置于37 ℃恒溫摇床下培养,初步筛选出具有铜耐受性的微生物。
1.2.2耐铜微生物的分离与纯化。
利用平板涂布法进行微生物的分离,用胶头滴管吸取10 mL已长出生物膜的菌液,分别用无菌水稀释10、100、1 000倍,采用平板涂布进行菌株分离。
将分离菌株的培养基置于37 ℃恒温培养箱培养数日,菌株生长情况较好后进行平板划线,以纯化菌株,为保证菌株的单一划线进行3次。
1.2.3耐铜微生物的鉴定。结合微生物形态分析鉴定和显微镜镜检对已分离纯化的菌株进行初步鉴定。
1.2.4摇床不同转速菌株生长情况。
于三角瓶中分别制备相应培养基90 mL,并加入配制好的10 mL菌液,置于37 ℃恒温摇床(转速0、30、60、90、120、150 r/min)中培养,并实时观察其微生物生长情况,待进入稳定期测定培养瓶中菌胶团平均半径,重复3次。
1.2.5生长曲线的测定。
将耐受微生物接种至不同铜浓度(0、3 000、4 000、5 000、6 000、7 000、8 000 mg/L)的相应液体培养基中,置于恒温摇床以37 ℃、120 r/min的条件下培养。每隔24 h取样,于分光光度计测定OD600,以OD600为纵坐标,培养时间为横坐标,绘制不同铜浓度下耐铜菌株的生长曲线。
1.2.6吸附能力的测定。
将耐受微生物接种至相应液体培养基中,置于恒温摇床37 ℃、120 r/min的条件下培养。待耐受微生物进入快速生长的对数生长期时,吸取上清液50 mL于50 mL离心管中,每种菌做2组,一组直接置于离心机内以8 000 r/min离心5 min,通过过滤将沉于试管底部的微生物和重金属收集至已称重的滤纸上,置于105 ℃烘箱内烘2 h,烘干后称重。
另一组在在通风橱内操作,先配制王水(浓盐酸与浓硝酸体积比为3∶1配制成),将所得下沉物质转移至坩埚内置于300 ℃恒温铁板仪用王水消解,经过消解的那组样品用无菌水进行溶解,并用無菌水定容至50 mL,保存后采用火焰原子分光光度测定,计算菌株的吸附能力,重复3次。
1.3数据分析试验数据用均值±标准差(mean±SD)表示;采用Excel 2016对试验数据进行制图;采用SPSS 20.0统计软件进行数据分析。
2结果与分析
2.1液体初筛
经过7 d的培养,分别发现在含10-2的土壤悬液、2 000 mg/L的马丁氏液体培养基,含10-2的土壤悬液、1 000 mg/L牛肉膏蛋白胨培养基,含10-2的土壤悬液、3 000 mg/L的马铃薯蛋白胨培养基中有较好的生物膜形成,且长势较好。
2.2分离纯化
于马丁氏培养基中分离得到2种形态不同的菌株,分别命名为MD1、MD2,并通过平板划线法得到单一菌株;于牛肉膏蛋白胨培养基中分离得到1种菌株,命名为N1;于马铃薯蛋白胨培养基中分离得到1种菌株,命名为ML菌株,同样经平板划线得到单一菌株,待后续的鉴定、驯化以及特性研究。
2.3菌株初步鉴定
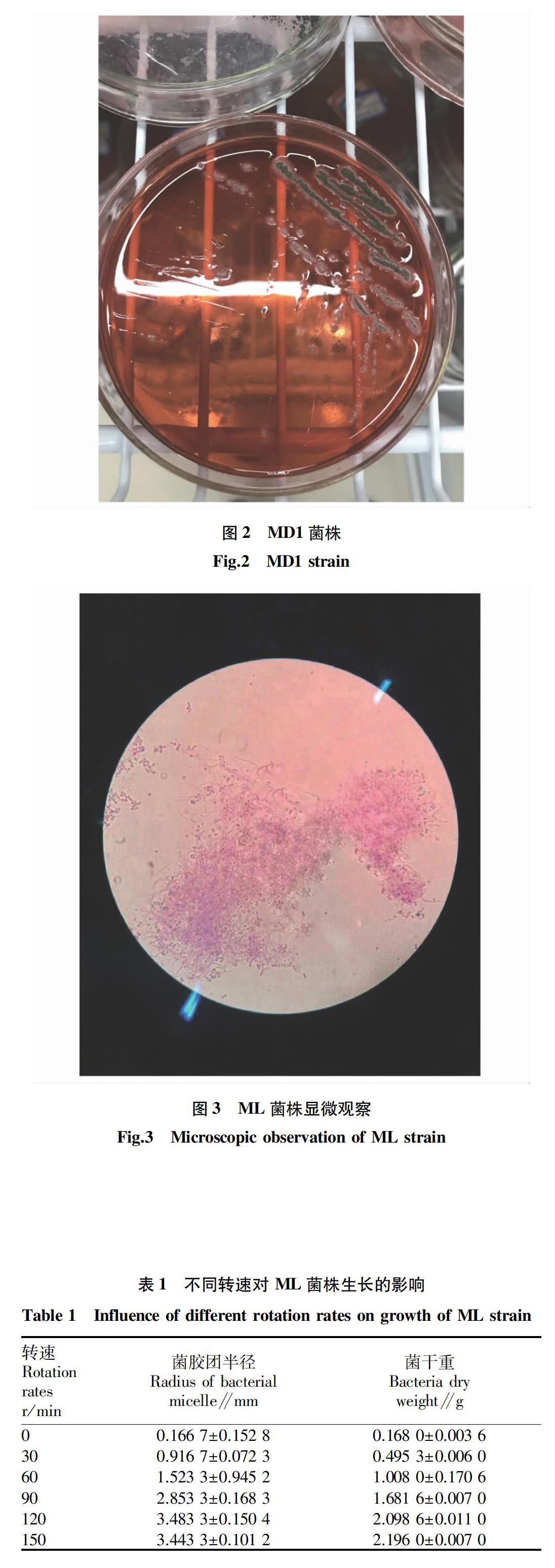
MD1菌株初步鉴定为黑曲霉(图2),其形态大致分双层,干燥,上层为孢子丝,其上已经长出孢子,呈黑色球状,下层基内菌丝较黏稠但颜色较浅。MD2菌株初步鉴定为霉菌,为粉白色,干燥,上层孢子为粉色,下层基内菌丝为白色。
N1菌株初步鉴定为革兰氏阴性短杆菌,整体呈灰白色絮状,难挑取,显微观察呈半透明短杆状。
ML菌株初步鉴定为放线菌,乳白色,较难挑取,绒毛状菌丝密集且细长。在显微镜下观察ML菌株(图3),发现菌丝形态是由垂直生长到弯曲生长并逐步向丛生发展,并存在游动的孢子[15]。
2.4菌株生长特性
对恒温摇床中的ML菌株进行实时观察发现,在转速为0 r/min的37 ℃恒温摇床培养下,培养液内部基本无菌胶团的形成,4 d左右在液面处长出生物膜,对比其他转速下微生物的生长发现,其他转速情况液面下均有不同程度的菌胶团产生,可能为分离出的菌株均为好氧菌株导致。
由表1可知,当ML菌株培养转速达120 r/min后,其生长情况和菌胶团成球能力较好,同时对比转速150 r/min时,菌胶团成球情况并未明显增加,故该试验所分离出的菌株最适培养条件为37 ℃、120 r/min。
2.5菌株生长曲线
通过对OD600连续8 d的测量,绘制各菌株生长曲线,结果见图4。由图4可知,不同菌株在铜胁迫条件下生长趋势不同,同时也受铜离子浓度的影响。恒温摇床37 ℃、120 r/mn培养下MD1菌株的铜耐受极限为4 000 mg/L,
其生长潜伏期较长,在较低铜浓度下4d后进入对数生长期后快速到达峰值,表明此刻MD1菌株生长速率和浓度达到最高峰,培养液中MD1菌株的生物量也达到最大。在含7 000 mg/L马丁氏液体培养基的生长曲线OD600一直在0.2附近,同时观察培养基内菌株生长情况,其内基本未见生物膜或菌胶团,8 000 mg/L菌株代谢生长基本无法进行。
恒温摇床37 ℃、120 r/mn培养下MD2菌株的铜耐受极限为6 000 mg/L,其生长停滞期较短,培养1 d后即迅速进入对数生长期,MD2菌株对数增长。在6 d左右培养液的OD600达到最高值,表明菌株生长速率和浓度达到最高峰,7 d后MD2菌株开始进入衰亡期,OD600开始下降。
在恒温摇床37 ℃、120 r/mn培养下N1菌株的铜耐受极限为1 000 mg/L,观察发现整体的N1生长曲线趋势相似,迅速进入对数期但受铜的毒害影响较大,其OD600一直在0.2左右。结合液体初筛和固体平板培养综合分析,N1菌株的耐性高,对铜的耐性约在1 000 mg/L。
恒温摇床37 ℃、120 r/mn培养下ML菌株的铜耐受极限为8 000 mg/L, ML菌株在铜浓度8 000 mg/L后,其菌株的生长趋势仍较好,通过比较各个不同铜浓度的ML菌株生长曲线发现,ML菌株仍受高浓度铜离子影响而生长较为缓慢。初期ML株停滞期较短,很快进入生长期,在生长初期由于ML菌株的耐受性较强,故各个浓度铜离子马铃薯葡萄糖培养基的OD600值相差不大,在3 d左右,在较低浓度的马铃薯葡萄糖培养基中出现菌落的积聚,富集了培养液中的菌种,故OD600稍回落。由图4可知,ML菌株整个生长周期约8 d。鉴于试验时间局限性对ML菌株的驯化未能进行,ML菌株的耐铜极限为8 000 mg/L,且长势较好,能够较好地生成吸附铜离子的菌胶团。其耐受浓度与柴新义等[16]的1株铜绿微生物Cladosporium sp.的耐受性能相当,且同样具有形成较好菌胶团的能力。
安徽农业科学2019年
2.6吸附能力
为了更好地了解菌株对铜的吸附能力,取最大铜耐受极限浓度下对数生长期的上清液50 mL,分别经离心、消解、定容制成待测样品,并于火焰原子分光光度计TAS-990F进行吸附能力检测。由表2可知,50 mL样品中各菌
株对重金属铜的吸附量均在20 mg左右,结合50 mL中样品
菌干重分析,MD2菌株、 ML菌株的菌干重较小,其单位生物量的吸附能力则较强,并通过计算得图5。由图5可知,MD1菌株吸附能力为10.420 mg/g,MD2菌株吸附能力为16.884 mg/g,N1菌株吸附能力为9.764 mg/g,ML菌株吸附能力为23.309 mg/g。结合各菌株的耐受极限分析,N1菌株的耐受极限和吸附能力综合表现最弱,但N1菌落初步鉴定为细菌,
可作为耐铜细菌吸附能力研究的试验菌种。ML菌株的耐受极限为8 000 mg/L,其吸附能力为23.309 mg/g,是该试验中分离出的4种菌株中最强的,且其菌落形成菌胶团的能力强、时间快。对比MD1菌株和MD2菌株发现,这2种菌株均为马丁氏培养基中分离出的霉菌,但MD2菌株的耐受极限及吸附能力较MD1菌株高。
杨帅等[17]于安徽某铜矿区发现的革兰氏阳氏菌株的耐受极限为200 mg/L,相较该试验于浙江嘉兴地区所分离出的菌株,其耐受极限较低。分析其原因,浙江嘉兴地区为酸性土壤,同时土壤采集地为金属加工工厂附近,污染较为严重,已经对本土菌株进行了一定的驯化。
同时对比同为浙江地区董新姣等[18]2003年发现的铜绿假单胞菌的耐受性,其耐受极限为560 mg/L,发现随着我国工业化进程的不断推进,土壤中重金属含量的积累,微生物受驯化其耐受性也随之增加,吸附能力也相应增加。
3结论与讨论
(1)微生物修复为重金属污染修复土壤提供了较传统物理、化学法更为高效、绿色的方法,其修复潜力巨大[19]。该研究从典型重金属土壤中成功分离出4种不同耐铜菌株,初步鉴定菌株类型并测定其其生长曲线及吸附能力,确定菌株的生长特性、条件及对铜的吸附能力,初步鉴定菌株MD1、MD2、N1、ML分别为黑曲霉、霉菌、杆状菌、放线菌。探索了耐性微生物的筛选、分离的机理,扩充了耐性微生物的种类,对菌株运用于含铜土壤的修复提供依据。
(2)现阶段虽已有耐铜微生物的报道,但其耐受性不强:Pseudomonadaceae USTB-E 560 mg/L[20]、Aspergillus fumigatus 940 mg/L[21]、Rhizopus 1 920 mg/L[22]。该研究从典型重金属土壤中成功分离出4种不同的耐铜菌株MD1、MD2、N1、ML铜耐受极限分别为4 000、6 000、1 000、8 000 mg/L;吸附强度分别为10.420、16.884、9.764、23.309 mg/g,为已发现耐铜微生物中较优质的菌株。
(3)ML菌株的耐受极限达8 000 mg/L,吸附性能为23.309 mg/g,与已报道的铜绿微生物Cladosporium sp[16]相似,且ML菌株的吸附性能更强,其在摇床37 ℃、120 r/min下形成的菌胶团半径更大,其长势较好,易于后续土壤修复的工业化生产。
参考文献
[1] 李玉梅,李海鹏,张连科,等. 包头某铜厂周边土壤重金属分布特征及来源分析[J]. 农业环境科学学报,2016,35(7):1321-1328.
[2] 刘洪超,魏学华,何广宇. 我国重金属污染土壤修复技术的发展现状及选择策略[J]. 环境与发展,2018,30(2):82,86.
[3] 贝荣塔马叶,王琳,等. 选矿废水污染的土壤铜量与生物累积的研究[J]. 环境保护科学,2013,39(1):27-32.
[4] 李致颖,韩旭,吕月玲. 重金属铜污染土壤修复牧草植物选择研究[J]. 家畜生态学报,2016,37(12):30-35.
[5] 于莎莎.锌和铜对镉胁迫下水稻幼苗生长及植物螯合肽合成的影响研究[D]. 北京:中国农业科学院,2016.
[6] 康薇.微生物-蓖麻联合修复铜污染土壤的机理与应用研究[D].武汉:中国地质大学,2014.
[7] 王泽煌,王蒙,蔡昆争,等. 细菌对重金属吸附和解毒机制的研究进展[J]. 生物技术通报,2016,32(12):13-18.
[8] 刘艳.一株硫酸盐还原菌(Desulfovibrio sp.strain SRBa)的分离鉴定及其去除水体中镉离子研究[D]. 广州:华南理工大学,2011.
[9] 郜雅静,李建华,靳东升,等. 重金屬污染土壤的微生物修复技术探讨[J]. 山西农业科学,2018,46(1):150-154.
[10] 刘家女,王文静. 微生物促进植物修复重金属污染土壤机制研究进展[J]. 安全与环境学报,2016,16(5):290-297.
[11] 尹平河,赵玲.海藻生物吸附废水中铅、铜和镉的研究[J].海洋环境科学,2000,19(3):11-15.
[12] SAY R,DENIZLI A,ARICA M Y. Biosorption of cadmium (II),lead(II) and copper(II) with the filamentous fungus Phanerochaete chrysosporium[J]. Bioresource technology,2001,76(1): 67-70.
[13] TASTAN B E,ERTUGˇRUL S,DNMEZ G. Effective bioremoval of reactive dye and heavy metals by Aspergillus versicolor[J]. Bioresource technology,2010,101(3):870-876.
[14] LIU H Y,GUO S S,JIAO K,et al. Bioremediation of soils co-conta minated with heavy metals and 2,4,5-trichlorophenol by fruiting body of Clitocybe maxima[J]. Journal of hazardous materials,2015,294:121-127.
[15] 杨少彬,黄永春,王常荣,等. 链霉菌TJ430的鉴定及产物结构[J]. 微生物学报,2014,54(6):624-634.
[16] 柴新义,童飞,安双登. 铜矿厂区土壤中耐铜菌株的筛选及其生长特性初探[J]. 工业微生物,2015,45(1):56-61.
[17] 杨帅,王飞,马贵党,等. 铜矿区土壤中耐铜菌株的分离鉴定及生物学特性[J]. 现代矿业,2017(2):200-202,204.
[18] 董新姣,陈文海. 耐铜细菌的筛选及其吸附条件优化[J]. 环境科学与技术,2002,25(5):6-7,19.
[19] 张雪晴,张琴,程园园,等. 铜矿重金属污染对土壤微生物群落多样性和酶活力的影响[J]. 生态环境学报,2016,25(3):517-522.
[20] 王海鸥,钟广蓉,王立曼,等.一株耐铜细菌的鉴定及富集特性的研究[J].环境工程学报,2011,5(10):2380-2384.
[21] 傅冬和,薛志慧,姚亚丽,等.1株高耐铜真菌的分离鉴定及其在茶园土壤中的富铜应用研究[J].中国农学通报,2012,28(34):268-273.
[22] 卢福芝,李启虔,钱丰,等. 耐铜、铅、锡微生物的分离筛选[J]. 河池学院学报,2012,32(5):15-20.

