东北地区鸡源多重耐药大肠杆菌整合子的检测
冯涛 何纪元 薛原
摘要[目的]了解东北地区鸡源大肠杆菌耐药性的流行特征以及整合子-基因盒系统的耐药机制。[方法]在检测耐药性的基础上,采用PCR方法对整合酶和整合子进行检测和克隆测序,并且对检测结果和耐药基因盒与GenBank数据库的序列进行比对和分析。[结果]413株分离菌中整合子检出率为71.91%,整合酶 Ⅰ 和整合酶 Ⅱ 的检出率分别为65.52%和54.48%,整合酶 Ⅲ未检出。序列分析得出,共包含6种整合子,各自携带不同组合的基因盒。[结论]Ⅰ 型整合子在细菌耐药性的传播过程中发挥着至关重要的作用。
关键词鸡;大肠杆菌;耐药性;PCR;整合子;基因盒
中图分类号S852.61文献标识码A
文章编号0517-6611(2019)02-0083-03
doi:10.3969/j.issn.0517-6611.2019.02.024
鸡主要为人类提供食用价值和药用价值,也有一些鸡的种类具有观赏价值[1]。随着抗菌药物使用频率的逐渐增加,大肠杆菌在临床上的耐药情况也越来越强,在近几年的研究中多重耐药的情况也较多[2]。耐药基因的传播不仅对鸡源的饲养有重要影响,而且对人类生活也会产生间接影响。
整合子是一种可以移动遗传的物质,具有特异性结合和捕获耐药基因的能力,在整合酶的催化下完成表达过程[3]。整合子有2种途径进行表达:一是可以与质粒或者染色体连接,二是成为转座子的组成部分,继而完成其移动和表达的过程[4]。整合子随质粒和转座子的表达加速了耐药基因水平以及垂直传播,耐药水平和多重耐药性均有上升。整合子是一个组合基因,包括两端高度保守序列和存在于二者之间的可变区域。在保守序列中含有整合酶基因、决定特异性的序列片段以及可变区的启动子,整合子可以通过编码整合酶特异性来选择结合特定的基因盒。笔者对东北地区不同鸡源养殖场的大肠杆菌耐药性和 Ⅰ 型整合子进行了检测,旨在了解鸡源大肠杆菌的整合子-基因盒系统的流行情况,为控制鸡的多重耐药性提供依据和研究方向。
1材料与方法
1.1菌株
大肠杆菌质控菌株(菌株编号为ATCC25922),由中国兽医药品监察所提供;试验用大肠杆菌413株,分离自东北不同地区鸡养殖场。
1.2主要试剂
22种药敏纸片,包括安普霉素(APR)、氨苄西林(AMP)、环丙沙星(CIP)、头孢噻吩(KF)、头孢他啶(CAZ)、阿米卡星(AK)、氯霉素(C)、阿莫西林/克拉维酸(AMC)、四环素(TE)、诺氟沙星(NOR)、亚胺培南(IPM)、氟苯尼考(FFC)、氨曲南(ATM)、氧氟沙星(OFX)、复方新诺明(SXT)、庆大霉素(N)、强力霉素(DO)、多黏菌素B(PB)、卡那霉素(K)、新霉素(NEO)、恩诺沙星(ENR)、阿莫西林(AMX),均由杭州天和微生物试剂有限公司提供;质粒小量提取试剂盒、DNA 片段凝胶回收试剂盒均由爱思进生物技术有限责任公司提供;水解酪蛋白琼脂培养基(mueller-hinton,MH),由西陇科学股份有限公司提供;10×Buffer、dNTP、Taq 酶、DL2000 Marker、6×Loading Buffer、pMD18-T 载体、感受态细胞E.coli DH5α均由TaKaRa公司提供。
1.3药敏试验
当质控菌株的抑菌环处于CLSI[5]的标准范围内时,试验菌株的抑菌结果有效且稳定。试验采用WHO推荐的Kirby-Bauer法[5]对413株大肠杆菌进行药敏试验,按照抗生素的敏感性扩散的抑菌环直径来确定不同菌株的耐药性。然后,采用耐药、中介、敏感3种评定标准来标定抑菌环的大小,最后进行汇总分析。
1.4整合酶基因的检测
PCR扩增体系(25.00 μL)如下:2.50 μL 10×Buffer,2.00 μL dNTP,上、下游引物各1 μL、0.25 μL Taq酶,2.00 μL模板。按照参考文献[6-8]设计引物序列。PCR扩增程序如下:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。通过琼脂糖凝胶电泳对扩增出的PCR产物进行验证。
1.5整合子的检测
参照文献[9]设计引物序列。PCR扩增体系同“1.4”。PCR扩增程序如下:94 ℃预 变 性 5 min;94 ℃变性30 s,55.4 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃再延伸10 min。对扩增出的PCR产物使用琼脂糖凝胶电泳进行验证。
1.6整合子-基因盒的克隆与测序
将整合子的阳性PCR产物扩增样本用胶回收纯化后与18-T载体连接,并转入感受态细胞E.coli DH5α中克隆复制,将质粒样本送至哈尔滨博仕生物技术有限公司测序部进行序列测定。将返回的核苷酸序列用DNASTAR軟件分析,与GenBank数据库进行比较。
2结果与分析
2.1大肠杆菌的耐药性
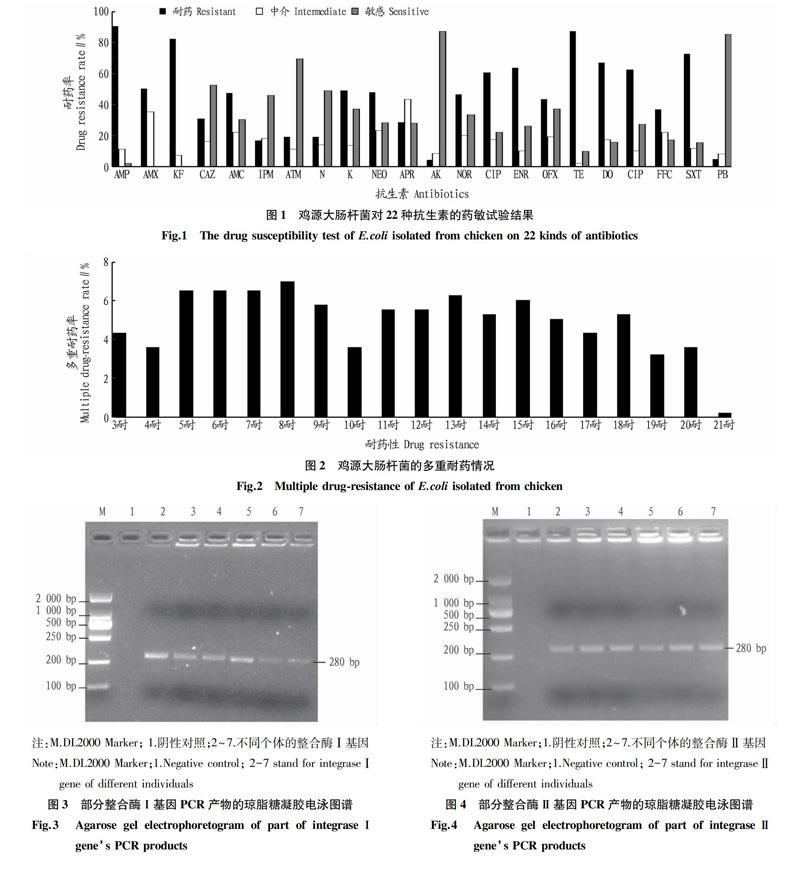
413株鸡源大肠杆菌的耐药情况表现比较复杂,结果见图1。由图1可知,对氨苄西林、头孢噻吩和四环素3种抗生素的耐药率都超过80%;对有些药物的敏感性较强,如多黏菌素B、氨曲南和阿米卡星,鸡源大肠杆菌对这些抗生素的敏感性达70%。
在413株鸡源大肠杆菌中,试验菌株中8重耐药的比例最大,达7.02%。分离菌株的多重耐药现象比较明显,最少为3种,最多为21种,结果见图2。
2.2整合酶基因的检测
413株大肠杆菌中整合酶 Ⅰ 被检出为阳性的有271株,检出率为65.52%,见图3。整合酶 Ⅱ 的阳性菌株有225株,阳性率为54.48%,见图4。整合酶 Ⅲ基因未检出。
2.3整合子的检测
413株鸡源大肠杆菌中,Ⅰ 型整合子基因的PCR 产物片段出现多种不同大小的条带,见图5。413株大肠杆菌菌株中297株 Ⅰ 型整合子基因扩增结果呈阳性,检出率为71.91%。
3讨论
该试验中鸡源大肠杆菌对采用的22种抗生素具有不同程度的耐药性,多重耐药可达21种,其中较高的是8重耐药,耐8种抗生素的占总数的7.02%,3重及3重耐药以上的耐药菌株包括391株,所占比例可达94.68%。这些结果都表明东北地区鸡源养殖场在治疗普通疾病时具有较复杂的用药过程,多重耐药情况明显,单一抗生素的耐药性却并不普遍,大肠杆菌在东北地区使用的抗生素种类复杂,在不断的选择压力下逐渐进化为多重耐药的菌株[10]。
该试验使用的PCR引物扩增技术筛选 Ⅰ 型整合子和整合酶,以了解整合子的流行和传播程度。检测结果显示,鸡源大肠杆菌 Ⅰ 型整合子存在具有广泛性和普遍性,413株大肠杆菌菌株中检出 Ⅰ 型整合子297株,检出率达到71.91%。通过GenBank核酸序列数据库对比分析,发现鸡源大肠杆菌Ⅰ 型整合子携带的基因盒组合形式有aadA1-aadA22-aadA23、aadA1-aadA2-dfrA1-dfrA12-drfA15、aadA5-dfrA17、aadA1-aadA2-aadA29-dfrA1-dfrA12-dfrA15、aadA2-aadA28-dfrA12和aadA2-dfrA16。該研究中的整合子中出现的基因盒 dfrA1、dfrA12、dfrA15、dfrA16和dfrA17可以编码二氢叶酸还原酶; aadA1、 aadA2、aadA5、aadA22、aadA23、aadA28、aadA29能促进腺苷转移酶的表达。李琳等[11]对安徽地区的鸡源大肠杆菌的整合子以及基因盒进行了检测和分析,结果表明试验的菌种中均检测出 Ⅰ 型整合子,检出率高达100%,其携带基因盒的种类主要包括5种,有3种组合形式流行。杨聪等[12]对宁夏地区的鸡源耐药性大肠杆菌进行了研究,结果发现 Ⅰ 型整合子的检出率为75%,其中aadA5-dfrA17基因盒在该研究中也有出现。该研究与国内外研究[11-14]报道的大肠杆菌 Ⅰ 型整合子的检出率十分相近,主要存在的基因盒包括aadA 和dfrA两种 ,但基因盒的种类及其组合方式存在较大差异,可能与整合子的地区分布以及不同地区的用药差异有关。Ⅰ 型整合子在不同地区不同动物源大肠杆菌内广泛存在,尤其是各地区鸡源大肠杆菌的耐药基因盒流行普遍,证实了在对鸡等禽类的饲养过程中用药的不合理情况。
该研究对东北地区(包括黑龙江、吉林、辽宁)的鸡源大肠杆菌样本做了整合子-基因盒检测试验,结果发现鸡源大肠杆菌整合子中 Ⅰ 型整合子的分布比较广泛。与整合子的关系密切得主要为aadA和dfrA这2个基因,这2种基因也是在近几年国内外报道中整合子介导的最常见的抗药基因型[15]。 Ⅰ 型整合子对细菌的耐药性和多重抗药率、抗药谱具有十分重要的作用,是能够直观体现多重抗药性的一项重要指标。鸡源大肠杆菌耐药性产生的主要原因是由于临床治疗以及饲料中添加药物导致,也有可能是由于环境污染(水源污染、土壤污染)所导致的耐药性产生。在近几年的国内外研究进展中,可以发现有些耐药基因盒产生的原因主要是由于传统的抗生素,而一些新型抗生素的耐药基因盒在研究过程中很少出现,由此可见这些基因盒的广泛传播主要依赖于长时间的选择压力,而新型抗生素还未产生这种影响,但是整合子具有强大的从环境中获取基因盒的能力,若不改善用药情况,可能很快会造成新的耐药基因盒的出现和广泛传播。因此,临床用药或在饲料中添加药物时,应注意多种抗生素轮换使用,不要长期大量使用某种药物,以减少抗生素的依赖性,避免产生和扩散细菌耐药性,影响治疗效果,造成经济损失和其他严重后果。
参考文献
[1]朱建录,刘先珍.乌骨鸡的经济价值与饲养管理技术[J].畜牧兽医,2006(5):57-59.
[2] SKOCˇKOV A,KOLCˇKOV I,BOGDANOVICˇOV K,et al.Characteristic and antimicrobial resistance in Escherichia coli from retail meats purchased in the Czech Republic[J].Food control,2015,47:401-406.
[3] SCHWARZER A,KAESBERG A K,BERGMANN S,et al.Activity rhythms and use of nest boxes of juvenile mink in seminatural group housing[J].KVet Dent,2017,18: 13-22.
[4] POEY M E,LAVIN~A M.Integrons in uropathogenic Escherichia coli and their relationship with phylogeny and virulence[J].Microbial pathogenesis,2014,77: 73-77.
[5]张炳亮,王文文,杨国栋,等.洛阳地区规模化猪场大肠杆菌耐药基因检测及耐药性分析[J].黑龙江畜牧兽医,2018(5):125-128.
[6] DOLEJSKA M,CIZEK A,LITERAK I.High prevalence of antimicrobial-resistant genes and integrons in Escherichia coli isolates from Black-headed Gulls in the Czech Republic[J].Journal of applied microbiology,2007,103(1): 11-19.
[7] KOELEMAN J G,STOOF J,VAN DER BIJL M W,et al.Identification of epidemic strains of Acinetobacter baumannii by integrase gene PCR[J].J Clin Microbiol,2001,39(1): 8-13.
[8] GOLDSTEIN C,LEE M D,SANCHEZ S,et al.Incidence of class 1 and 2 integrases in clinical and commensal bacteria from livestock,companion animals,and exotics[J].Antimicrob Agents Chemother,2001,45(3): 723-726.
[9] DE LA TORRE E,COLELLO R,FERNNDEZ D,et al.Multidrug resistance in Escherichia coli carrying integrons isolated from a pig farm with moderate antibiotic use[J].J Gen Appl Microbiol,2015,61(6): 270-273.
[10] 段俊秀.雞大肠杆菌的分离鉴定及耐药性试验[J].中国畜牧业,2015(5):55-56.
[11] 李琳,代兴杨,汪莹,等.安徽鸡源大肠杆菌整合子-基因盒分布及同源性分析[J].中国兽医科学,2016,46(10):1277-1282.
[12] 杨聪,周学章,杜军,等.宁夏地区鸡源耐药性大肠杆菌Ⅰ类整合子的研究[J].中国兽医杂志,2015,51(1):88-90.
[13] CHIRILA F,TABARAN A,FIT N,et al.Concerning increase in antimicrobial resistance in shiga toxinproducing Escherichia coli isolated from young animals during 1980-2016[J].Microbes Environ,2017,32(3):252-259.
[14] CHUNG Y S,SONG J W,KIM D H,et al.Isolation and characterization of antimicrobial-resistant Escherichia coli from national horse racetracks and private horse-riding courses in Korea[J].J Vet Sci,2016,17(2): 199-206.
[15] 刘玉芹,闫平,董淑珍,等.河北部分腹泻仔猪源大肠杆菌整合子-基因盒的分子流行病学调查[J].黑龙江畜牧兽医,2018(8): 98-100.

