拟南芥SPM12基因GFP载体构建及转基因植株筛选
方雪 徐洁娜 孟杏楠 曹树青 樊婷婷
摘要[目的]为了进一步研究SPM12基因的功能,利用哥伦比亚(Columbia,Col)遗传背景的野生型拟南芥材料构建SPM12基因GFP载体及其转基因植株。 [方法] 以野生型拟南芥的RNA反转录成的 cDNA为模板,PCR擴增出SPM12基因的CDS全长序列,将其连接到GFP载体的质粒上;然后将构建成功的重组质粒转化到大肠杆菌DH5α受态细胞中,挑取阳性菌落经PCR鉴定并测序后,将其质粒转入农杆菌GV3101感受态细胞中。PCR鉴定出阳性菌落后,通过浸花法将其转入野生型拟南芥植株中。收种子后,使用带有抗性的选择性培养基筛选出阳性植株。[结果]通过SPM12基因CDS片段和SPM12-GFP重组质粒的获得,构建了SPM12-GFP载体和其转基因植株。 [结论]成功获得拟南芥SPM12-GFP转基因植株,为进一步研究拟南芥SPM12基因的功能与分子机制奠定了基础。
关键词拟南芥;SPM12;载体;GFP转基因植株
中图分类号Q939.9文献标识码A文章编号0517-6611(2019)02-0086-03
doi:10.3969/j.issn.0517-6611.2019.02.025
植物在其自然栖息地中经常面临过多的非生物和生物胁迫。适应这种变化需要很大程度的表型可塑性,这主要取决于植物的基因组。目前尚不清楚植物是如何做到整合大量部分协同或拮抗的环境信号,从而使他们能够在任何特定条件下做出响应[1]。但显而易见的是,植物在应对各种胁迫时能够做出相应的抵御反应。土壤中有害重金属污染是世界范围内日益迫切的问题,重金属污染是对植物造成重大损害的因素之一[2-5]。笔者发现,SPM12基因使得拟南芥对重金属镉的胁迫有所响应,为进一步研究该基因的功能,通过构建SPM12基因GFP载体及其转基因植株,研究SPM12基因在镉胁迫响应中所起的作用。
1材料与方法
1.1材料
1.1.1试验材料。该试验使用的植物材料为哥伦比亚(Columbia,Col)遗传背景的野生型(wild-type,Col-0)拟南芥(Arabidopsis thaliana),购于美国拟南芥种质资源中心。载体构建过程中所用大肠杆菌DH5α、农杆菌GV3101、载体pXB94-GFP均购自北京全式金生物技术有限公司。
1.1.2主要试剂。TIANprep Mini Plasmid Kit和TIANprep Mini Purification Kit 购自天根生化科技(北京)有限公司;T4-DNA Ligase、限制性内切酶Kpn I和Eco RI购自NEB公司;Eazy Taq DNA Polymerase和Marker购自北京全式金生物技术有限公司; PrimeSTAR HS DNA Polymerase 购自TaKaRa公司;Silwet-77购自索莱宝公司;琼脂、NaCl、氯仿、异丙醇、乙醇、蛋白胨、酵母粉、蔗糖均购自国药集团;壮观霉素、庆大霉素、卡那霉素均购自生工生物工程(上海)股份有限公司。
1.2方法
1.2.1野生型拟南芥RNA的提取及其反转录。提前准备好研钵,洗干净后放入65 ℃烘箱烘干水分。用锡箔纸包裹放入180 ℃烘箱,高温烘4~6 h后,冷却至室温,放入-20 ℃预冷冰柜备用。同时将氯仿、异丙醇、乙醇放入-20 ℃冰柜中预冷处理。离心机提前设置到4 ℃预冷。称取无菌培养2周左右的野生型拟南芥(WT)材料100~300 mg,置于预冷的研钵中,用无菌纸杯取适量液氮加入研钵中,将样品材料在液氮中充分研磨成粉末;向研磨破碎后的材料中加入1 mL Trizol裂解液(4 ℃保存)继续研磨成液体;转移研磨完成后的材料至1.5 mL的离心管(EP)中,于超净台中室温静置5 min;加入200 μL氯仿后剧烈震荡约15 s;继续室温静置5 min后,13 000 r/min、4 ℃离心10 min;取上清液500 μL转移至新的1.5 mL EP管中,并加入500 μL异丙醇,轻轻颠倒混匀6~8次,室温静置10 min;然后13 000 r/min、4 ℃离心15 min(在此期间配制足量75%乙醇);弃上清,留沉淀,沿着EP管壁缓缓加入1 mL 75%乙醇,8 000 r/min、4 ℃离心5 min;充分弃去上清,在超净台静置晾干5~8 min后,加入30~50 μL DEPC水,65 ℃水浴溶解10 min,每5 min敲打一次,溶解完毕后置于冰上,吸取2 μL进行浓度和纯度检测,根据检测结果将所得RNA按反转录试剂盒说明书操作反转录成cDNA。
1.2.3酶切、连接与大肠杆菌的转化。将所得目的基因片段和载体pXB94-GFP质粒用限制性内切酶KpnI和EcoRI在37 ℃下分别进行双酶切2和4 h,琼脂糖凝胶电泳后进行胶回收,使用T4-DNA Ligase将酶切后的基因片段和pXB94-GFP质粒在16 ℃下连接12 h。取5 μL连接产物加至40 μL大肠杆菌DH5α感受态细胞中,轻轻混匀,冰浴30 min。然后42 ℃热激50 s,迅速放冰上静置2~3 min。加入600~800 μL无菌液体LB培养基,放置在37 ℃摇床中,220 r/min培养1 h。4 000 r/min离心5 min,弃去部分上清,留下约200 μL将菌体沉淀重悬并涂布于带有50 mg/L的壮观霉素抗性的固体LB培养基上,放在37 ℃培养箱中倒置过夜培养。挑取单菌落至装有500 μL含50 mg/L壮观霉素抗性的无菌液体LB培养基的EP管中,220 r/min、37 ℃培养至培养基浑浊,进行菌落PCR鉴定阳性菌株。
1.2.4农杆菌的转化。用测序比对正确的阳性菌落扩大培养并提取出重组质粒。取重组质粒2 μL,加入50 μL GV3101感受态细胞,混匀后移至预冷的电击杯中,1 800 V电击;电击完成后迅速取出,加入600~800 μL无菌液体LB培养基,使用移液枪吹打混匀,尽可能多的将混合液移入无菌的1.5 mL EP管中,放入28 ℃摇床220 r/min培养3 h;4 000 r/min离心5 min。弃去部分上清,留下约200 μL将菌体沉淀重悬并涂布于带有50 mg/L壮观霉素和50 mg/L庆大霉素双抗性的固体LB培养基上,放在28 ℃培养箱倒置培养约48 h;挑取单菌落至装有500 μL含50 mg/L壮观霉素和50 mg/L庆大霉素双抗性的无菌液体LB培养基的EP管中,220 r/min、28 ℃培养至培养基浑浊,进行菌落PCR鉴定阳性菌株。并使用50%甘油将阳性菌株保存一部分于-80 ℃冰箱留作菌种。
1.2.5浸花法转基因。将含有表达载体的阳性克隆扩大培养,5 000 r/min离心5 min收集菌体。用MS/蔗糖缓冲液重悬后,再次离心收集。用缓冲液再次重悬至OD600=0.5,按照1∶4 000的比例加入Silwet-77。剪去野生型擬南芥的果荚和已授粉的花,将未授粉得到花浸入侵染缓冲液约20 s后,裹上保鲜膜黑暗过夜培养,揭去保鲜膜后22 ℃正常培养。1周后,再次侵染。
1.2.5
转基因植株的筛选。 收到拟南芥侵染后的第一代种子后,筛去杂质,放置于37 ℃烘箱干燥15 d,然后密封放在4 ℃冰箱春化1周左右。使用时在超净台先用0.1%的氯化汞消毒1次,并用无菌水洗涤3次,将洗涤过的种子用无菌牙签拨置于无菌滤纸上。待种子晾干后,撒在含50 mg/L卡那霉素的MS固体培养基上,用封口膜密封后置于4 ℃冰箱春化3 d。春化后,将培养基放在恒温22 ℃光照培养箱培养2周。因为卡那霉素能够影响植物叶绿体和线粒体的蛋白合成从而引起植物黄化而死亡,而转基因植物由于带有卡那抗性能够抑制卡那的作用,所以能够通过卡那培养基筛选出转基因植株。对有阳性植株的培养皿进行拍照,并将阳性植株移栽土培。土培2周后可选莲座叶提取DNA进行PCR复验证。
2结果与分析
2.1目的片段的PCR扩增
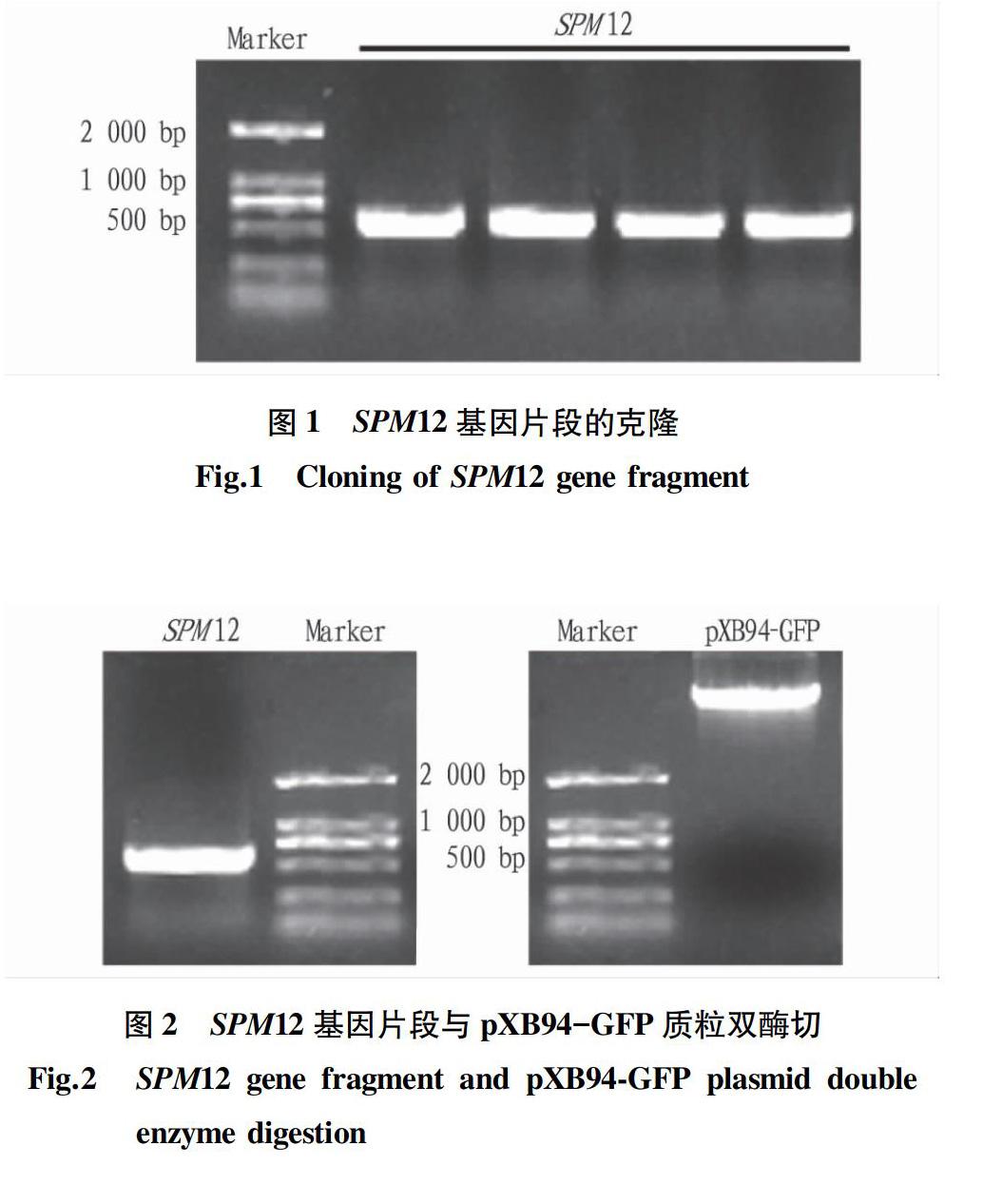
利用无菌培养2周的拟南芥提取的RNA反转录出的cDNA通过PCR扩增出目的基因SPM12的片段,该片段长度为561 bp,从图1中琼脂糖凝胶电泳的结果来看,扩增出的条带与该基因片段的长度相吻合。通过琼脂糖凝胶DNA回收试剂盒回收基因片段。
2.2目的基因与pXB94-GFP质粒的双酶切
由于在设计克隆目的基因的引物时根据不同载体所携带的酶切位点,选择性设计了2个最优的酶切位点KpnI和EcoRI分别加在上下游引物的5′端。取30 μL基因片段和20 μL pXB94-GFP质粒的溶液,每个限制性内切酶各加1 μL,相应各加入5 μL的Cutsmart,用ddH2O配足50 μL,目的基因酶切时间为2 h,pXB94-GFP质粒的酶切时间为4 h。图2中双酶切的结果显示酶切效果良好,无拖尾,无杂带。条带大小与目的基因和质粒分别相符。用胶回收试剂盒回收酶切产物。使用T4-DNA Ligase将酶切后的目的基因与pXB94-GFP质粒载体在16 ℃的金属浴中连接12 h。
2.3大肠杆菌重组质粒阳性菌落的PCR鉴定
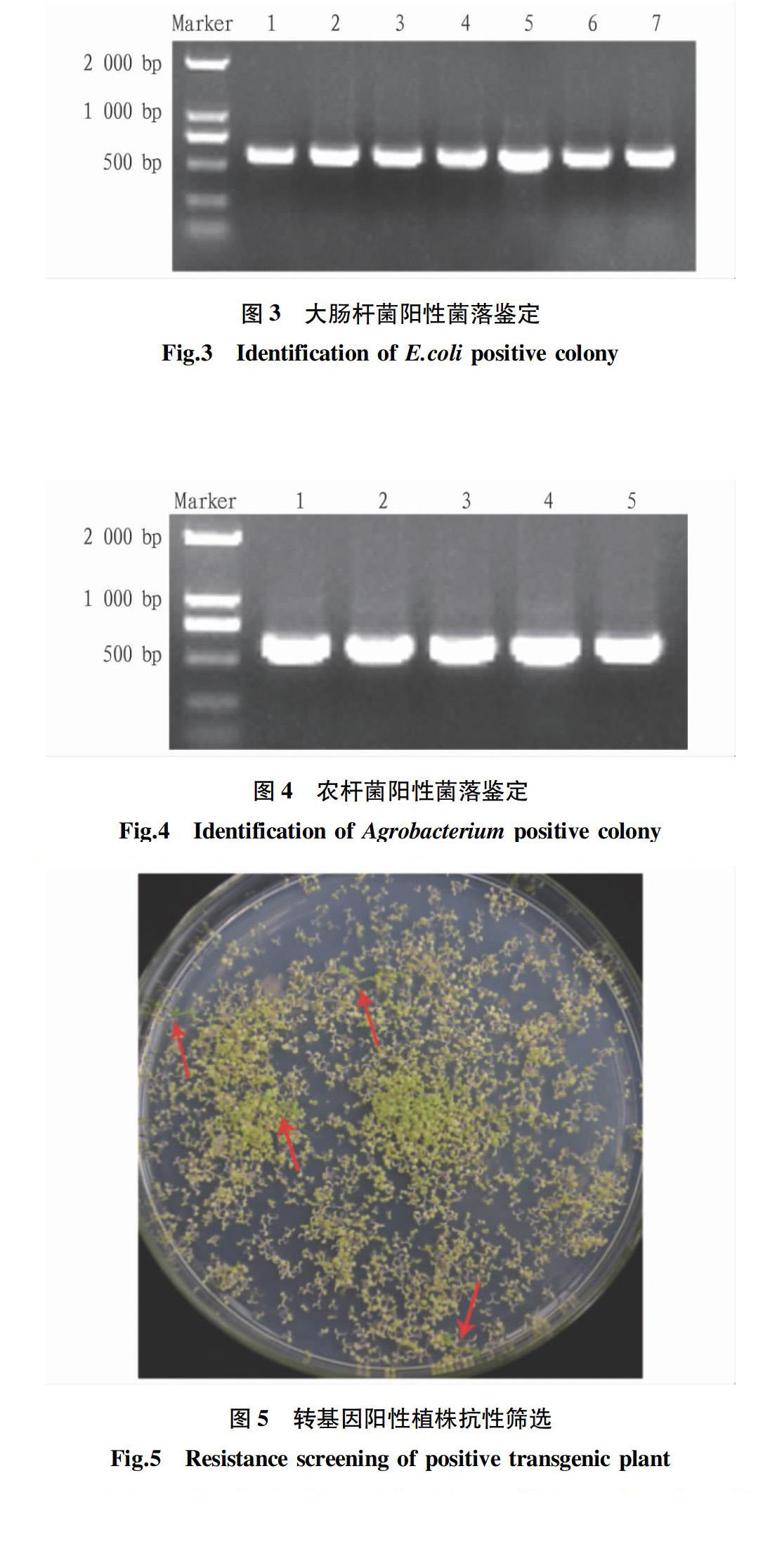
将连接产物通过化学转化法转入大肠杆菌DH5α的感受态细胞中,涂布在壮观霉素抗性的LB固体培养基上过夜后,挑取阳性菌落培养一定时间,通过PCR鉴定获得阳性菌落,图3为大肠杆菌重组质粒阳性菌落PCR鉴定的琼脂糖凝胶电泳结果,显示与目的基因大小符合。经过测序比对,得到含目的基因的重组质粒载体。
2.4农杆菌阳性克隆的PCR鉴定
用质粒小提试剂盒提取测序比对正确的大肠杆菌重组质粒,并提取出的重组质粒通过电转化法转入农杆菌GV3101感受态细胞中,在含有50 mg/L庆大霉素和壮观霉素双抗性的LB固体培养基上28 ℃培养2 d左右,挑取单菌落活化,然后进行菌落PCR鉴定。农杆菌阳性菌落的琼脂糖凝胶电泳结果(图4)说明,目的基因成功转入农杆菌。
2.5转基因阳性植株的抗性筛选
通过浸花法侵染野生型拟南芥,将收到的种子撒在带有卡那霉素抗性的MS固体培养基上,阳性植株会正常生长(图5),阴性植株因不含转基因携带的抗性而黄化死亡。2周后,将阳性株系移栽土培。
为进一步验证转基因成功的株系,提取转基因株系的DNA进行PCR鉴定,如图6,成功扩增出SPM12的CDS片段,从而更进一步地确定了阳性植株为转基因成功的株系,也说明成功构建了拟南芥SPM12基因的GFP载体并得到了相应的转基因植株。
3讨论
自然界中和人为造成的重金属污染对很多农业土壤造成不同程度的污染。人为造成的污染主要包括工业生产活动以及农业活动中使用的含有重金属的肥料[6-7]。受到重金属污染的土壤会造成很多农作物产品如各种水果与蔬菜中含有很高的重金属成分[8-9]。镉是重金属污染中最危险的因素之一,对植物和农作物具有很强的毒性,镉能够通过与巯基结合使得蛋白质变性失活,从而造成动植物的细胞损伤[10-13]。通过研究对重金属胁迫有所响应的基因有助于筛选出优质的农作物品种。由于SPM12基因能够对镉胁迫做出应答,通过SPM12基因的GFP载体和该基因的GFP转基因株系的构建,对后续研究该基因的功能与分子机制做出了一定的贡献,对农业生产、食品安全有重要意义。
参考文献
[1] PANDEY S P,SOMSSICH I E.The role of WRKY transcription factors in plant immunity[J].Plant physiology,2009,150(4):1648-1655.
[2] SHI W Y,SHAO H B,LI H,et al.Progress in the remediation of hazardous heavy metalpolluted soils by natural zeolite[J].Journal of hazardous materials,2009,170(1):1-6.
[3] GJORGIEVA D,KADIFKOVAPANOVSKA T,RUSKOVSKA T,et al.DNA-damage and total antioxidant status in two selected medicinal plants subjected to heavy metal phytotoxicity[C]// Conference on medicinal and aromatic plants of southeast European countries.[s.l.]:[s.n],2012:127-127.
[4] SYTAR O,KUMAR A,LATOWSKI D,et al.Heavy metal-induced oxidative damage,defense reactions,and detoxification mechanisms in plants[J].Acta physiologiae plantarum,2013,35(4):985-999.
安徽農业科学2019年
[5] SHAW B P,SAHU S K,MISHRA R K.Heavy metal induced oxidative damage in terrestrial plants[M]//PRASAD M N V.Heavy metal stress in plants.Berlin Heidelberg:SpringerVerlag,2004:84-126.
[6] LEE J,BAE H,JEONG J,et al.Functional expression of a bacterial heavy metal transporter in Arabidopsis enhances resistance to and decreases uptake of heavy metals[J].Plant physiology,2003,133(2):589-596.
[7] ROSS S M.Sources and forms of potentially toxic metal in soil-plant system[M]// ROSS S M.Toxic metals in soil-plant systems.New York:John Wiley & Sons,1994:3-25.
[8] SHAFFER M.Waste lands:The threat of toxic fertilizer[M].Los Angeles,CA:Californias Advocate for the Public Interest,2001.
[9] MENCH M J.Cadmium availability to plants in relation to major long-term changes in agronomy systems[J].Agric Ecosyst Environ,1998,67(2/3):175-187.
[10] RASKIN I,SMITH R D,SALT D E.Phytoremediation of metals:Using plants to remove pollutants from the environment[J].Curr Opin Biotechnol,1997,8(2):221-226.
[11] SHIM D,HWANG J U,LEE J,et al.Orthologs of the class A4 heat shock transcription factor HsfA4a confer cadmium tolerance in wheat and rice[J].Plant cell,2009,21:4031-4043.
[12] GALLEGO S M,PENA L B,BARCIA R A,et al.Unravelling cadmium toxicity and tolerance in plants:Insight into regulatory mechanisms[J].Environ Exp Bot,2012,83:33-46.
[13] GOYER R A.Toxic and essential metal interactions[J].Annu Rev Nutr,1997,17:37-50.
——宣教载体

