耐有机溶剂低温碱性脂肪酶产酶条件优化及其酶学性质
严晓云 石红璆 查代明 余甜甜 张炳火
摘要[目的]研究沙雷氏菌JXJ-54胞外脂肪酶的产酶条件以及粗酶酶学性质。[方法]以沙雷氏菌JXJ-54为出发菌株,采用单因素分析优化其产胞外脂肪酶的条件并对该酶进行酶学性质研究。[结果]该菌株的最佳产酶条件为牛肉浸膏10 g/L、K2HPO4 2 g/L、菜籽油乳化液体积分数2.25%,初始pH 9.0、培养温度20 ℃、装样量40 mL、接种量2%、发酵时间20 h。JXJ-54脂肪酶的最适底物为对硝基苯酚辛酸酯和对硝基苯酚葵酸酯,在30 ℃、pH 8.5~9.5时酶活力最高,且具有一定的热稳定性和较好的pH稳定性;酶样品受到多数供试金属离子和EDTA的抑制,在供试表面活性剂和有机溶剂中具有良好耐受性,甚至处于激活状态。[结论]该菌株能利用简单的发酵培养基达到较好的产酶效果,其所产胞外脂肪酶为低温碱性脂肪酶,具有一定的热稳定性和较好的pH稳定性,在供试表面活性剂和有机溶剂中具有良好的耐受性,在食品加工、洗涤剂、低温环境修复等低温碱性环境的工业领域中有一定的应用潜力。
关键词低温碱性脂肪酶;有机溶剂耐受性;表面活性剂耐受性;沙雷氏菌属
中图分类号Q815文献标识码A
文章编号0517-6611(2019)03-0076-06
doi:10.3969/j.issn.0517-6611.2019.03.025
脂肪酶(triacylglycerol acylhydrolases,EC 3.1.1.3)广泛存在于动植物和微生物中,既能在油水界面上催化酰基甘油水解,又能在微水相或非水相中催化转酯、酯化、氨解、醇解、酸解等多种化学反应,且催化反应具有良好的化学选择性、区域选择性和/或立体选择性[1]。微生物脂肪酶具有资源丰富、催化活性多样、稳定性高、工业生产适用性好等优点,已成为工业用脂肪酶的主要来源,广泛应用于食品、洗涤剂、饲料、生物能源、精细化工、医药等领域[2-3]。
有机溶剂耐受性是评价脂肪酶性能的重要指标,也是脂肪酶资源挖掘的热点方向。虽然关于有机溶剂耐受性脂肪酶的研究报道较多[4-6],但是从沙雷氏菌属(Serratia)细菌中筛选出有机溶剂耐受性脂肪酶的研究报道较少。Zhao等[7]对粘质沙雷氏菌(S. marcescens)ECU1010胞外脂肪酶进行了纯化,并对该纯酶进行了酶学性质研究,发现该脂肪酶具有良好的有机溶剂耐受性,这是首次关于沙雷氏菌脂肪酶具有有机溶剂耐受性的研究报道。朱绮霞等[8]在大肠杆菌(Escherichia coli)BL21(DE3)中高效表达了粘质沙雷氏菌脂肪酶LipA,酶学性质表明LipA对一些有机溶剂有较好的耐受性。司冠儒[9]从土壤中筛选出一株脂肪酶活力较高的粘质沙雷氏菌JNS3-9,通过PCR技术克隆了其脂肪酶基因lipA,并在枯草芽孢杆菌(Bacillus subtilis)168中实现了高效表达,酶学性质表明LipA对有机溶剂有一定的耐受性。Ugur等[10]从生乳中筛选出一株产脂肪酶的格氏沙雷氏菌(S. grimesii)RB06-22,对部分纯化后的胞外脂肪酶进行了酶學性质研究,结果表明该脂肪酶对一些有机溶剂有一定的耐受性,其中正己烷对该酶有强烈的激活作用。李婧玒等[11]克隆了源于北极冻土沙雷氏菌BOB的脂肪酶基因lip18,并在大肠杆菌BL21(DE3)中实现了活性表达,酶学性质表明Lip18具有较好的有机溶剂耐受性。García-Silvera等[12]从石油污染的土壤中筛选出一株产脂肪酶的粘质沙雷氏菌SM3,甲磺酸乙酯诱变处理后获得了一株产脂肪酶活力较高的突变株SMRG4,其胞外脂肪酶具有良好的有机溶剂耐受性。笔者以沙雷氏菌JXJ-54为对象,研究其胞外脂肪酶的产酶条件以及粗酶酶学性质,旨在为进一步应用提供理论基础和技术指导。
1材料与方法
1.1材料
1.1.1菌种。沙雷氏菌JXJ-54,前期分离并用甘油管保藏于超低温冰箱中。
1.1.2
培养基。LB培养基:蛋白脉10 g/L、酵母提取物5 g/L、NaCl 10 g/L,自然pH,固体培养基另加琼脂条18 g/L;基础发酵培养基:麦芽糖5 g/L、蛋白胨10 g/L、K2HPO4 2 g/L、MgSO4 0.5 g/L、大豆油乳化液体积分数2%,pH 7.0。大豆油乳化液:大豆油与体积分数2%的PVA按1∶3的比例混合,10 000 r/min乳化10 min即可。
1.2方法
1.2.1
脂肪酶活力的测定。挑取生长于LB固体培养基上的沙雷氏菌JXJ-54单菌落,接种到4 mL LB液体培养基中,30 ℃、160 r/min培养过夜,然后以2%的接种量接种于20 mL基础发酵培养基中,30 ℃、160 r/min发酵24 h;所有发酵液于4 ℃、4 500 r/min离心15 min,所得上清液即为胞外脂肪酶粗酶,酶活力测定参考文献[6]。
1.2.2培养基的优化。
1.2.2.1碳源。在基础发酵培养基的基础上改变碳源组成,按照上述条件进行发酵培养,测定脂肪酶活力以确定碳源对产酶的影响,对照组不添加碳源,其酶活力设为100%。
1.2.2.2氮源。在上述优化培养基的基础上改变氮源组成,按照上述条件进行发酵培养,测定脂肪酶活力以确定氮源对产酶的影响,对照组不添加氮源,其酶活力设为100%;分别添加7.50、8.75、10.00、11.25、12.50 g/L最佳氮源以确定其添加量对产酶的影响,最佳组的酶活力设为100%。
1.2.2.3
金属离子。在上述优化培养基的基础上改变金属离子的组成,按照上述条件进行发酵培养,测定脂肪酶活力以确定金属离子对产酶的影响,对照组不添加金属离子,其酶活力设为100%。
1.2.2.4
诱导剂。在上述优化培养基的基础上改变油脂诱导剂的组成,按照上述条件进行发酵培养,测定脂肪酶活力以确定诱导剂对产酶的影响,对照组不添加诱导剂,其酶活力设为100%;分别添加2.00%、2.25%、2.50%、2.75%、300%最佳诱导剂以确定其添加量对产酶的影响,最佳组的酶活力设为100%。
1.2.3
发酵条件的优化。
1.2.3.1
初始pH。采用优化发酵培养基,在初始发酵条件的基础上改变初始pH进行发酵培养,测定脂肪酶活力以确定发酵培养基的初始pH对产酶的影响,最佳组的酶活力设为100%。
1.2.3.2
温度。采用优化发酵培养基,在上述优化发酵条件的基础上改变温度进行发酵培养,测定脂肪酶活力以确定发酵温度对产酶的影响,最佳组的酶活力设为100%。
1.2.3.3
装样量。采用优化发酵培养基,在上述优化发酵条件的基础上改变250 mL三角烧瓶中的培养基体积进行发酵培养,测定脂肪酶活力以确定装样量对产酶的影响,最佳组的酶活力设为100%。
1.2.3.4
接种量。采用优化发酵培养基,在上述优化发酵条件的基础上改变种子液的接种量进行发酵培养,测定脂肪酶活力以确定接种量对产酶的影响,最佳组的酶活力设为100%。
1.2.3.5
发酵时间。采用优化发酵培养基,在上述优化发酵条件下进行发酵培养,分别在不同时间段取样进行脂肪酶活力测定以确定发酵时间对产酶的影响,最佳组的酶活力设为100%。
1.2.4酶学性质研究。
1.2.4.1底物特异性。以对硝基苯酚乙酸酯、对硝基苯酚丁酸酯、对硝基苯酚辛酸酯、对硝基苯酚葵酸酯、对硝基苯酚月桂酸酯、对硝基苯酚豆蔻酸酯和对硝基苯酚棕榈酸酯为底物,分别测定脂肪酶活力以确定底物对酶活力的影响,最高酶活力设为100%。
1.2.4.2
温度对酶活力的影响。在最适底物条件下,分别测定不同反应温度(20~55 ℃)下的脂肪酶活力以确定反应温度对酶活力的影响,最高酶活力设为100%。不同温度(30~60 ℃)下温浴处理酶样品,1 h后分别测定脂肪酶活力以确定其热稳定性,处理前的酶活力设为100%。
1.2.4.3
pH对酶活力的影响。在最适底物、温度条件下,分别在Na2HPO4-HCl缓冲液(50 mmol/L,pH 5.0~8.0)和Tris-HCl缓冲液(50 mmol/L,pH 8.0~10.5)中测定脂肪酶活力以确定反应pH对酶活力的影响,最高酶活力设为100%。在不同pH缓冲液中28 ℃摇床处理酶样品,1 h后测定脂肪酶活力以确定其pH稳定性,pH 7.0组的酶活力设为100%。
1.2.4.4
金属离子和EDTA对酶活力的影响。酶样品中分别加入NaCl、KCl、MgCl2、CaCl2、MnCl2、ZnCl2、CuCl2、FeCl3和EDTA,使其终浓度为10 mmol/L,将加入等量双蒸水的酶样品设为对照组,28 ℃摇床处理1 h后,分别测定脂肪酶活力以确定金属离子和EDTA对酶活力的影响,对照组的酶活力设为100%。
1.2.4.5
表面活性剂对酶活力的影响。酶样品中分别加入SDS、CTAB和Triton X-100,使其终浓度为0.10%,加入等量双蒸水的酶样品设为对照组,28 ℃摇床处理1 h后,分别测定脂肪酶活力以确定表面活性剂对酶活力的影响,对照组的酶活力设为100%。
安徽农业科学2019年
1.2.4.6
有机溶剂对酶活力的影响。酶样品中分别加入异丙醇、甲醇、乙腈、乙醇、丙酮、乙酸乙酯、三氯甲烷和正己烷,使其体积分数分别为10%~50%,加入等量双蒸水的酶样品设为对照组,28 ℃摇床处理1 h后,分别测定脂肪酶活力以确定有机溶剂对酶活力的影响,对照组的酶活力设为100%。
1.2.5
数据处理。数据来自3次独立重复试验,以平均数±标准差表示。
2结果与分析
2.1培养基的优化
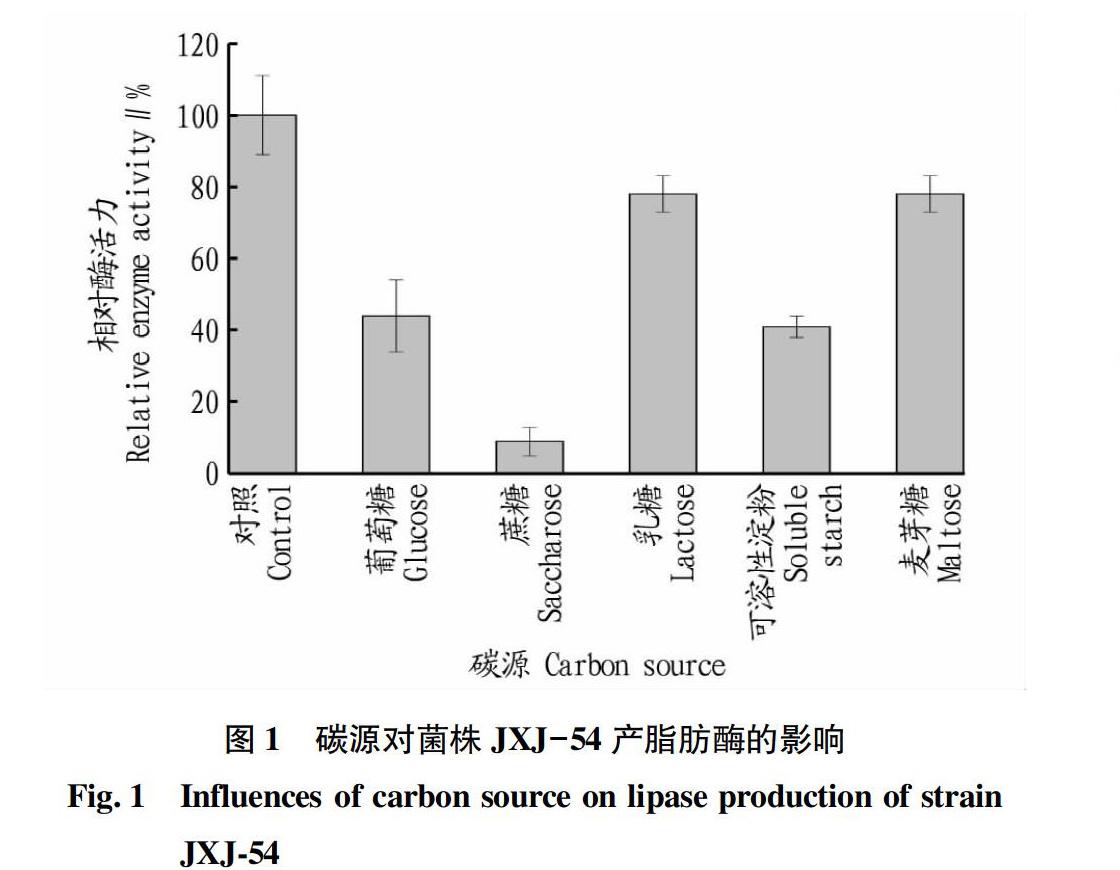
2.1.1碳源。由图1可知,葡萄糖、蔗糖、乳糖、可溶性淀粉、麦芽糖均显著抑制菌株JXJ-54产酶,其中蔗糖的抑制作用最强。因此,发酵培养基中无需额外添加碳源。这些碳源的存在不利于菌株JXJ-54产脂肪酶,可能是由于它们的分解代谢物抑制脂肪酶基因的表达。
2.1.2
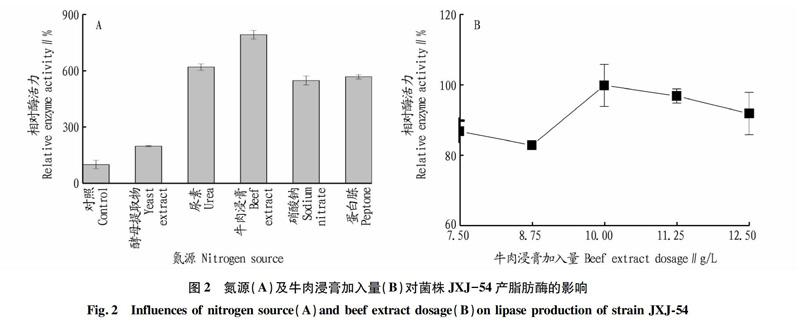
氮源。由图2A可知,硝酸钠、尿素、酵母提取物、牛肉浸膏、蛋白胨均显著促进菌株JXJ-54产酶,其中牛肉浸膏的促进作用最强,因此选择牛肉浸膏作为该菌株产酶的最佳氮源。由图2B可知,牛肉浸膏加入量为10 g/L时,菌株的产酶活力最强,因此选择该浓度为牛肉浸膏的最适加入量。
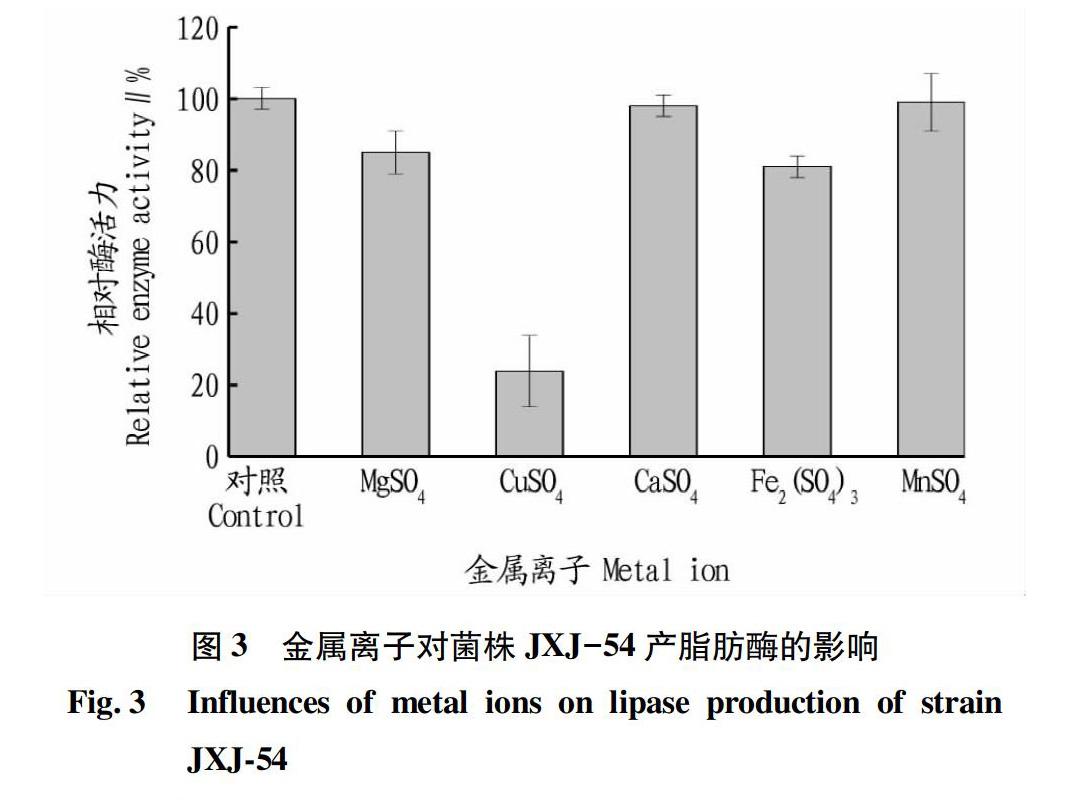
2.1.3金属离子。由图3可知,供试金属离子均不同程度地抑制菌株JXJ-54产酶,其中Cu2+、Mg2+、Fe3+显著抑制菌株产酶,而Ca2+、Mn2+的抑制作用没有显著性。因此,发酵培养基中无需额外添加金属離子。
2.1.4诱导剂。由图4A可知,供试油脂乳化液作为诱导剂显著促进菌株JXJ-54产酶,其中菜籽油的促进作用最强,其次为葵花籽油、玉米油、芝麻油、花生油和大豆油,但是它们之间的促进作用没有显著差异,因此选择菜籽油乳化液作为该菌株产酶的最佳诱导剂。与不添加诱导剂的对照组相比,各诱导剂组的脂肪酶活力只增加了20%~29%,这可能是由于诱导剂为菌株JXJ-54提供了额外的碳源所致,说明该菌株可能是组成型表达胞外脂肪酶。由图4B可知,菜籽油乳化液加入量为2.25%时,菌株产酶活力最强,因此选择该体积分数为菜籽油乳化液的最适加入量。
2.2发酵条件的确定
2.2.1初始pH。由图5可知,菌株JXJ-54在初始pH为40~10.0的发酵培养基中具有较高的产酶活力,其中初始pH为9.0时菌株产酶活力最高,因此选择9.0为该菌株产酶的最佳初始pH。
2.2.2温度。由图6可知,发酵温度对菌株JXJ-54产酶的影响较大,发酵温度为20 ℃时菌株产酶活力最高,因此选择20 ℃为该菌株产酶的最佳发酵温度。
2.2.3
装样量。由图7可知,装样量对菌株JXJ-54产酶的影响不大,装样量为30 mL时菌株产酶活力最高,由于装样量为30 mL与40 mL时的酶活力没有显著差异,因此选择40 mL为该菌株产酶的最佳装样量。
2.2.4
接种量。由图8可知,接种量对菌株JXJ-54产酶的影响较大,随着接种量的增加,菌株产酶活力逐渐增高,接种量为2%时产酶活力达到最高,随后缓慢下降,因此选择2%为该菌株产酶的最佳接种量。
2.2.5
发酵时间。由图9可知,发酵时间是影响菌株JXJ-54产酶的关键因素之一,随着发酵时间的延长,菌株产酶活力迅速增高,12 h达到产酶的稳定期,24 h达到产酶的峰值,随后逐渐下降。由于20 h的酶活力与24 h相比没有显著差异,因此选择20 h为该菌株产酶的最佳发酵时间。
2.3酶学性质研究
2.3.1
底物特异性。由图10可知,JXJ-54脂肪酶特异性水解中链对硝基苯酚酯,其最适底物为对硝基苯酚辛酸酯和对硝基苯酚葵酸酯,与其他沙雷氏菌属脂肪酶的底物特异性存在较大的差异[7,11,13]。
2.3.2
温度对酶活力的影响。由图11A可知,JXJ-54脂肪酶的最适反应温度为30 ℃,20 ℃时其酶活力较低,保持在45%,而25~55 ℃时其酶活力较高,均保持在85%以上。由图11B可知,酶样品在30~60 ℃下温浴1 h后,其残余酶活力急剧下降,50~60 ℃的残余酶活力只有温浴处理前的20%左右。JXJ-54脂肪酶的温度特性与Lip18脂肪酶类似[11]。一般来说,最适反应温度低于40 ℃的酶属于低温酶,且具有一定的热稳定性[14]。因此,JXJ-54脂肪酶为低温脂肪酶,在30~40 ℃时具有较好的热稳定性,这对该酶应用于生物转化领域非常有利,特别是食品加工和油脂加工领域[15]。
2.3.3pH对酶活力的影响。由图12A可知,JXJ-54脂肪酶
的最适反应pH为8.5~9.5,pH 8.0~10.0时其酶活力保持在70%以上,pH低于8.0或高于10.0时其酶活力急剧下降。由图12B可知,酶样品在不同pH缓冲液(5.0~10.5)中28 ℃处理1 h后,其残余酶活力均保持在80%以上。JXJ-54脂肪酶的pH特性与RB06-22脂肪酶和SMRG4脂肪酶类似[10,12]。综上,JXJ-54脂肪酶为低温碱性脂肪酶,具有较宽的最适反应pH和较好的pH稳定性,在低温碱性环境的工业领域具有较大的应用潜力,比如洗涤剂配方和低温环境修复。
2.3.4
金属离子和EDTA对酶活力的影响。由图13可知,金属离子和EDTA对JXJ-54脂肪酶活力具有不同的影响,K+和Mg2+对酶活力具有显著激活作用,Ca2+、Mn2+、Zn2+、Cu2+、Fe3+和EDTA对酶活力具有显著抑制作用,Na+对酶活力没有显著作用。由EDTA抑制酶活力可知,JXJ-54脂肪酶为金属酶,其催化活性需要一定的金属离子参与。一般来说,Ca2+和Mn2+对脂肪酶活力具有激活作用,但它们却抑制JXJ-54脂肪酶活力,与LipA脂肪酶和RB06-22脂肪酶相反[8,10],与Lip42脂肪酶、UD-8脂肪酶和CICC1368脂肪酶类似[16-18]。
2.3.5
表面活性剂对酶活力的影响。由图14可知,表面活性剂对JXJ-54脂肪酶活力具有不同的影响,阳离子表面活性剂CTAB显著激活酶活力,而阴离子表面活性剂SDS和非离子表面活性剂Triton X-100对酶活力没有显著影响,与RB06-22脂肪酶和SMRG4脂肪酶类似[10,12]。可见,JXJ-54脂肪酶在供试表面活性剂中具有良好的耐受性,在洗涤剂配方中可能具有应用潜力。
2.3.6
有机溶剂对酶活力的影响。由表1可知,有机溶剂对JXJ-54脂肪酶活力的影响与其lg P值有关。当lg P < 0时,除甲醇和乙醇外,酶活力随着有机溶剂体积分数的增大而降低,10%~30%甲醇、10%乙腈和30%乙醇对酶活力具有显著激活作用,30%~50%异丙醇、50%甲醇、30%~50%乙腈、50%乙醇和30%~50%丙酮对酶活力具有显著抑制作用,10%异丙醇、10%乙醇和10%丙酮对酶活力没有显著影响。当lg P > 0时,酶活力随着有机溶剂体积分数的增大而增强,30%~50%乙酸乙酯、30%~50%三氯甲烷和50%正己烷对酶活力具有显著激活作用,10%乙酸乙酯对酶活力具有显著抑制作用,10%三氯甲烷和10%~30%正己烷对酶活力没有显著影响。总之,JXJ-54脂肪酶具有良好的有机溶剂耐
受性,这一现象在其他沙雷氏菌屬脂肪酶中也有报道[7-12]。脂肪酶在有机溶剂中呈现良好的稳定性,使其在基于非水相或微水相催化反应的应用领域具有巨大的潜力,比如食品、油脂、新型材料、精细化工、医药、化妆品、生物能源等[19]。
3结论
通过单因素分析,确定出沙雷氏菌JXJ-54产胞外脂肪酶的最佳发酵培养基为牛肉浸膏10 g/L、K2HPO4 2 g/L、菜籽油乳化液体积分数2.25%,最佳发酵条件为初始pH 9.0、培养温度20 ℃、装样量40 mL、接种量2%、发酵时间20 h。总之,该菌株能够利用简单的发酵培养基达到较好的产酶效果。
从底物、温度、pH、金属离子、EDTA、表面活性剂、有机溶剂等方面研究了沙雷氏菌JXJ-54所产胞外脂肪酶粗酶的酶学性质。该酶对中链对硝基苯酚酯有最大水解活力,最适底物为对硝基苯酚辛酸酯和对硝基苯酚葵酸酯;在30 ℃、pH 8.5~9.5时酶活力最高,且具有较好的温度(30~40 ℃)和pH(5.0~10.5)稳定性;K+和Mg2+对酶活力具有显著激活作用,Ca2+、Mn2+、Zn2+、Cu2+、Fe3+和EDTA对酶活力具有显著抑制作用,Na+对酶活力没有显著作用;阳离子表面活性剂CTAB显著激活酶活力,而阴离子表面活性剂SDS和非离子表面活性剂Triton X-100对酶活力没有显著影响;酶样品在不同体积分数的异丙醇、甲醇、乙腈、乙醇、丙酮、乙酸乙酯、三氯甲烷和正己烷中具有良好耐受性,甚至处于激活状态。总之,JXJ-54脂肪酶为低温碱性脂肪酶,具有一定的热稳定性和较好的pH稳定性,在供试表面活性剂和有机溶剂中具有良好的耐受性。
参考文献
[1] 查代明,张炳火,李汉全,等.假单胞菌属脂肪酶的分子生物学研究进展[J].中国生物工程杂志,2015,35(9):114-121.
[2] JAEGER K E,EGGERT T.Lipases for biotechnology[J].Current opinion in biotechnology,2002,13(4):390-397.
[3] HASAN F,SHAH A A,HAMEED A.Industrial applications of microbial lipases[J].Enzyme and microbial technology,2006,39(2):235-251.
[4] PENG R,LIN J P,WEI D Z.Purification and characterization of an organic solvent-tolerant lipase from Pseudomonas aeruginosa CS2[J].Applied biochemistry and biotechnology,2010,162(3):733-743.
[5] 叶涛.橄榄树内生菌分离及其耐有机溶剂脂肪酶研究[D].福州:福建师范大学,2011.
[6] 谢玉婷,查代明,石红璆,等.Burkholderia sp.JXJ-16低温耐有机溶剂脂肪酶产酶条件优化及粗酶酶学性质[J].食品工业科技,2017,38(4):207-213.
[7] ZHAO L L,XU J H,ZHAO J,et al.Biochemical properties and potential applications of an organic solventtolerant lipase isolated from Serratia marcescens ECU1010[J].Process biochemistry,2008,43(6):626-633.
[8] 朱绮霞,陈英,张搏,等.粘质沙雷氏菌脂肪酶基因的克隆表达和酶学性质的研究[J].生物技术,2010,20(5):12-16.
[9] 司冠儒.粘质沙雷氏菌脂肪酶基因的克隆及其在枯草芽孢杆菌中的表达和发酵优化[D].无锡:江南大学,2013.
[10] UGUR A,BORAN R.Production and characterization of a coldactive and nhexane activated lipase from a newly isolated Serratia grimesii RB0622[J].Biocatalysis and biotransformation,2014,32(4):222-230.
[11] 李婧玒,李仁宽,林娟,等.粘质沙雷氏菌低温脂肪酶的基因克隆与酶学性质分析[J].福州大学学报(自然科学版),2016,44(5):738-745.
[12] GARCASILVERA E E,MARTNEZMORALES F,BERTRAND B,et al.Production and application of a thermostable lipase from Serratia marcescens in detergent formulation and biodiesel production[J].Biotechnology and applied biochemistry,2018,65(2):156-172.
[13] YAO H Y,YU S W,ZHANG L D,et al.Isolation of a novel lipase gene from Serratia liquefaciens S33 DB1,functional expression in Pichia pastoris and its properties[J].Molecular biotechnology,2008,38(2):99-107.
[14] NICHOLS D,BOWMAN J,SANDERSON K,et al.Developments with Antarctic microorganisms:Culture collections,bioactivity screening,taxonomy,PUFA production and coldadapted enzymes[J].Current opinion in biotechnology,1999,10(3):240-246.
[15] 梁秋艷.低温脂肪酶产生菌株的筛选、发酵条件优化及其酶学性质研究[D].石河子:石河子大学,2014.
[16] 张银波.脂肪酶基因的克隆与表达研究[D].北京:中国农业科学院,2009.
[17] 王刚.耐有机溶剂脂肪酶高活性菌株选育、酶合成及酶学特性研究[D].长春:吉林农业大学,2011.
[18] 王迪.发酵性丝孢酵母脂肪酶与蛋白酶发酵及性质的比较[D].大连:大连工业大学,2012.
[19] 查代明.防御假单胞菌Pf-5脂肪酶LipA的分子鉴定、酶学性质及基因表达调控研究[D].武汉:华中科技大学,2014.

