不同氮效率基因型玉米根系对低铁胁迫的响应
牛乐 位晶 唐宏亮

摘要[目的]揭示不同基因型玉米根系对低铁胁迫的响应,为玉米铁营养研究提供理论依据。[方法]采用营养液培养的方法,研究2种不同氮效率的玉米基因型(ZD958和XY335)在低铁(5 μmol/L)和高铁(200 μmol/L)条件下生物量累积和分配、根系形态和养分吸收的变化。[结果]低铁胁迫下,2种基因型玉米的苗干重、根干重、总根长、根体积和根表面积均有不同程度的降低,ZD958的苗干重、根干重、根体积、根表面积比XY335分别高45.00%、28.33%、21.27%、16.41%,但2个品种在低铁处理下根质量比与平均根直径明显增加;在低铁胁迫下,ZD958的氮累积量、磷累积量、钾累积量和铁累积量比XY335分别高36.80%、48.12%、45.08%和47.19%。[结论]氮低效的玉米基因型ZD958较氮高效玉米基因型XY335对低铁胁迫更为敏感。
关键词铁胁迫;玉米;根形态;养分吸收
中图分类号S513文献标识码A
文章编号0517-6611(2019)03-0128-05
doi:10.3969/j.issn.0517-6611.2019.03.041
铁(Fe)是植物所必需的微量营养元素,参与基本的生物氧化还原过程[1]。尽管Fe在地壳中的含量很高,但有氧条件下,Fe仅在土壤中微溶,特别是在碱性钙质土壤中。为防止缺Fe,植物具有与Fe螯合形成复合物铁[Fe(III)]和直接摄取铁离子(Fe2+)的双重机制。过量Fe摄取对植物有害,Fe不足引起植物叶片黄化,影响籽粒产量[2]。
殷文娟等[3]研究表明,低铁胁迫严重抑制了小麦生殖器官的发育,从而降低产量;缺铁处理显著降低了小麦植株叶绿素a、叶绿素b的含量;低铁胁迫抑制了小麦对微量元素的吸收,但促进了Mn、Cu 等的吸收。Ciaffi等[4]研究发现,低铁胁迫对小麦生长有显著影响,导致地上部分和根的生长均减少30%;缺铁处理下小麦叶绿素含量显著减少;在Fe供应充足、而硫缺乏条件下,Fe浓度在地上部分和根部均显著下降。Zamboni等[5]研究表明,在缺Fe条件下,小麦幼苗表现出Fe限制性植物的典型症状(如叶绿素水平降低)以及其他必需矿物营养素的不均衡积累;在Fe缺乏的小麦中发现Cu和Zn的显著累积;低铁胁迫也会导致小麦中磷含量的升高。黄瓜和大豆在缺Fe营养液中分别生长8和11 d后,叶绿素含量明显减少[6]。Zaid等[7]研究发现,木麻黄属植物在Fe缺乏下生长21 d后,发生黄叶病。章爱群等[8]研究表明,低Fe胁迫会抑制玉米株高,且对不同基因型玉米幼苗的干重影响不同。龙文靖等[9]研究发现,低Fe处理后,幼苗Fe含量變化较小,根系Fe含量下降相对明显。
玉米是我国最主要的粮食作物,玉米缺铁,叶片脉间失绿,呈条纹花叶,新叶症状重;严重时新叶不出,植株生长不良,矮缩,生育延迟,有的甚至不能抽穗,轻者减产,重者造成大片植株黄化、矮缩,甚至绝收[8]。尽管前期研究已证实作物对低Fe胁迫会产生适应性的反应,但有关不同基因型玉米对低铁胁迫的响应报道较少。笔者利用水培营养液培养的方法,以2个不同氮效率的玉米基因型[郑单958(氮低效)、先玉335(氮高效)]为材料,探讨这2种基因型玉米根系对低铁胁迫的响应,旨在为进一步研究铁胁迫下不同基因型玉米的响应提供理论依据。
1材料与方法
1.1植物培养
挑选健康饱满玉米种子(郑单958,Zea mays L.cv.ZD958;先玉335,Z.mays L.cv.XY335),用10%(V/V)H2O2 表面消毒10 min 后,将种子置于2层湿润的滤纸上,室温下避光培养3 d。待种子萌发,叶完全展开,选取地上部和根系发育一致的幼苗,用去离子水将根冲洗干净后,移栽至含有5.0 L不同铁浓度的营养液中进行培养(每盆3颗苗)。营养液成分:Ca(NO3)2 2 000 μmol/L,KH2PO4 250 μmol/L,K2SO4 750 μmol/L,MgSO4 650 μmol/L,KCl 100 μmol/L,H3BO3 10 μmol/L,ZnSO4 0.5 μmol/L,MnSO4 0.5 μmol/L,CuSO4 0.2 μmol/L,(NH4)6Mo7O24 0.01 μmol/L。Fe以乙二胺四乙酸铁钠(EDTA-FeNa)的形式加入。营养液pH用0.05 mol/L 的盐酸或氢氧化钠调至5.6,每隔5 d更换1次营养液,昼夜连续通气。植物培养室条件:光照时间(白天/夜晚)14 h/10 h,昼夜温度28 ℃/22 ℃,光照强度300 μmol/(m2·s),相对湿度75%~85%。试验设5 μmol/L Fe(低铁)和200 μmol/L Fe(高铁)2个铁水平,2个玉米品种,共4个处理,每处理6个重复,完全随机排列,每3 d改变盆的位置,以最大化消除环境的效应。出苗后第25天收获,分别测定各处理地上部、地下部鲜重和干重、根形态参数(根长、根表面积、平均根直径和根体积)及地上部养分含量(氮、磷、钾、铁)。
1.2测定项目与方法
1.2.1叶绿素相对含量。
在植株收获之前,用 SPAD-502 Plus叶绿素计分别测定每株植物全展叶的SPAD 值[10]。
1.2.2植株生物量。
植物收获时,用剪刀从根茎交界处剪取地上部,在105 ℃下杀青30 min后,在80 ℃下烘干72 h至恒重后称干重(g);根样冲洗干净后直接装入自封袋中于-20 ℃下保存供根系扫描分析用。根质量比=根干重/(根干重+地上部干重)×100%。
1.2.3根系形态参数。
根系解冻后,放于双面扫描仪(EPSON GT-X900)上进行扫描。扫描后的图片用WinRHIZO 图像分析系统(WinRHIZO Pro2009b,Canada)获得总根长(cm)、根表面积(cm2)、平均根直径(mm)、根体积(cm3)等根形态参数。扫描后的根系在80 ℃下烘干72 h至恒重,以获得根干重(g)。
1.2.4地上部氮、磷、钾含量。
烘干的植株样品用粉碎机研磨成细粉状,过1 mm筛,称取约0.3 g,用H2SO4-H2O2消化样品。消化液氮浓度采用凯氏定氮仪测定[11];磷浓度采用钒钼黄比色法测定[12];钾浓度采用火焰光度法测定。
1.2.5地上部分铁含量。
称取研磨好的样品约0.1 g,湿灰化法(HNO3∶HClO4=8∶2))消煮后,用ICP-AES确定消煮液中的铁浓度。
1.3数据分析
采用IBM SPSS Statistics 20.0统计软件对试验数据进行单因素方差分析。单因素方差(oneway ANOVA)分析检验显著性后,采用SNK法比较生物量、根形态和养分含量等参数平均值在不同处理之间的差异显著性(P≤0.05)。
2结果与分析
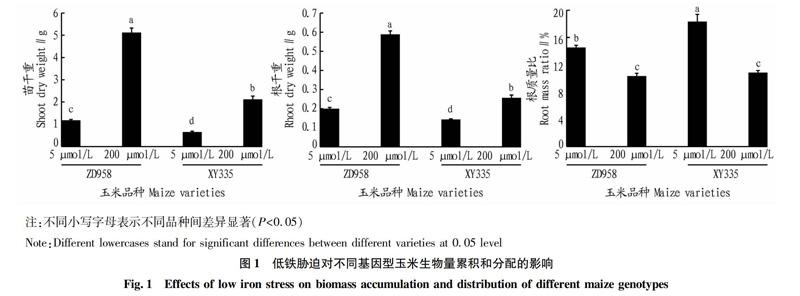
2.1低铁胁迫对不同基因型玉米生物量累积及分配的影响
从图1可以看出,低铁胁迫显著降低了2个不同基因型玉米的苗干重和根干重,但2个基因型玉米降低的幅度不同。不管铁供应如何,ZD958苗干重和根干重显著高于XY335(P<0.001)。在低铁处理下,ZD958的苗干重和根干重比XY335分别高45.00%和28.33%;高铁处理下,ZD958的苗干重和根干重比XY335分别高58.56%和56.37%。低铁胁迫明显增加了2个基因型玉米的根质量比,但增加幅度不同。在低铁处理下,ZD958的根质量比XY335低26.29%;在高铁处理下,两者无显著差异(P>0.05)。
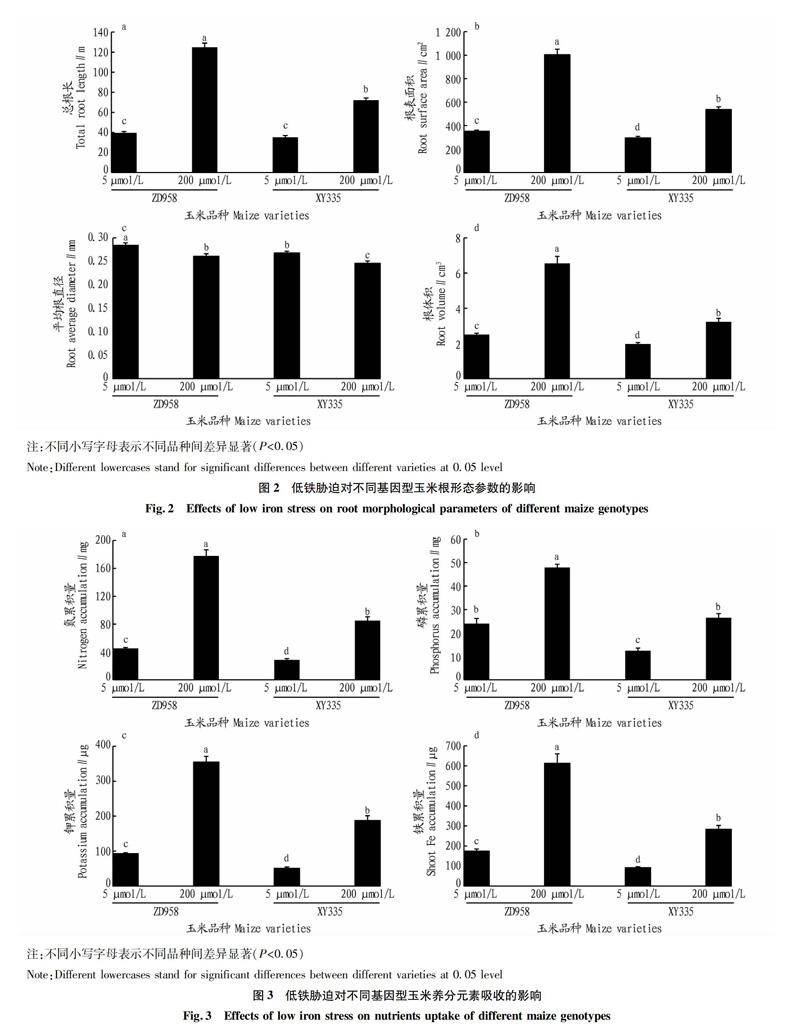
2.2低铁胁迫对不同基因型玉米根形态参数的影响
从图2可以看出,低铁处理明显降低了2个不同基因型玉米的总根长、根体积和根表面积,但增加了平均根直径。在低铁胁迫下,ZD958与XY335的总根长无显著差异(P>0.05);高铁处理下,ZD958的总根长比XY335高42.38%(P<0.001,图2a)。低铁胁迫下,ZD958的根表面积比XY335高16.41%(P<0.01),在高铁处理下,ZD958的根表面积比XY335高46.67%(P<0.01,图2b)。低铁胁迫显著增加了2个玉米品种的平均根直径,ZD958平均根直径比XY335明显增加(图2c)。在低铁胁迫处理下,ZD958的根体积比XY335高21.27%(P<0.001,图2d);高铁胁迫下,ZD958的根体积比XY335高50.64%(P<0.001,图2d)。
2.3低铁胁迫对不同基因型玉米养分元素吸收的影响
低铁胁迫显著降低了2个不同基因型玉米的氮、磷、钾累积量(图3a~c)。低铁处理下,ZD958的氮、磷、钾累积量比XY335分别高36.80%、48.12%、45.08%;高铁处理下,ZD958的氮、磷、钾累积量比XY335分别高52.12%、44.64%、47.15%。
由图3d可知,低铁显著降低了2个不同基因型玉米的铁累积量,但降低幅度不同。不管铁供应如何,ZD958的铁累积量均高于XY335。低铁供应条件下,ZD958的铁累积量比XY335高47.19%;高铁供应条件下,ZD958的铁累积量比XY335高53.73%。
2.4低铁胁迫对不同基因型玉米叶绿素含量的影响
从图4可以看出,低铁处理显著降低了2个不同基因型玉米的叶绿素含量,但降幅不同。2个不同基因型玉米的叶绿素含量在低铁与高铁处理下均无显著差异(P>0.05)。
3讨论与结论
研究表明,缺铁能够明显影响植物的生物量累积和分配,但不同基因型对铁胁迫的响应程度不同。Zocchi 等[13]研究发现,缺铁胁迫下,大豆地上部和根的生物量水平均大幅度降低。沙棘在低铁处理下的生物量显著低于正常铁处理水平下的生物量[14]。红三叶草在缺铁条件下,根干重与苗干重都不同程度减少[15]。该研究结果表明,铁胁迫条件下,2个不同基因型玉米生物量明显下降,表明铁在玉米生长中具有至关重要的作用。不同养分效率的基因型对铁胁迫存在明显不同的响应。邱慧珍等[16]研究表明,磷高效基因型小麦比磷低效基因型小麦对低铁的反应更敏感,其生长更容易受到低铁胁迫。赵婧等[17]研究发现,铁低效的基因型大豆生物量降低程度大,铁高效品种基因型大豆降低程度较小。该研究结果表明,氮低效的玉米基因型ZD958比氮高效的玉米基因型XY335的生物量对铁胁迫响应更为敏感,这与前人[16]在不同磷效率小麦基因型对铁胁迫响应结果相反,但与不同铁效率基因型大豆对铁胁迫的响应[17]一致,表明植物对低铁胁迫的响应在很大程度上依赖于基因型的养分效率和养分资源类型。
缺铁胁迫会导致玉米根系形态发生一系列变化,从而影响根系对铁元素的吸收[9]。龙文靖等[9]研究表明,低铁处理下不同耐低铁玉米品种的根体积和根长显著低于高铁处理,与该试验中低铁处理与高铁处理相比下根体积和总根长显著减小结果相一致。李丽杰[18]研究表明,缺氮处理下的玉米根系总长度高于正常供氮处理,这可能是由于低氮胁迫下,植物为了适应缺氮逆境表现出来的根系适应性,从而尽可能多地吸收氮元素,保證自身的氮需求。高姝等[19]研究表明,低磷处理下的玉米总根长、根体积、根表面积高于正常供磷处理,这是玉米为了适应缺磷逆境表现出来的适应能力。该试验结果验证了López-Bucio等[20]的研究结果,为了应对缺素胁迫,通过根系形态的改变提高植物自身面对胁迫逆境的适应能力。Lynch等[21]认为植物通过改变根系的分布来增大根系的吸收面积,根系面积的增大表现为根长的增加、侧根的增多。孙曰波等[22]研究发现,与正常铁处理下相比,缺铁条件下的玫瑰幼苗根系表面积、总根长、平均根直径和根体积均有所增加,这是由于玫瑰幼苗根系在缺铁环境下主动吸收能力受到抑制,但根系表面积增大,扩大了根系与营养元素接触面积,提高了被动吸收能力,从而弥补了主动吸收对自身的影响。在该研究中,低铁胁迫与高铁处理相比,2种不同基因型玉米的根系总根长、根体积、根表面积均显著减少;但低铁处理显著增加了2个基因型玉米的平均根直径。石荣丽等[23]研究表明,不同基因型小麦在低铁胁迫下的根表面积不同。该试验结果表明,氮低效的玉米基因型ZD958比氮高效的玉米基因型XY335对低铁胁迫根系形态的响应更为敏感,氮低效型玉米ZD958能够更好地通过减小根直径、根体积、根表面积,提高自身平均根直径来适应逆境,更好地吸收铁元素以保证自身铁元素的需求。
研究表明,植物在缺铁条件下,叶片会发生黄化症,从而引起叶绿素含量降低,而叶绿素含量是判断植物缺铁的标准[24-26]。Donnini等[27]研究发现,不同基因型梨幼苗在缺铁处理下表现出叶片黄化症状,且不同基因型间有差异;任小平等[28]研究发现,不同基因型花生在低铁处理下,铁敏感型花生黄化症非常严重,而耐低铁基因型的花生黄化症较轻微,这与该试验结果类似。在缺铁环境下,2种不同基因型玉米叶片失绿,发生叶片黄化。殷文娟等[3]和Ciaffi等[4]研究发现,小麦植株叶绿素含量在供铁情况下显著高于不供铁小麦。在缺铁营养液中生长的黄瓜和大豆植物显示出高度褪绿叶和典型的Fe缺乏响应[13,29-30]。在缺铁处理下,大豆、红三叶草和木麻黄属的物种,叶绿素含量显著降低[13,31]。该试验验证了前人的研究结果,缺铁导致2种不同基因型玉米叶绿素含量下降,说明缺铁胁迫会引起植物叶绿素含量降低[32]。章爱群等[8]研究发现,低铁处理与对照组相比,显著降低了植物叶绿素含量,低磷敏感型玉米叶绿素含量的降幅稍高于耐低磷玉米叶绿素含量的降幅。但该研究发现,在低铁条件下,氮低效玉米基因型ZD958与氮高效玉米基因型XY335两者间无显著差异。
参考文献
[1] RODRGUEZCELMA J,LATTANZIO G,GRUSAK M A,et al.Root responses of Medicago truncatula plants grown in two different iron deficiency conditions:Changes in root protein profile and riboflavin biosynthesis[J].J Proteome Res,2011,10(5):2590-2601.
[2] KOBAYASHI T,ITAI R N,NISHIZAWA N K.Iron deficiency responses in rice roots[J].Rice,2014,7:1-11.
[3] 殷文娟,吴玉霞,刘泽军,等.小麦对缺铁胁迫的适应性反应[J].天津农业科学,2014,20(8):8-12.
[4] CIAFFI M,PAOLACCI A R,CELLETTI S,et al.Transcriptional and physiological changes in the S assimilation pathway due to single or combined S and Fe deprivation in durum wheat(Triticum durum L.)seedlings[J].J Exp Bot,2013,64(6):1663-1675.
[5] ZAMBONI A,CELLETTI S,ZENONI S,et al.Root physiological and transcriptional response to single and combined S and Fe deficiency in durum wheat[J].Environ Exp Bot,2017,143:172-184.
[6] DELLORTO M,DE NISI P,VIGANI G,et al.Fe deficiency differentially affects the vacuolar proton pumps in cucumber and soybean roots[J].Frontiers in plant science,2013,4:1-9.
[7] ZAID H,ARAHOU M,DIEM H G,et al.Is Fe deficiency rather than P deficiency the cause of cluster root formation in Casuarina species?[J].Plant soil,2003,248(1/2):229-235.
[8] 章愛群,斯琴朝克图,刘牛,等.低铁胁迫对不同耐低磷玉米生长及磷、铁养分吸收的影响[J].作物杂志,2014(6):111-115.
[9] 龙文靖,辜涛,万年鑫,等.低铁胁迫对玉米苗期根系生长和铁素吸收利用的影响[J].中国生态农业学报,2017,25(8):1163-1172.
[10] 李刚华,丁艳锋,薛利红,等.利用叶绿素计(SPAD-502)诊断水稻氮素营养和推荐追肥的研究进展[J].植物营养与肥料学报,2005,11(3):412-416.
[11] 张志良,瞿伟菁,李小芳.植物生理学实验指导[M].北京:高等教育出版社,2009:106.
[12] LIGABA A,SHEN H,SHIBATA K,et al.The role of phosphorus in aluminiuminduced citrate and malate exudation from rape(Brassica napus)[J].Physiol Plant,2004,120(4):575-584.
[13] ZOCCHI G,DE NISI P,DELLORTO M,et al.Iron deficiency differently affects metabolic responses in soybean roots[J].J Exp Bot,2007,58(5):993-1000.
[14] SHAH S R U,AGBACK P,LUNDQUIST P O.Root morphology and cluster root formation by seabuckthorn (Hippopha rhamnoides L.)in response to nitrogen,phosphorus and iron deficiency[J].Plant soil,2015,397:75-91.
[15] ZHENG S J,TANG C X,ARAKAWA Y,et al.The responses of red clover(Trifolium pratense L.)to iron deficiency:A root Fe(III)chelate reductase[J].Plant Sci,2003,164:679-687.
[16] 邱慧珍,張福锁.不同磷效率小麦对低铁胁迫的基因型差异[J].植物营养与肥料学报,2004,10(4):361-366.
[17] 赵婧,邱强,张鸣浩,等.低铁胁迫与大豆品种铁效率间的关系[J].中国农学通报,2016,32(30):49-55.
[18] 李丽杰.营养液培养条件下缺氮对玉米幼苗生长发育的影响分析[J].乡村科技,2017(20):56-57.
[19] 高姝,王治红,陆兰姣,等.低磷胁迫下玉米苗期根系特征及优良材料筛选[J].广西农学报,2017,32(6):6-9.
[20] LPEZBUCIO J,CRUZRAMIREZ A,HERRERAESTRELLA L.The role of nutrient availability in regulating root architecture[J].Curr Opin Plant Biol,2003,6(3):280-287.
[21] LYNCH J,BROWN K M.Ethylene and plant responses to nutritional stress[J].Physiol Plant,1997,100:613-619.
[22] 孙曰波,赵兰勇,张玲.缺磷和缺铁胁迫对玫瑰幼苗根构型的影响[J].中国农学通报,2011,27(8):132-135.
[23] 石荣丽,张福锁,邹春琴.不同基因型小麦铁营养效率差异及其可能机制[J].植物营养与肥料学报,2010,16(6):1306-1311.
[24] 高丽,史衍玺,周健民.不同耐低铁基因型花生铁营养特性的差异[J].土壤通报,2009,40(6):1393-1397.
[25] TAGLIAVINI M,ROMBOLà A D.Iron deficiency and chlorosis in orchard and vineyard ecosystems[J].Europ J Agrometeorol,2001,15(2):71-92.
[26] REDDY K B,ASHALATHA M,VENKAIAH K.Differential response of groundnut genotypes to iron deficiency stress[J].J Plant Nutr,1993,16(3):523-531.
[27] DONNINI S,DELL ORTO M,ZOCCHI G.Oxidative stress responses and root lignification induced by Fe deficiency conditions in pear and quince genotypes[J].Tree Physiol,2011,31(1):102-113.
[28] 任小平,姜慧芳,黄家权,等.水培条件下花生对缺铁的生理反应[J].植物遗传资源学报,2010,11(4):491-497.
[29] RABOTTI G,DE NISI P,ZOCCHI G.Metabolic implications in the biochemical responses to iron deficiency in cucumber(Cucucmis sativus L.)roots[J].Plant Physiol,1995,107(4):1195-1199.
[30] ESPEN L,DELL ORTO M,DE NISI P,et al.Metabolic responses in cucumber(Cucumis sativus L.)roots under Fedeficiency:A 31P-nuclear magnetic resonance invivo study[J].Planta,2000,210(6):985-992.
[31] ZHENG S J,TANG C X,ARAKAWA Y,et al.The responses of red clover(Trifolium pratense L.)to iron deficiency:A root Fe(III)chelate reductase[J].Plant Sci,2003,164(2003):679-687.
[32] COVARRUBIAS J I,RETAMALES C,DONNINI S,et al.Contrasting physiological responses to iron deficiency in Cabernet Sauvignon grapevines grafted on two rootstocks[J].Sci Hortic,2016,199:1-8.

