昼夜节律钟基因及TTFL 模型的发现历程
任衍钢 白冠军 宋玉奇 路彦文
(阳泉师范高等专科学校 山西平定 045200)
生物钟的研究源远流长。据记载,早在公元前4 世纪, 亚历山大大帝时期就有一位船长记录罗望子树叶昼夜开合的现象。 首次提到生物节律具有内源性(endogenous)的文献是在1729 年,法国天文学家梅朗(Mairan J.O.)发现含羞草的羽状复叶在完全黑暗的环境下仍然能保持24h 的开合周期, 这表明了生物的昼夜节律钟是并不依赖于环 境 中 的 光 照 等 外 界 环 境 条 件[1]。 1918 年,希 曼斯基(Szymansid J.S.)发现,没有外界光和温度的变化,动物仍然保持24h 的周期活动。 20 世纪50年代前对生物钟的研究是零星的、碎片化的,没有进行概念层次上的探讨。 1959 年, 时间生物学(chronobiology)创始人哈尔伯格(Halberg F.)首先引入“昼夜节律钟(circadian rhythm)”术语。 circadian 这个词来自拉丁语,由circa(大约)和diem(一天)合成,即昼夜的意思[2]。昼夜节律钟内源性机制的揭示是从模式生物果蝇开始的。
1 per 基因的发现及TTFL 模型的提出
早在1935 年,德国生物学家汉斯(Hans K.)和欧文(Erwin B.)首次各自独立地发现黑腹果蝇昼夜节律的存在。 1954 年,“生物钟之父”英裔美籍科学家培腾德瑞(Pittendrigh C.)在观察野生果蝇活动时发现, 果蝇在发育期总是在一天中特定的时间羽化。他通过观察果蝇发育的一系列行为,认为生物钟具有内源性且受遗传物质控制, 而不是由外界环境主导[3]。 正是这些初始的研究启迪后续学者在研究果蝇昼夜节律方面取得了划时代的突破。 果蝇作为模式生物研究的优点是: 个体小、繁殖快、易在实验室培养,染色体数目少,后代数量大,较容易发现突变类型,这就为发现控制昼夜节律钟的基因提供了有利条件。首先是美国遗传 学 家 康 诺 普 卡(Konopka R.)和 本 泽(Benzer S,康诺普卡是本泽的首位研究生)用甲基磺酸乙酯(EMS)处理黑腹果蝇(Drosophila melanogaster)诱导其基因组点突变,并在羽化期将其分离出来,然后调查2 000 只果蝇的昼夜节律钟。结果发现,这2 000 只果蝇中,大多数是12 h 活动,12 h 休息;但有3 种突变体具有异常节律,一种(perS)是9 h的周期,一种(perL)是8 h 的周期,还有一种(per0)似乎没有周期, 活动和休息的时间表现出随机交替。他们用传统的方法绘制出染色体图,发现这些昼夜节律钟突变型都处于X 染色体相同的位置,距白眼基因小于1 cM 的位点上,属于等位基因,因与昼夜节律钟有关,故命名为period(中文:周期;英文缩写per)基因。 1971 年,他们公布了研究结果,首次证实生物钟基因的存在[4]。这一发现被认为是步入生物钟研究新时代的里程碑。
per 如何为生物钟定时?1984 年,霍尔(Hall J.)和罗斯巴什(Rosbash M.)、杨(Young M.)2 个团队成功地分离了per 基因。 他们发现,perS和perL都是点突变,导致一个氨基酸发生改变(甲基磺酸乙酯的作用机制是使DNA 上的一个碱基发生转换,即A—G);per0则引入了一个终止密码子,导致蛋白质的翻译提前终止。 1988 年,霍尔和罗斯巴什发现per 基因编码的蛋白质——PER 蛋白, 此蛋白呈现出夜间累积而白天降解的昼夜节律变化。1990 年, 在罗斯巴什实验室工作的哈丁(Hardin P.E.)等,通过检测果蝇脑内的mRNA 发现per基因转录的mRNA 也呈现昼夜变化, 而且per mRNA 峰值出现的时间要比PER 蛋白峰值出现时间早几个小时。 他们依据per mRNA 和PER 蛋白都呈现的节律性变化,PER 过表达会抑制体内per mRNA 的翻译,并且此抑制作用表现出细胞负反馈调节[5],提出了果蝇生物钟的TTFL(Transcription-Translation Feedback Loop, 即转录–翻译反馈环路)模型[1](图1)。

图1 1990 年提出的果蝇昼夜节律TTFL 模型
2 per 基因的调控及TTFL 模型的深化
PER 蛋白如何进入细胞核内起作用? 1992年, 罗斯巴什实验室利用免疫电镜技术对per 基因的表达进行了亚细胞定位,发现PER 蛋白是定位 在 细 胞 核 内 影 响 生 物 节 律 的[6]。 1994 年,杨 实验室的普莱斯(Price J.L.)发现,位于果蝇2 号染色体上的一个基因也与昼夜节律钟有关, 这是继per 基因后,发现的第2 个生物钟基因——timeless基因(中文:永久;英文缩写tim),其编码正常昼夜节律钟所需的TIM 蛋白。 他们发现,per 基因与tim 基因表达的时间基本一致, 并发现当TIM 蛋白结合PER 蛋白之后,2 种蛋白质才能进入细胞核,在那里抑制per 基因的活性,这样图1 的模型更清晰(图2)。

图2 基于1994 年发现的tim 基因而深化的TTFL 示意图
这种调控机制虽然解释了细胞中PER 蛋白质水平与昼夜节律钟同步的变化, 但蛋白质水平变化的频率如何控制? 1997—1998 年,杨和他在洛克菲勒大学的团队在果蝇3 号染色体上发现了另一个基因——doubletime 基因(中文:双重时间或快步;英文缩写dbt)也参与了昼夜节律钟的活动,它所编码的DBT 蛋白可延缓PER 蛋白的累积。DBT 是一种蛋白激酶,在细胞质内对PER 进行磷酸化,使其稳定性降低,从而易于与TIM 结合。 两者结为异二聚体后性能稳定,进入细胞核[7]。 当TIM 被降解后,PER 会从复合物中暴露出来,被DBT 磷 酸 化, 促 使PER 蛋 白 在 细 胞 核 内 降 解[8]。这就进一步解释了PER 蛋白的水平变化如何与24 h 周期相匹配(图3)。

图3 基于1997 年发现的dbt 基因而深化的TTFL 示意图
激活per 和tim 基因的起始点是什么?这个秘密首先是在模式生物小鼠身上揭开的。 1994 年,日本出生的美籍神经科学家高桥(Takahashi J.)和他的团队发现,在数周持续的光照下,一种失去昼夜节律钟的纯合突变小鼠会转录一种mRNA,翻译成CLOCK(时钟)蛋白,并与另一个基因DNA链结合,激活per 基因。 1998 年,霍尔和罗斯巴什等通过遗传基因筛选, 在果蝇3 号染色体上也找到了与小鼠clock 基因同源的dClock 基因(中文:钟,缩写为Clk 或jrk 基因)。 他们发现,dClock 基因突变会延长TTFL 环路的周期, 并且这些突变导致果蝇PER 和TIM 蛋白含量降低,这在果蝇中不仅激活per 基因,而且激活tim 基因[9]。此外,研究人员还在3 号染色体上发现了一种被称作cycle(中文:循环,缩写为cyc)的基因(与小鼠的bmal基因同源),它翻译成的蛋白能与CLOCK 蛋白结合形成二聚体激活per 和tim 基因。
幸运的是另一个一直困惑科学家的问题也几乎同时得到解释, 这就是环境光强度对昼夜节律钟的影响。 1996 年,塞加尔(Sehgal A.)实验室发现果蝇TIM 蛋白可被光降解, 在光照之后PERTIM 蛋白复合体的数量很快地下降。 1997—1998年, 霍尔实验室的科学家在对果蝇的研究中进一步发现,CRY 蛋白(Cryptochrome,亦叫隐花色素,发现于20 世纪50 年代,由于含量低,直到1993年科学家才用遗传学克隆的方法在拟南芥中证实)能与PER/TIM 复合体中的TIM 作用, 促进TIM 蛋白的降解,这样可以防止TIM 蛋白与PER 蛋白结合抑制tim 和per 基因,从而减少抑制蛋白的数量[10]。 由此可见,DBT 蛋白和CRY 蛋白起到了相反的调控TIM-PER 异二聚体的作用,隐花色素被认为具有起搏器的作用。 这样也很好地解释昼夜节律钟内因与外因的关系, 即生物钟在外界环境影响下如何调控昼夜节律钟的自行运转(图4)。
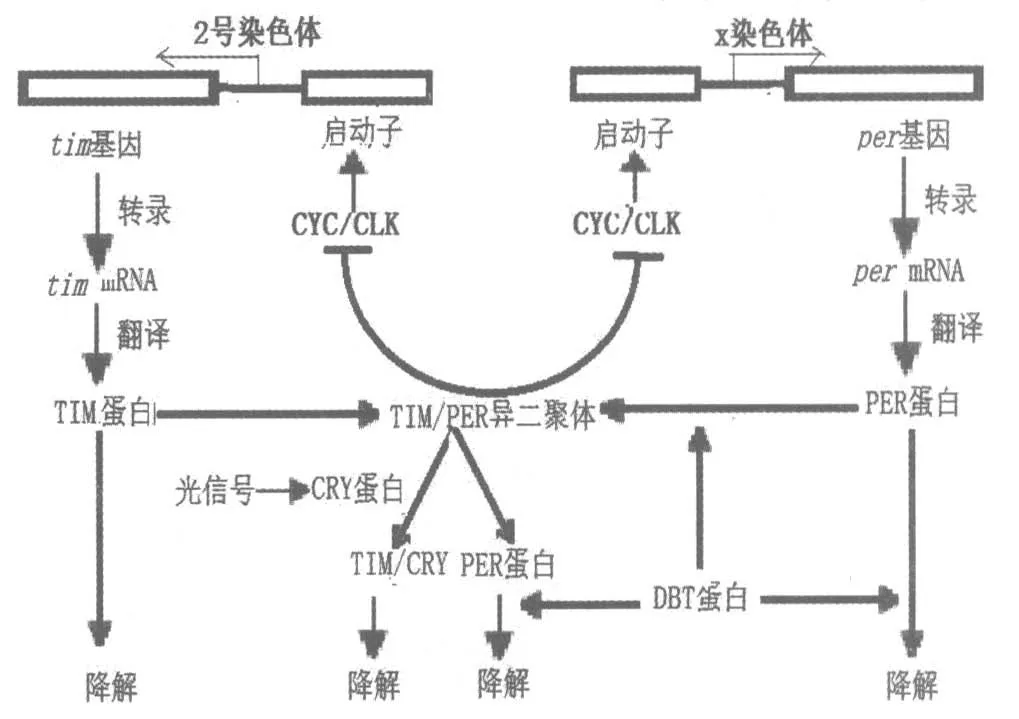
图4 基于1998 年发现的cyc 和cry 基因而深化的TTFL 示意图
在发现上述果蝇生物钟反馈调控的同时,还发现了另一个生物钟反馈环路, 这是基于一对等位基因vrille(中文:旋转,缩写为vri)的发现。1997 年, 乔治 (George H) 和泰拉科尔(Terracol R.) 在用甲基磺酸乙酯诱变技术分析果蝇胚胎发育时, 发现有一个转录因子涉及昼夜节律钟的活动。 1999 年,伯劳(Justin Blau)发现该转录因子影响CLK/CYC 复合体的功能, 这个转录因子就是VRI 蛋白。 这其中还涉及到另一个转录因子是PDP(Pyruvate dehydrogenase phosphatase 的 缩 写,即丙酮酸脱氢酶磷酸酶)。 PDP 对clk 基因转录有正向的激活作用, 而VRI 对dClk 有负向的抑制作用,当然也对CLK/CYC 复合体起到抑制作用。 这样,由于CLK/CYC 的抑制,PER/TIM 降低了CLK/CYC 的抑制作用, 除per-tim 回路外, 还有一个dClk 回路(这里d 是表示英文果蝇的第1 个字母)(图5)。

图5 果蝇per-tim 和dCLK 回路简图[11]
3 果蝇与其他模式生物昼夜节律钟研究的相互促进
需要指出的是,TTFL 模型的揭示决不是仅限于对果蝇的研究, 而是与其他模式生物的研究相互印证的。 哈丁等在1990 年提出的TTFL 模型并没有解决是mRNA 翻译的蛋白质直接作用还是通过其他生化信号间接影响的问题。 1994 年,阿伦森(Aronson B.D.)等通过对面包霉(Neurospora crassa)的研究才确定是PER 蛋白能自动调节自己的转录[12]。 在昼夜节律钟的研究中,除果蝇外,模式生物小鼠的贡献同样显著。 1994 年,科学家用类似研究果蝇节律基因突变的筛选方法首先描述了小鼠昼夜节律基因的突变。 1997 年,受此影响突变的基因成为第1 个被克隆的哺乳动物生物钟基因。随后,小鼠昼夜节律基因的研究获得迅速的进展, 这些基因与昼夜节律基因果蝇基因的相似性(指核苷酸序列)也被鉴定出来。 科学家发现,它们之间一些功能是相同的,但亦存在一些差异[13]。例如在小鼠中,CRY 蛋白是与PER 蛋白结合,形成PER/CRY 复合体,而不是像果蝇那样,与TIM蛋白结合,形成TIM/CRY 复合体。 故果蝇是间接激活per 基因的转录, 但在小鼠中则是抑制该基因的表达,两者作用相反。图6 是从20 世纪70 年代始至20 世纪末果蝇和小鼠在昼夜节律钟研究中的比较图。从图中可见,生物钟的研究主要体现在表型和生理学、基因克隆2 个方面。 在表型、生理学方面,科学家发现了果蝇一系列的突变体、外侧神经元起搏点和外部振荡器; 而在小鼠中则发现了视交叉上核的中心作用、 独立的视网膜时钟和外部振荡器等; 在基因克隆方面则是克隆了一系列的突变基因, 果蝇与小鼠昼夜节律钟的基因克隆几乎都集中在20 世纪90 年代下半期, 基因克隆技术的应用, 成为了揭开生物钟分子机制的关键[14](图6)。

图6 1970—2000 年果蝇与哺乳动物昼夜节律基因研究中的重要事件[14]
表1 是有关学者对小鼠与果蝇中其他涉及到昼夜节律钟基因突变的表型作出的相互比较,这也证明了TTFL 模型具有共性。
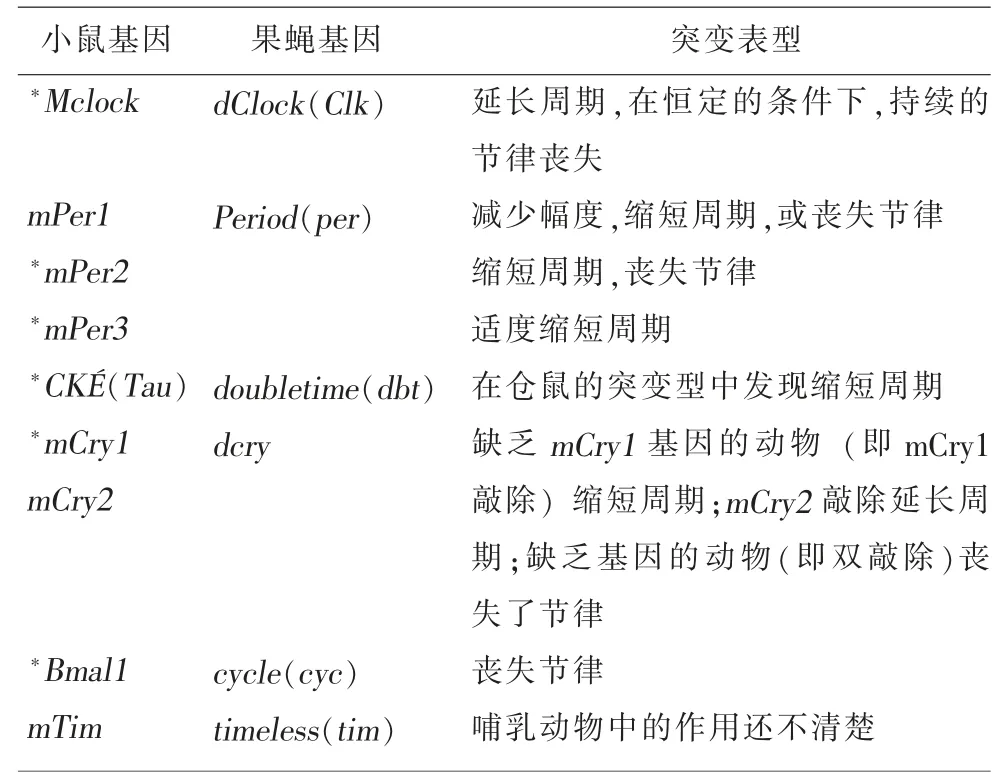
表1 果蝇与小鼠昼夜节律钟基因突变基因和表型的相互比较[13]
需要补充的是,进入21 世纪以后,科学家的兴趣逐渐从对模式生物果蝇昼夜节律钟的研究转移到模式生物小鼠上, 主要成果在Bmal 基因研究方面:2000 年,邦杰(Bunger M.K.)通过第1 个Bmal1基因敲除发现,BMAL1 蛋白对节律维持必不可少;2006 年,孔德拉托夫(Kondratov R.V.)进一步发现,Bmal1 基因敲除会使小鼠生命缩短;2015年,利普顿(Lipton J.O.)发现BMAL1 蛋白S42 位点被S6k1 周期磷酸化调控蛋白质合成。 此外,2006 年,正 雄(Masao D.)和 平 山(Hirayama J.)在发 现CLOCK 蛋 白 是 一 种 组 蛋 白 乙 酰 酶[15]。 2008年,阿舍(Asher G.)发现SIRT1 通过去乙酰化参与对per2 基因的调控[16]。 可见,模式生物小鼠对TTFL 模型的贡献并不亚于果蝇。
综上所述, 生物钟研究有利于准确地揭示生命现象的规律及内在机制,通过研究生物钟,如今已产生了时辰生物学、 时辰药理学和时辰治疗学等新学科,这不仅在医学上有着重要的意义,而且对生物学的基础理论研究起着巨大的促进作用。果蝇昼夜节律钟分子机制及负反馈机制的发现,为科学家研究其他生物和人类生物钟起到了先导作用。TTFL 模型的揭示主要是运用了基因克隆技术和基因与蛋白质昼夜间的振荡表达的量化分析及各种模式生物之间的相互印证。霍尔、罗斯巴什和杨因发现控制昼夜节奏的分子机制分享了2017 年的诺贝尔生理学或医学奖。 当然,生物钟中还有许多秘密有待进一步揭开, 期待科学家的下一个研究成果。

