不同品种紫花苜蓿氮代谢的Cd耐性评价及其鉴定指标筛选
杨 姝,祖艳群,李 博,毕玉芬,何永美,贾 乐,李 元*
(1.云南农业大学资源与环境学院,昆明 650201;2.云南农业大学理学院,昆明650201;3.云南农业大学动物科学与技术学院,昆明 650201)
由于采矿业、汽车工业和农业的快速发展,目前我国土壤镉(Cd)污染问题较为严峻,其点位超标率达7.0%,在8种无机污染物中位列第一[1]。重金属Cd是一种植物非必需元素[2],在较低水平下就能影响植物的生长及生理生化过程[3]。氮代谢是植物的重要生理过程之一,决定了植物的产量和品质[4]。Cd胁迫会影响植物的氮代谢过程[7],导致硝酸还原酶(NR)活性受到抑制[5],进而减缓硝态氮的同化过程[6]。Cd胁迫也会影响谷氨酰胺合成酶(GS)、谷氨酸合酶(GOGAT)和谷氨酸脱氢酶(GDH)的活性[7-8],从而导致氨态氮含量的变化[9]及一系列连锁反应,包括株高和生物量的变化[10]。此外也发现,一些氮代谢产物如脯氨酸、GSH和PCs在植物的Cd耐性方面起着非常重要的作用[11]。
紫花苜蓿(Medicago sativaL.)是一种优良牧草,其氮代谢过程会受Cd胁迫的影响[12]。如Cd胁迫降低了“甘农3号”苜蓿籽苗中可溶性蛋白的含量[13]。对叶片中脯氨酸含量的研究表明,随着Cd胁迫浓度的增加,“新疆大叶”苜蓿的脯氨酸含量呈现先升后降的趋势[14],而在相同Cd浓度的胁迫下,“新疆大叶”的脯氨酸含量大于“阿尔冈金”[15]。此外,也有研究发现紫花苜蓿的氮代谢过程与其产量和品质有相关性[4],表明氮代谢过程的Cd耐性可能是紫花苜蓿Cd耐性的一个重要表现方面。
本研究以20个紫花苜蓿品种为植物材料,以Cd胁迫前后11个氮代谢相关指标的变化率作为分析的数据基础,应用主成分分析法和隶属函数法得到综合评价值并对20个品种氮代谢的Cd耐性进行评估,同时利用多元线性回归法构建各单项指标与综合评价值之间的数学模型,筛选出最能体现氮代谢Cd耐性的评价指标,以构建紫花苜蓿氮代谢Cd耐性的评价体系,为筛选紫花苜蓿的耐Cd品种及Cd污染土壤的治理及综合利用提供研究材料和研究模型。
1 材料与方法
1.1 试验材料
盆栽用土壤取自昆明市云南农业大学农场(25°14′30″N,102°56′27″E),红壤土,pH值6.83,有机质含量为30.18 g·kg-1,全氮含量为2.68 g·kg-1,碱解氮含量为56.73 mg·kg-1,全磷含量为14.21 g·kg-1,速效磷含量为 82.83 mg·kg-1,全钾含量为 16.06 g·kg-1,速效钾含量为521.76 mg·kg-1,总Cd含量0.38 mg·kg-1,土壤过筛备用。选用的紫花苜蓿品种如表1所示,由云南农业大学动科院草业科学实验室提供,挑选大小一致且籽粒饱满的种子,用10%H2O2进行表面消毒10 min,再用蒸馏水冲洗多次后晾干备用。
1.2 试验设计
使用圆形塑料花盆(高45 cm,口内径40 cm),每盆装土9 kg,在土壤中加入研成粉末状的CdCl2·2H2O拌匀,使土壤Cd含量分别为0(CK)和50 mg·kg-1。按10 g·盆-1的量加入生石灰粉末拌匀调节土壤pH值至中性。按5 g·盆-1的量施入复混通用肥(N 10%,P2O510%,K2O 5%)作为底肥,用去离子水调节土壤含水量至最大持水量的60%左右,平衡两周。按8粒·盆-1的播种量,将苜蓿种子均匀撒播于盆内,待出苗至株高10 cm时,每盆留5株,其余间去。生长期间常规管理,待生长至100 d时进行指标测定。每个处理设3个重复,共计120盆,随机排列放置于云南农业大学温室大棚。
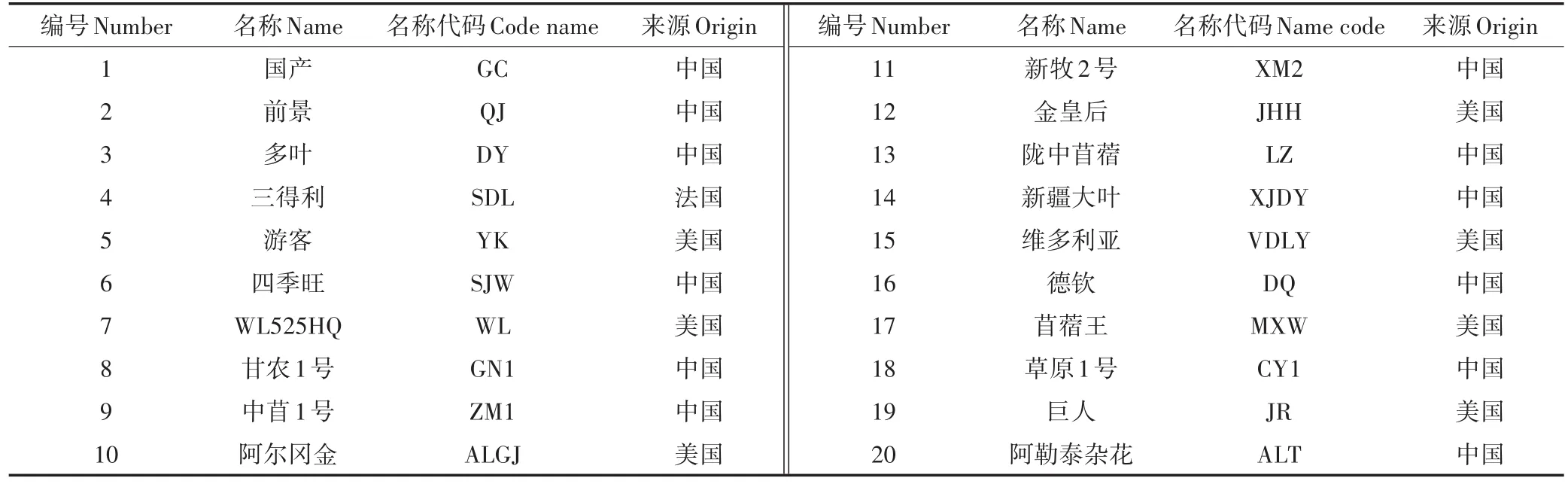
表1 苜蓿品种名称及来源Table 1 Origin and name of alfalfa varieties
1.3 取样与测定
待植株生长至100 d时,测定株高。以盆为单位收获植株,用蒸馏水洗净晾干表面水分后,测定其生物量。叶片鲜样中氮代谢关键酶(NR、GS、GOGAT、GDH)活性使用酶活性测定试剂盒(Solarbio,北京索莱宝科技有限公司)测定。叶片鲜样中硝态氮含量采用5%硫酸-水杨酸提取比色法测定[4,11],总游离氨基酸采用茚三酮溶液显色法测定[16],可溶性蛋白采用考马斯亮蓝法测定[17],脯氨酸含量采用酸性茚三酮法测定[18]。整株鲜样放入真空干燥箱内105℃杀青30 min,而后将温度调至70℃烘至恒质量,研磨干样至粉末状并过筛后,使用凯式定氮法测定植株总氮含量[19]。
1.4 数据处理
试验数据采用Microsoft Excel进行常规计算及分析,相关性分析、主成分分析和多元线性回归分析采用SPSS软件处理。

式中,RCi为第i个品种在Cd胁迫下的指标变化率。Uij为第i个品种在j公因子中的隶属函数值,Cij表示第i个品种在第j个公因子中的得分,Cmin表示所有品种在第j个公因子中的最小得分,Cmax表示所有品种在第j个公因子中的最大得分。Wj为第j个公因子的权重系数,Pj为第j个公因子的贡献率。Di为第i个品种的综合评价值。下标i表示受试紫花苜蓿品种的编号,取值为1,2,3,…20,下标j指主成分分析提取的公因子数(主成分数),在本论文中的取值为1、2。
2 结果与分析
2.1 Cd胁迫下紫花苜蓿氮代谢指标的变化率
在外源添加Cd浓度为50 mg·kg-1时,与对照相比,20个紫花苜蓿品种的株高、生物量、氮含量、氮代谢酶活性、可溶性蛋白含量、游离氨基酸含量、脯氨酸含量和硝态氮含量等11个指标均有不同程度的变化(图1)。其中,株高增加最大的品种是“巨人”(58.18%),而减少最大的品种是“中苜1号”(-24.94%)。从生物量看,增加和降低幅度最大的品种分别是“新牧2号”(58.64%)和“游客”(-21.04%)。结果显示,全氮含量的变化范围在16.04%~-30.01%之间,增加最大的品种为“苜蓿王”,而减小最大的品种为“多叶”。从可溶性蛋白含量看,品种“德钦”增加最多,增幅达36.18%,而品种“四季旺”降幅最大,达-34.85%。各品种游离氨基酸含量也有较大变化,其中增幅最大品种是“前景”,达49.60%,而降幅最大品种为“多叶”,达-45.52%。脯氨酸含量的变化范围为89.63%~-35.76%,最大增幅和降幅的品种分别为“国产”和“中苜1号”。硝态氮含量变化幅度也较大,其中增幅最大和降幅最大的品种为“WL525HQ”和“金皇后”,其值分别达122.24%和-68.30%。氮代谢关键酶NR、GS、GOGAT和GDH活性的指标变化率范围分别为66.68%(新牧2号)~-83.00%(WL525HQ)、76.36%(草原1号)~-45.71%(三得利)、97.79%(国产)~-73.22%(游客)和75.44%(国产)~-74.97%(WL525HQ)。
2.2 各氮代谢指标间的相关性分析
分析20个紫花苜蓿品种在Cd胁迫下各项指标变化率的相关性(表2)。结果显示,在株高、生物量、全氮含量、NR活性和GOGAT活性这5个指标之间,两两均呈极显著正相关关系(P<0.01),GS活性与可溶性蛋白含量、脯氨酸含量之间互呈显著正相关关系(P<0.05)。而硝态氮含量则与株高、生物量、全氮含量、游离氨基酸含量、NR活性、GS活性和GOGAT活性呈极显著负相关关系(P<0.01),与可溶性蛋白含量、脯氨酸含量和GDH活性呈显著负相关关系(P<0.05)。此外,GDH活性与GOGAT活性之间呈极显著正相关关系(P<0.01),与全氮含量、可溶性蛋白含量、游离氨基酸含量和脯氨酸含量呈显著正相关关系(P<0.05)。
2.3 主成分分析
使用SPSS软件对20个品种中11个指标的变化率进行主成分分析并提取关键因子(表3)。结果表明,第一主成分的特征根为7.376,贡献率达67.053%,第二主成分的特征根为1.007,贡献率为9.158%,从第三主成分开始,其特征根均小于1。第一和第二主成分的累积贡献率达76.212%,已大于75%,因此可将原有的11个指标降维整合为2个因子,这两个因子是新的相互独立的综合指标,能概括原始指标携带的绝大部分信息。
由成分得分系数发现(图2),主成分1的值与指标株高、生物量、全氮、NR和GS呈正相关关系,而与指标游离氨基酸、可溶性蛋白、脯氨酸、硝态氮、GOGAT和GDH呈负相关关系,其中株高、生物量和GDH的载荷较大,分别为0.329、0.306和-0.327。主成分2的值与全氮、可溶性蛋白、游离氨基酸、脯氨酸、硝态氮、NR、GOGAT和GDH呈正相关关系,而与株高、生物量和GS活性呈负相关关系,其中可溶性蛋白、游离氨基酸和GDH的载荷较大,分别为0.247、0.293和0.512。
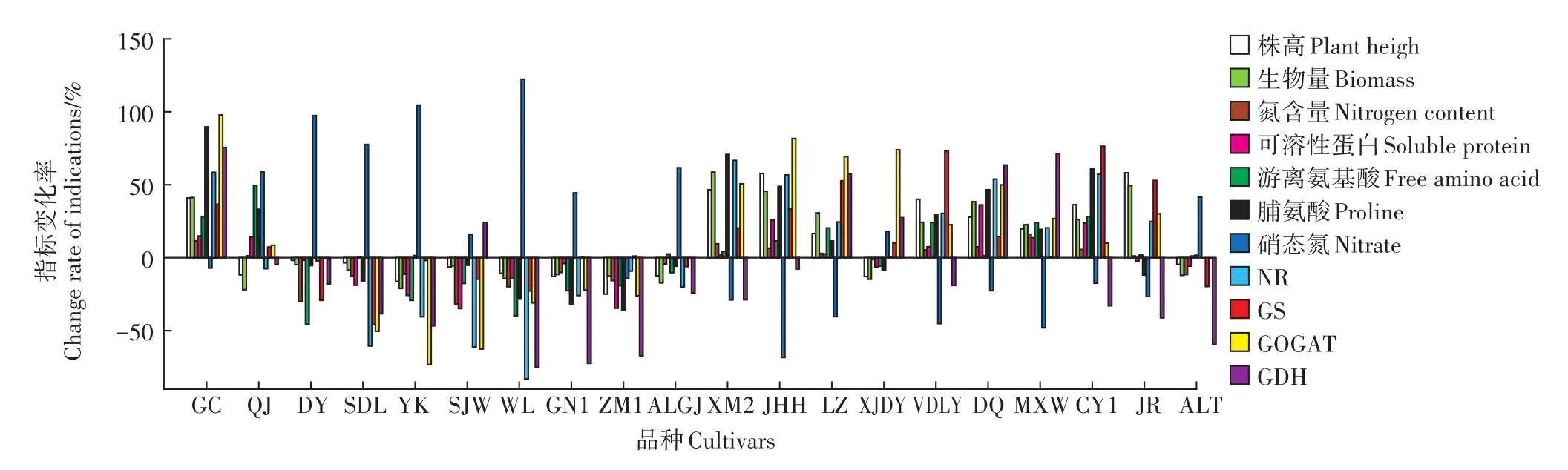
图1 Cd胁迫下20个紫花苜蓿品种的指标变化率Figure 1 Index change rates of 20 alfalfa cultivars under Cd stress
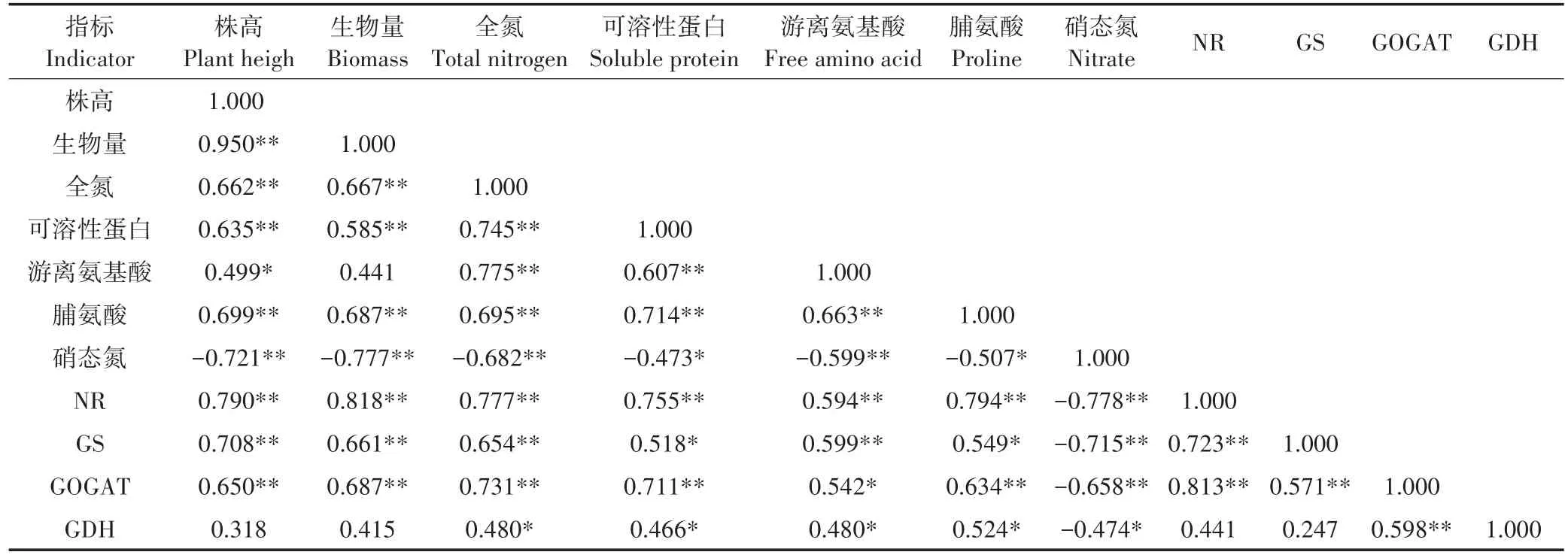
表2 Cd胁迫下20个紫花苜蓿氮代谢相关指标变化率的相关性分析Table 2 Correlation analysis of indicators change rate in nitrogen metabolism of 20 alfalfa cultivars under Cd stress
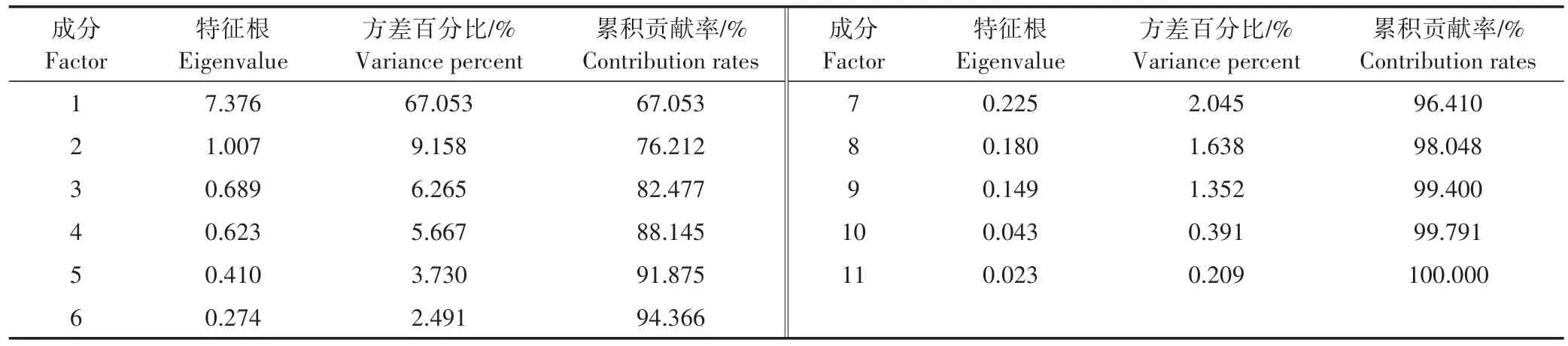
表3 主成分的特征根和贡献率Table 3 Eigenvalue and contribution rates of principal components
2.4 Cd耐性综合评价
根据成分得分系数,各品种在两个因子中的分值(Cij)计算函数分别为:
Ci1=0.329×株高+0.306×生物量+0.004×全氮-0.065×可溶性蛋白-0.113×氨基酸-0.021×脯氨酸-0.223×硝态氮+0.164×NR+0.295×GS-0.009×GOGAT-0.327×GDH
Ci2=-0.210×株高-0.182×生物量+0.180×全氮+0.247×可溶性蛋白+0.293×氨基酸+0.200×脯氨酸+0.092×硝态氮+0.001×NR-0.187×GS+0.189×GOGAT+0.512×GDH
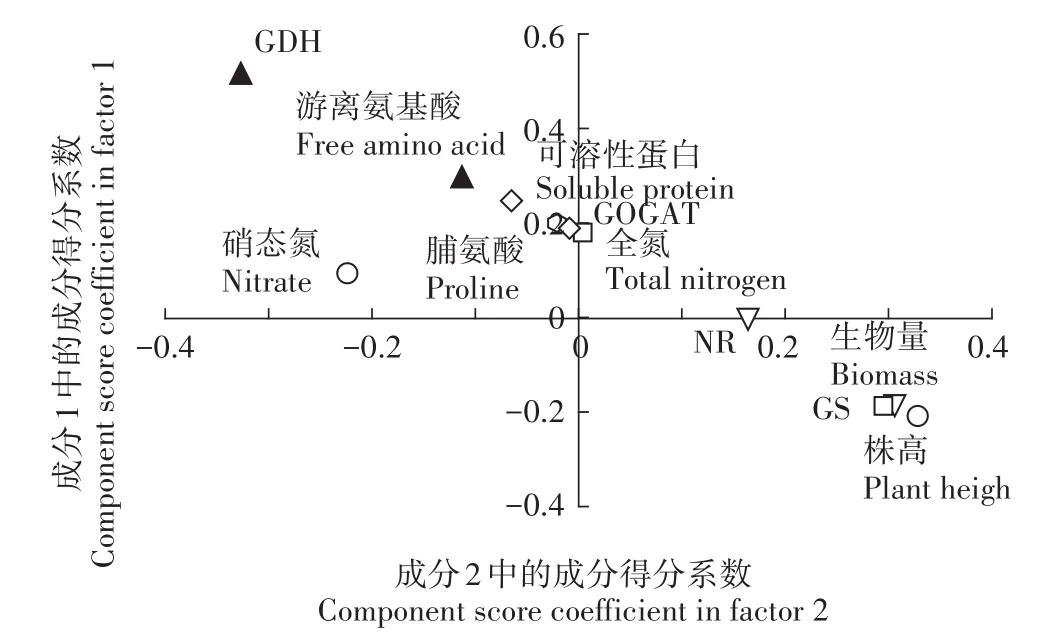
图2 氮代谢相关指标的成分得分系数Figure 2 Component score coefficient of nitrogen metabolismrelated indicators
利用公式(3)得出主成分1和主成分2的权重系数分别为0.880和0.120。在此基础上,根据公式(2)和(4)计算出各品种的隶属函数值(Uij)和综合评价值(Di)(表4)。结果显示,在20个品种中,“巨人”的Di值最大,为0.89,表明其氮代谢具有最强的耐Cd性。其后依次为“金皇后”“新牧2号”“草原1号”“维多利亚”和“陇中苜蓿”,它们的D值分别为0.87、0.84、0.81和0.80,说明它们的氮代谢均具有相对较高的耐Cd性。而“三得利”“WL525HQ”“四季旺”和“游客”几个品种的Di值均小于0.1,表明其氮代谢对Cd的胁迫较为敏感。
2.5 D值的回归模型及评价指标筛选
为分析各指标变化率与试验品种Cd耐性间的关系,筛选较为可靠的紫花苜蓿Cd耐性鉴定指标,以Cd耐性综合评价值(D)作为因变量,把在Cd胁迫下各单项指标的变化率视为自变量,开展多元线性逐步回归分析,得到相应的回归方程:
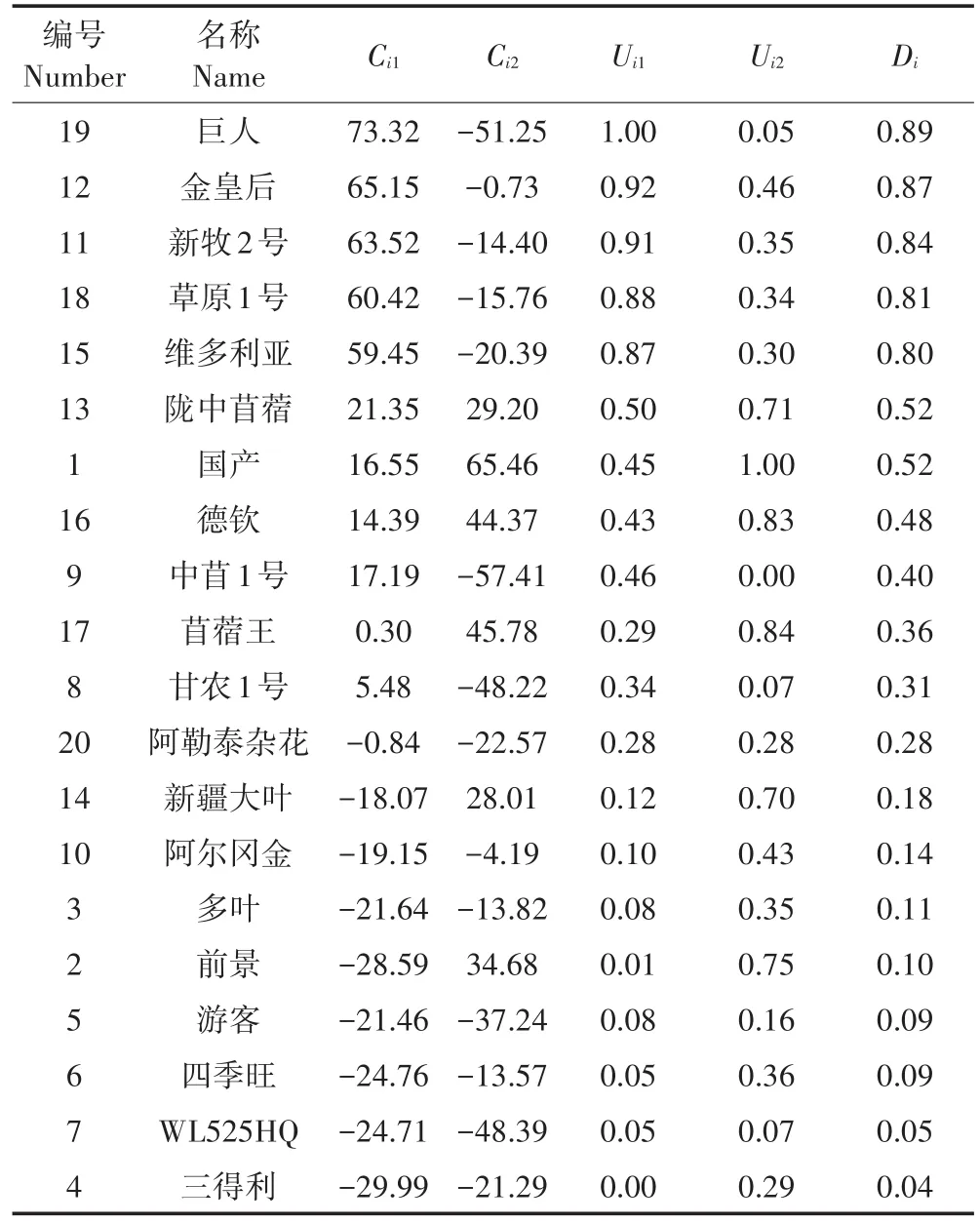
表4 20个紫花苜蓿品种氮代谢指标的主成分得分和综合得分Table 4 Principal component scores and synthesis score of 20 alfalfa cultivars
D=0.331+0.002×株高+0.002×GS-0.002×GDH-0.002×硝态氮+0.001×NR+0.003×生物量
其中,方程决定系数R2=0.999,P=0.000。从方程中发现,株高、GS、GDH、硝态氮、NR和生物量这6个指标对D值有显著影响,即这6个指标的变化率能较好体现紫花苜蓿氮代谢对Cd胁迫的耐性,通过该方程计算Cd耐性综合评价值(D),可初步预测不同紫花苜蓿品种氮代谢对Cd胁迫的耐性。
3 讨论
研究表明,Cd胁迫下紫花苜蓿的株高、根长、根质量、地上部质量等指标会发生变化[20],这种变化存在品种差异,一些耐性强的品种表现为增加,而一些耐性弱的品种表现为降低[21]。在本试验中Cd胁迫导致9个品种的株高增加而11个品种的株高下降,生物量的变化趋势与此相同,说明紫花苜蓿对Cd的耐性可较直观地通过株高和生物量指标的变化率表现出来。在Cd胁迫下,植物的生长会因氮同化酶(NR、NiR、GS)活性受到抑制而减缓[14],对紫花苜蓿的研究则发现其氮含量对其生物量的形成有着直接的影响[22]。在本试验中,Cd处理后20个品种的株高变化率和NR、GS、GOGAT活性变化率均呈显著正相关关系(P<0.01),20个品种的生物量变化率和NR、GS、GOGAT活性变化率及总氮含量变化率之间也呈显著正相关关系(P<0.01),这与前人研究结果相符。表明Cd胁迫对紫花苜蓿生长的影响可能是通过对氮代谢过程的影响来实现的。
脯氨酸、游离氨基酸和可溶性蛋白是氮代谢过程的重要代谢产物。通过抗脂质过氧化、保护酶活性和维持生物膜完整性,脯氨酸能够调节渗透压以应对Cd胁迫[23],本研究发现,20个品种的脯氨酸含量变化率与株高和生物量变化率均呈显著正相关关系(P<0.01),这也印证了Cd胁迫条件下,紫花苜蓿可通过体内脯氨酸含量的增加来抵御Cd毒[18]。Cd胁迫也会影响植株中游离氨基酸和可溶性蛋白的含量[16,24],游离氨基酸含量的增加有利于植物对逆境的抵御,可溶性蛋白含量的增加有助于维持细胞代谢的正常进行,还可能合成一类能与Cd特异结合的蛋白质或多肽,从而减轻毒害[25]。在本试验中,20个品种的游离氨基酸含量变化率与总氮含量变化率呈显著相关(P<0.01),可溶性蛋白含量变化率与株高、生物量和总氮含量变化率均呈显著正相关(P<0.01),也验证了前人研究结果。可见,氮代谢过程产物脯氨酸、游离氨基酸和可溶性蛋白可作为考察紫花苜蓿Cd耐性的重要指标。在相同浓度的Cd胁迫下,Cd耐性强的品种其脯氨酸、游离氨基酸和可溶性蛋白含量相对较高。
氮代谢过程的Cd耐性是紫花苜蓿Cd耐性的一个重要表现方面。氮代谢过程的相关指标可作为评估紫花苜蓿Cd耐性的重要参考依据。氮代谢过程非常复杂,所涉及的指标也较多[8],且指标与指标之间也存在着相互联系和相互影响的关系,因此不能片面地采用某个单一指标对紫花苜蓿氮代谢的Cd耐性进行评估。只有将多个具有代表性的指标进行综合分析,其结果才具有一定的说服力和可借鉴性[26]。主成分分析可将原来数量较多的单项指标转换成新的个数较少且彼此独立的综合指标,进一步利用模糊数学的隶属函数分析法求出各综合指标评价值(D值)[27],比较客观地反映各参试品种的Cd耐性。在本实验中,紫花苜蓿的11个氮代谢相关指标被转换成2个新的相互独立的综合指标,这2个指标概括了原始指标携带的绝大部分信息,结合隶属函数法,可以较为方便地对紫花苜蓿氮代谢的Cd耐性进行评估。
4 结论
氮代谢过程的Cd耐性可作为衡量紫花苜蓿Cd耐性的一个重要依据。11个氮代谢相关指标经主成分分析降维为2个新的独立的指标,以此计算得到的综合评价值(D)显示品种“巨人”和“三得利”分别具有最强和最弱的氮代谢Cd耐性。D值的线性回归分析显示株高、GS、GDH、硝态氮、NR和生物量6个单项指标可作为评价紫花苜蓿氮代谢Cd耐性的主要指标,为紫花苜蓿Cd耐性品种的筛选与鉴定提供依据和数学模型。

