视黄醇对仔猪睾丸支持细胞体外生物学特性的影响
邓嘉强,钟丽君,刘欢欢,曹随忠,沈留红,余树民
(四川农业大学 动物医学院,四川 成都 611130)
视黄醇(维生素A)是一类常见的脂溶性物质,视黄醇及其主要衍生物是维持机体生命活动、正常生理功能的必需化合物,具有促氧化和抗氧化的双重效应[1]。已有研究表明,视黄醇及其活性衍生物通过影响哺乳动物睾丸支持细胞(sertoli cell,SC)增殖发育和精原细胞减速分裂周期对雄性动物精子发生和睾丸发育发挥重要调控作用[2-4]。视黄醇缺乏或过量,均会引起睾丸病变和精子发生障碍[4-5]。
支持细胞是睾丸曲细精管上皮的主要组成细胞,为发育中的雄性生殖细胞提供微环境和免疫保护功能[6-8],支持细胞在调控睾丸发育[9]、精子发生[10]、精原干细胞(spermatogenial stem cells,SSCs)增殖和分化等过程中均具有不可或缺的作用[11-12]。研究发现,初情期前期睾丸支持细胞可以通过合成和分泌一系列细胞因子调节SSCs增殖和分化[13],如胶质源性神经营养因子(glial cell line-derived neurophic factor,GDNF)[14-15]、白血病抑制因子(leukemia inhibitory factor,LIF)[16]、干细胞因子(stem cell factor,SCF)[17]、碱性成纤维细胞生长因子(basic fibroblast growth factor,FGF2)[18]等。支持细胞是睾丸内视黄醇及其衍生物作用的最主要靶细胞,视黄醇通过支持细胞介导,在雄性动物生殖功能中发挥重要调控作用[8],因此其常被选作研究视黄醇调节雄性动物生殖功能的体细胞。目前对于视黄醇作用支持细胞的研究主要集中于裂齿动物[2-3],对仔猪睾丸支持细胞生物学功能的研究较少。本试验在体外条件下添加视黄醇,通过分析支持细胞活性、增殖及凋亡相关基因的表达和细胞因子转录和分泌情况,评价视黄醇对仔猪睾丸支持细胞的体外生物学特性的影响,为进一步阐明视黄醇在支持细胞内的代谢,以及视黄醇通过支持细胞介导调控雄性动物生殖机能提供理论依据。
1 材料与方法
1.1 材料
3~5周龄仔猪睾丸样品取自于雅安某规模化猪场。
CCK-8试剂盒,日本Dojindo Laboratories公司;Cell AmpTMDirect RNA prep Kit for Real Time RT-PCR,宝日医生物技术(北京)有限公司;全反式视黄醇,美国Sigma公司;FBS和DMEM高糖培养基,美国Gibco公司;IV型胶原酶、胰蛋白酶、透明质酸酶和DNase I酶,美国Amresco公司;高纯总RNA快速提取试剂盒,北京百泰克生物技术有限公司;PrimeScriptTMRT reagent Kit和Premix TaqTM,宝日医生物技术(北京)有限公司;ELISA试剂盒,美国Rapidbio公司。
1.2 方法
1.2.1 仔猪睾丸支持细胞的分离纯化
无菌采集仔猪睾丸,置于无菌PBS中,75%酒精浸泡3 min,去除附睾和白膜后,取实质剪成l~2 mm3大小。参照文献[19],剪碎的组织先用0.25% IV型胶原酶和0.1%透明质酸酶共同消化60 min,再用0.25%胰蛋白酶和0.1% DNase I共同消化20 min,经过滤、离心和洗涤后,将细胞沉淀用含10% FBS的DMEM重新悬浮。最终以(0.5~1)×106cells·mL-1接种于6孔培养板培养2 h后,收集悬液接种培养5~6 h,移除悬浮细胞,用20 mmol Tris-HCl处理5 min,洗涤后添加新鲜培养液继续培养,将细胞培养至第3代,用于后续试验。
1.2.2 CCK-8检测支持细胞活性
取对数生长期细胞,以(6~8)×104cells·mL-1接种于96孔板,每孔100 μL,过夜培养后更换培养液,分别添加浓度为0、0.005、0.025、0.125、0.625、1.250、2.500、5.000和10.000 μmol·L-1的视黄醇,不添加视黄醇的作为空白对照,每组3个重复,培养24 h和72 h后分别用CCK-8试剂盒检测细胞活力,以培养72 h后显著抑制细胞活性的视黄醇最小浓度绘制支持细胞生长曲线。
1.2.3 RT-PCR检测支持细胞增殖和凋亡相关基因表达
取对数生长期支持细胞,以(6~8)×104cells·mL-1接种于96孔板,每孔100 μL,过夜培养后更换培养液,实验组添加1.250 μmol·L-1视黄醇,对照组(C)不做任何处理,每组设置3个重复,在培养12 h、3 d和5 d后分别抽提细胞总RNA,经反转录和扩增后,进行凝胶电泳,经凝胶成象仪成象,分析细胞增殖相关基因(PCNA、C-MYC和BCL-2)和凋亡相关基因(CASP3和BAX)表达情况。PCR引物序列参见表1,凝胶成像结果用Image J进行灰度值分析,用GAPDH标准化蛋白表达量,以目的基因灰度值与GAPDH的灰度值比值作为其相对表达量。
1.2.4 支持细胞中细胞因子转录与合成检测
获取对数生长期支持细胞,以2×105cells·mL-1接种于96孔板。在基础培养液(含10%FBS)中培养2 d,更换含5% FBS培养液,对照组(C)不添加视黄醇,试验组添加1.25 μmol·L-1视黄醇,分别于培养24 h和72 h后取样,每组3个重复,对基因GDNF、LIF、CSF-1、FGF2、EGF、GAPDH的转录进行检测。
表1 基因引物参数
Table1Primer parameters of genes
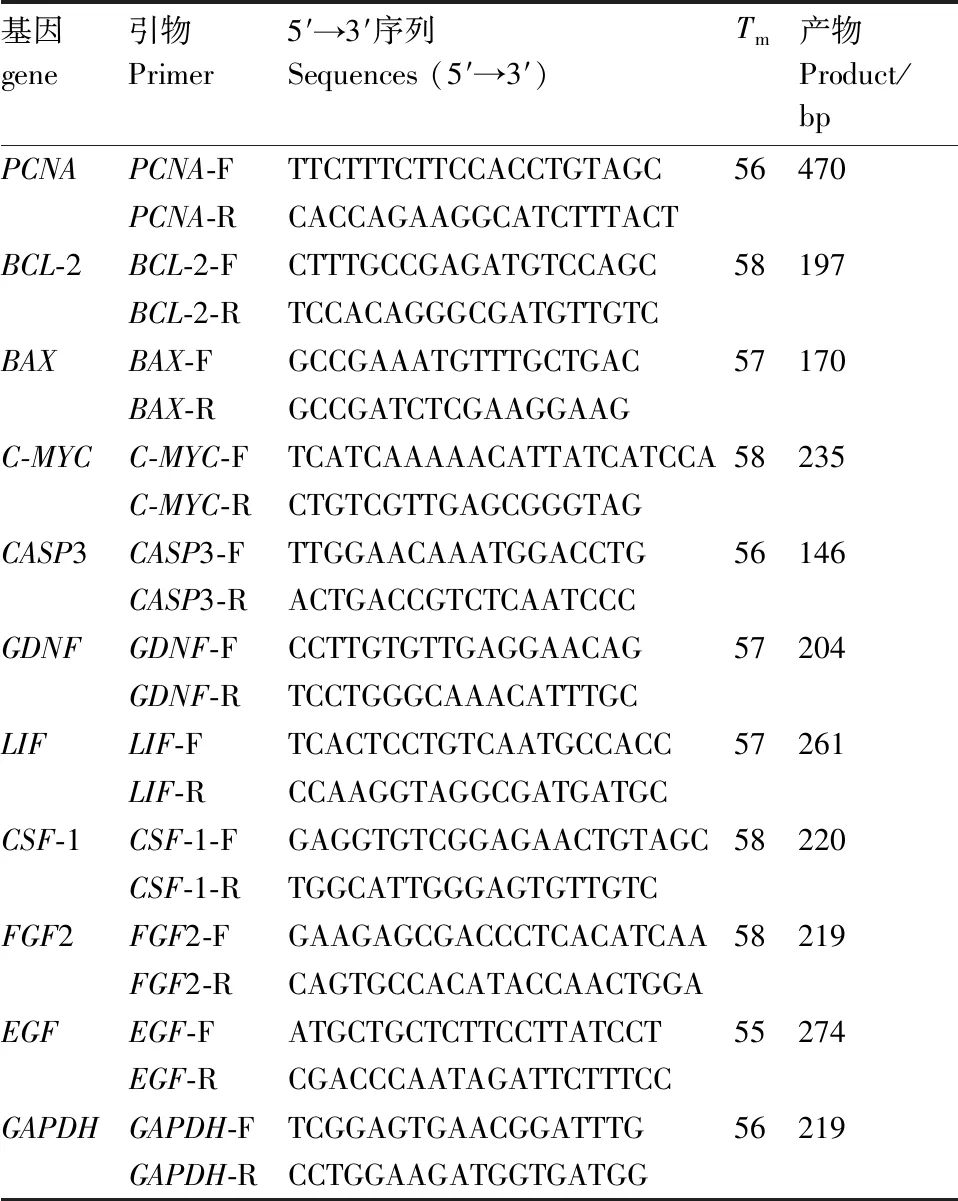
基因gene引物Primer5′→3′序列Sequences (5′→3′)Tm产物Product/bpPCNAPCNA-FTTCTTTCTTCCACCTGTAGC56470PCNA-RCACCAGAAGGCATCTTTACTBCL-2BCL-2-FCTTTGCCGAGATGTCCAGC58197BCL-2-RTCCACAGGGCGATGTTGTCBAXBAX-FGCCGAAATGTTTGCTGAC57170BAX-RGCCGATCTCGAAGGAAGC-MYCC-MYC-FTCATCAAAAACATTATCATCCA58235C-MYC-RCTGTCGTTGAGCGGGTAGCASP3CASP3-FTTGGAACAAATGGACCTG56146CASP3-RACTGACCGTCTCAATCCCGDNFGDNF-FCCTTGTGTTGAGGAACAG57204GDNF-RTCCTGGGCAAACATTTGCLIFLIF-FTCACTCCTGTCAATGCCACC57261LIF-RCCAAGGTAGGCGATGATGCCSF-1CSF-1-FGAGGTGTCGGAGAACTGTAGC58220CSF-1-RTGGCATTGGGAGTGTTGTCFGF2FGF2-FGAAGAGCGACCCTCACATCAA58219FGF2-RCAGTGCCACATACCAACTGGAEGFEGF-FATGCTGCTCTTCCTTATCCT55274EGF-RCGACCCAATAGATTCTTTCCGAPDHGAPDH-FTCGGAGTGAACGGATTTG56219GAPDH-RCCTGGAAGATGGTGATGG
分别收集细胞样品和细胞培养液,细胞培养液经3 500 r·min-1离心20 min,吸取上清液分装于2 mL冻存管内,-80 ℃冻存。细胞样品经消化、离心及洗涤后,将细胞沉淀用PBS重悬至密度为5×105cells·mL-1,通过反复冻融过程破坏细胞膜,从而释放胞内物质,再经3 500 r·min-1离心20 min,收集上清,置于-80 ℃冻存。ELISA法分别检测细胞样品和培养液样品中GDNF、FGF2、CSF-1、LIF和EGF的含量,用新鲜的高糖DMEM培养液作为阴性对照(C)。
1.3 统计分析
每次试验设置3次重复,结果用平均数±标准差表示,通过软件SPSS 25.0进行数据统计和单因素方差分析,以P<0.05表示差异显著。
2 结果与分析
2.1 支持细胞的分离纯化
原代支持细胞开始贴壁时多呈无规则多角形(图1-a),当培养至相邻细胞融合成片时,进行传代;第1、3代细胞生长旺盛,培养初期细胞呈短梭型(图1-b、c);传至第5代,细胞出现老化,增殖速度变慢,胞内可见空泡或颗粒(图1-d)。
2.2 视黄醇对支持细胞体外活性影响
如图2所示,当视黄醇添加浓度小于5.000 μmol·L-1时,培养24 h的细胞活性与对照组相比无明显差异,而浓度达到5.000 μmol·L-1及以上时细胞活性受到显著抑制(P<0.05);当视黄醇添加浓度高于0.125 μmol·L-1时,对培养3 d的支持细胞活性呈现显著抑制(P<0.05),且呈现剂量依耐性,当浓度达到1.250 μmol·L-1时表现极显著抑制(P<0.01)。

a~d分别为原代、第1、3、5代分别培养至第2天的支持细胞。a-d represented the primary cells, P1, P3 and P5 represented sertoli cells cultured for 2 d.图1 仔猪睾丸支持细胞的分离培养Fig.1 Isolation and culture of sertoli cells
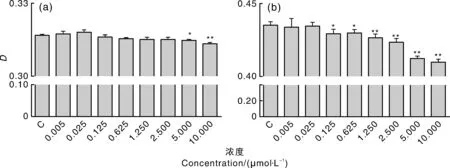
a、b分别为细胞培养24 h和3 d后细胞活力检测结果。*表示与对照组差异显著(P<0.05),* *表示与对照组差异极显著(P<0.01)。下图同。a and b represented cell viability assay results after 24 h and 3 d. * represented significant difference at P<0.05, * * represented significant difference at P<0.01. The same as below.图2 视黄醇对睾丸支持细胞活性的影响Fig.2 Effects of retinol on sertoli cell viability of testicular
以1.250 μmol·L-1作为后续实验视黄醇添加浓度,该浓度下支持细胞生长曲线如图3所示,视黄醇添加组和对照组生长趋势基本一致,0~2 d为潜伏期,3 d进入对数生长期,7 d后进入平台期。结果表明,视黄醇对支持细胞活性具有抑制作用,且这种抑制作用具有时效性和剂量依赖性。
2.3 视黄醇对支持细胞增殖和凋亡的影响
与对照组相比,视黄醇添加组支持细胞增殖相关基因的表达量显著下调,凋亡相关基因的表达量显著上调(图4)。12 h时视黄醇添加组PCNA相对表达量显著上调(P<0.05),而12 h后,视黄醇组PCNA相对表达量极显著下调(P<0.01);视黄醇添加组CASP3的表达量与对照组差异不显著(P>0.05);视黄醇添加组C-MYC相对表达量在3 d和5 d时极显著低于对照组(P<0.01);视黄醇组BCL-2相对表达量在各个时期均极显著低于对照组(P<0.01);视黄醇组BAX相对表达量5 d时极显著高于对照组(P<0.01)。结果表明,添加视黄醇可以显著下调支持细胞内增殖相关基因(PCNA、BCL-2和C-MYC)表达,上调凋亡相关基因(BAX和CASP3)表达。
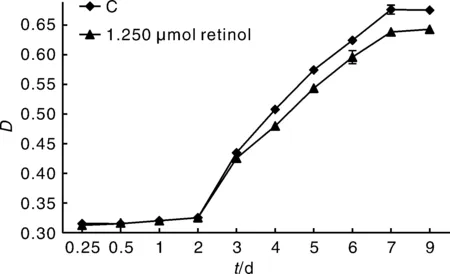
图3 支持细胞生长曲线Fig.3 Growth curve of sertoli cells
2.4 视黄醇对支持细胞内细胞因子转录和表达的影响
收集添加视黄醇干预培养24 h和3 d后的支持细胞进行RT-PCR和ELISA检测。RT-PCR结果显示,GDNF、CSF-1、EGF、LIF和FGF2在支持细胞中均有转录和表达(图5)。与对照组相比,视黄醇添加组支持细胞GDNF和CSF-1的基因表达量显著下调(P<0.05);EGF的基因表达量在培养3 d时显著下调(P<0.05),在培养24 h时与对照组相比无显著性差异(P>0.05)。视黄醇添加对支持细胞内LIF和FGF2的基因表达量无显著影响(P>0.05)。
ELISA检测结果表明(表2),处理24 h时,视黄醇添加组细胞中GDNF含量显著低于对照组(P<0.05),CSF-1、EGF含量极显著低于对照组(P<0.01);处理3 d,视黄醇添加组细胞中CSF-1、FGF2含量显著低于对照组(P<0.05),GDNF、EGF含量极显著低于对照组(P<0.01)。综上所述,视黄醇可以显著抑制GDNF、CSF-1和EGF的转录和合成。
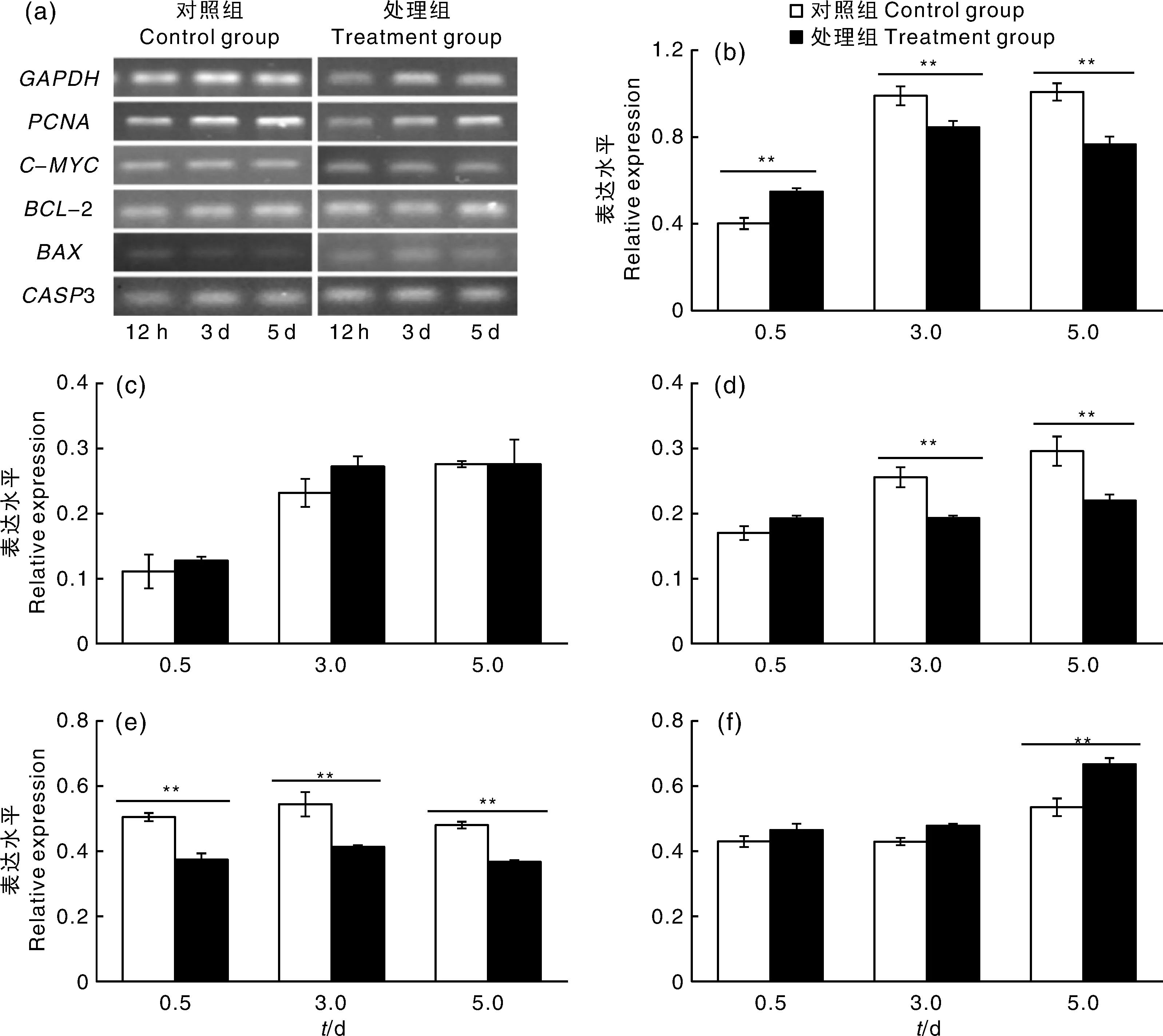
a为目的基因电泳图;b~f分别为PCNA、CASP3、C-MYC、BCL-2和BAX基因的相对表达量。a represented the expression of target genes; b-f represented relative expression levels of PCNA, CASP3, C-MYC, BCL-2 and BAX.图4 支持细胞内增殖和凋亡相关基因的相对表达量Fig.4 Relative expression of proliferation and appotis related genes in sertoli cells
3 讨论
视黄醇是最早发现的维生素之一,在机体生殖功能和免疫功能调节中都具有不可或缺的作用[1],但大量的体外实验发现,视黄醇对细胞表现出一定的毒性作用[20-23]。支持细胞是机体生殖功能调节的主要功能细胞[8],机体内支持细胞中视黄醇的生理水平维持在0.2~5.0 μmol·L-1之间[24-25]。已有研究发现,在无血清的体外培养条件下,添加高浓度的视黄醇,会对睾丸支持细胞产生毒性作用,但由于细胞的获取、来源、培养条件和视黄醇作用时间的不同,导致视黄醇对细胞的生物学功能影响呈现一定的差异。Oliveira等[22]发现,添加7 μmol·L-1视黄醇24 h后,大鼠睾丸支持细胞中超氧化物产生,并且使细胞发生形变,甚至会引起细胞DNA损伤[20]。Gelain等[21]发现,视黄醇添加浓度高于5 μmol·L-1时,对培养24 h后的大鼠睾丸支持细胞具有促氧化作用;当浓度达到14 μmol·L-1时,支持细胞活性受到显著抑制。但也有研究发现,在含6% FBS的体外培养条件下,低剂量的视黄醇(2~5 μmol·L-1)处理6 h后诱导HL-60细胞系DNA损伤[23]。上述研究均显示,体外条件下添加视黄醇可以诱导细胞DNA损伤。DNA损伤是自发产生的过程,可被环境中的诱变因素加强,进一步干扰DNA复制和转录过程,从而导致细胞活性丧失,多细胞生物会对该过程做出选择,使细胞程序性死亡[26]。在本试验中,在含10%FBS的体外条件下,添加视黄醇对支持细胞活性具有显著抑制作用,并且呈现时效性和剂量依赖性,增殖相关基因PCNA、BCL-2和C-MYC显著下调,凋亡相关基因BAX显著上调,这可能是视黄醇诱导了支持细胞DNA损伤,从而诱导细胞凋亡,导致细胞活性降低,其作用机理有待进一步研究。
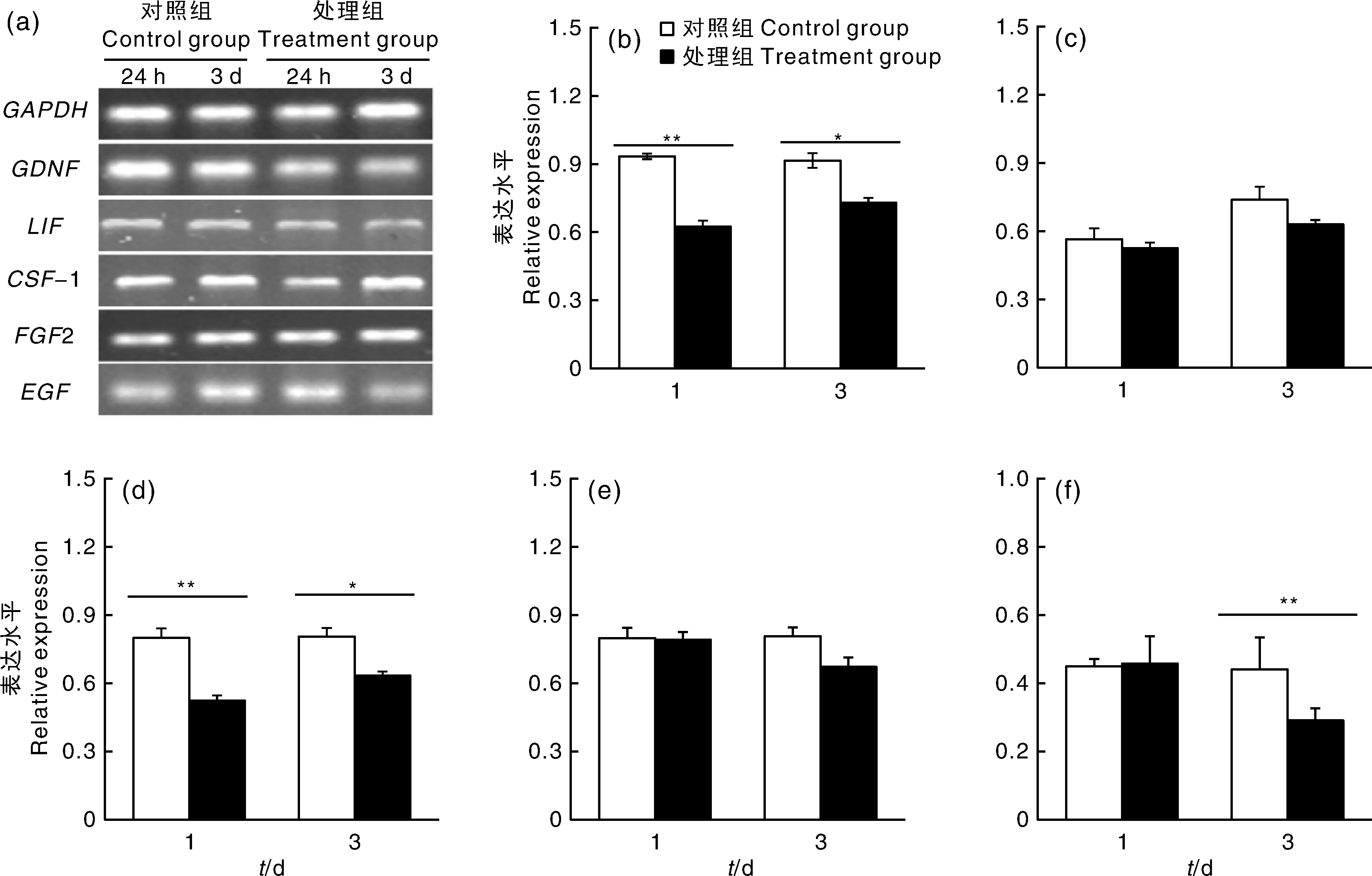
a为目的基因电泳图;b~f分别为GDNF、LIF、CSF-1、FGF2和EGF基因的相对表达量。a represented the expression of target genes; b-f represented relative expression levels of GDNF、LIF、CSF-1、FGF2 and EGF.图5 支持细胞内细胞因子相关基因的相对表达量Fig.5 Relative expression of cytokines related genes in sertoli cells
表2ELISA法检测细胞因子浓度
Table2Concentration of cytokines detected by ELISA
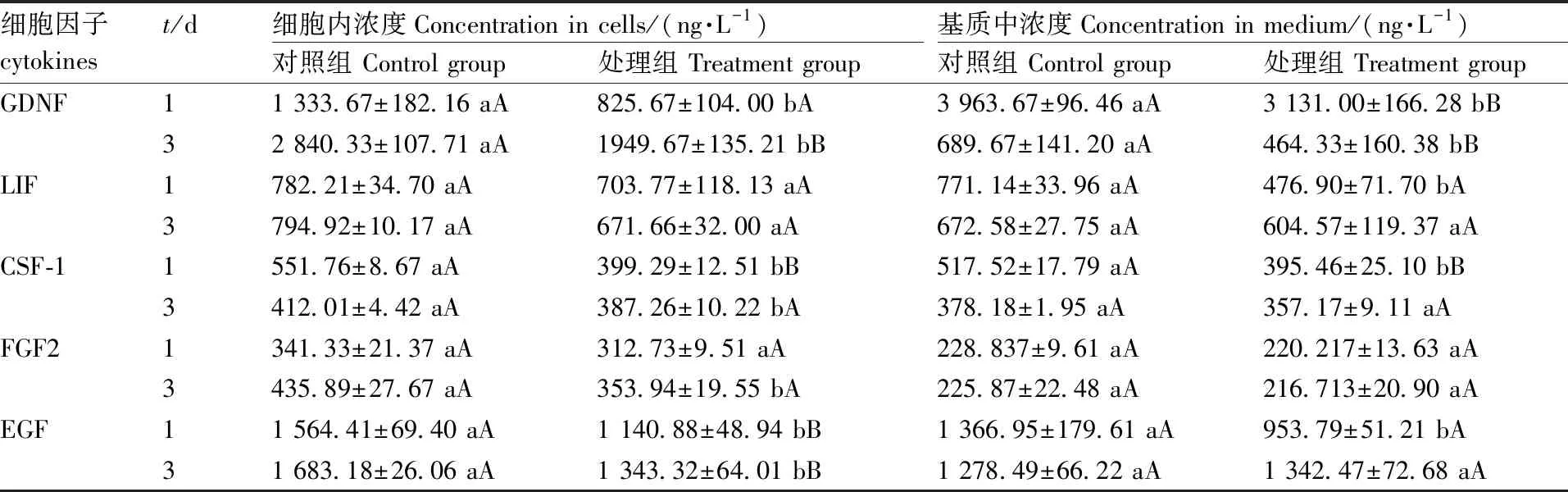
细胞因子cytokinest/d细胞内浓度Concentration in cells/(ng·L-1)对照组 Control group处理组 Treatment group基质中浓度Concentration in medium/(ng·L-1)对照组 Control group处理组 Treatment groupGDNF11 333.67±182.16 aA825.67±104.00 bA3 963.67±96.46 aA3 131.00±166.28 bB32 840.33±107.71 aA1949.67±135.21 bB689.67±141.20 aA464.33±160.38 bBLIF1782.21±34.70 aA703.77±118.13 aA771.14±33.96 aA476.90±71.70 bA3794.92±10.17 aA671.66±32.00 aA672.58±27.75 aA604.57±119.37 aACSF-11551.76±8.67 aA399.29±12.51 bB517.52±17.79 aA395.46±25.10 bB3412.01±4.42 aA387.26±10.22 bA378.18±1.95 aA357.17±9.11 aAFGF21341.33±21.37 aA312.73±9.51 aA228.837±9.61 aA220.217±13.63 aA3435.89±27.67 aA353.94±19.55 bA225.87±22.48 aA216.713±20.90 aAEGF11 564.41±69.40 aA1 140.88±48.94 bB1 366.95±179.61 aA953.79±51.21 bA31 683.18±26.06 aA1 343.32±64.01 bB1 278.49±66.22 aA1 342.47±72.68 aA
同行数据后无相同大、小写字母的分别表示组内差异极显著(P<0.01)与显著(P<0.05)。
In the same row, data marked without the same uppercase or lowercase letters indicated significant differences atP<0.01 andP<0.05, respectively.
强大分泌功能是支持细胞发挥调节作用的重要途径之一,Marh等[27]将小鼠精母细胞与支持细胞的共培养,可以使早期的生殖细胞产生具有受精能力的精子,间接证明支持细胞在生殖细胞增殖和分化具有重要的调节作用。本试验对支持细胞中相关细胞因子进行了检测分析,结果显示,GDNF、LIF、CSF-1、FGF2和EGF在支持细胞中均有转录和合成,这些细胞因子是支持细胞发挥调控功能的重要基础[14-16,18,28],添加视黄醇对GDNF、CSF-1和EGF的转录和合成具有显著抑制作用,说明添加视黄醇对支持细胞的分泌功能起抑制作用,这可能是该视黄醇浓度下引起支持细胞氧化损伤,导致细胞活性下降,从而使细胞分泌功能减弱,其作用机理有待进一步探究。
本试验结果丰富了视黄醇对哺乳动物睾丸支持细胞体外生物学特性影响这一领域的研究,进一步阐明视黄醇在支持细胞内代谢机理,以及为视黄醇作用于支持细胞后对雄性动物生殖功能的影响提供了理论依据。

