野生和栽培大豆种质油脂组成特点及其与演化的关系
陈 影 张晟瑞 王 岚 王连铮 李 斌 孙君明
野生和栽培大豆种质油脂组成特点及其与演化的关系
陈 影**张晟瑞**王 岚 王连铮 李 斌*孙君明*
中国农业科学院作物科学研究所/ 作物分子育种国家工程实验室/ 农业部农村大豆生物学重点实验室, 北京 100081
以58份不同类型(野生、半野生和栽培)大豆种质为材料, 利用32对SSR标记分析大豆种质间的遗传多样性和进化关系, 采用NIRS和GC方法分别分析大豆脂肪含量和脂肪酸组分含量, 研究不同类型大豆种质油脂组成特点及其与演化的关系。结果显示, 野生大豆和栽培大豆的油脂组成存在显著差异, 栽培大豆脂肪含量(平均20.8%)显著高于野生大豆(平均10.49%), 油酸含量(平均28.5%)显著高于野生大豆(平均14.37%), 而亚麻酸含量却显著低于野生大豆; 由相关性分析可知, 大豆种子中的脂肪与油酸含量显著正相关(= 0.85**), 而与其他脂肪酸组分极显著负相关; 油酸与所有其他脂肪酸组分均负相关, 特别是与亚麻酸和亚油酸呈极显著负相关(=-0.90**和-0.89**); 油脂组成和SSR标记对不同类型大豆种质的聚类和主成分分析表明, 2种分类结果基本一致, 可分为栽培和野生2个亚群, 半野生大豆则分布于2个亚群中。由此可见, 大豆油脂组成与大豆种质的驯化程度有关, 脂肪含量和亚麻酸含量可以作为大豆演化分类的参考指标。
野生大豆; 半野生大豆; 栽培大豆; 脂肪含量; 脂肪酸组分
大豆(L. Merr.)是世界上四大油料作物之一, 为食用植物油的主要来源。大豆油中含有丰富的脂肪酸, 主要包括棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸, 其中棕榈酸和硬脂酸为饱和脂肪酸, 油酸、亚油酸和亚麻酸为不饱和脂肪酸[1-2]。不同脂肪酸组成决定大豆油的品质和最终用途[3]。多不饱和脂肪酸可以促进体内胆固醇的代谢, 对预防心血管疾病有着显著的作用[4]。另一方面, 多不饱和脂肪酸亚油酸和亚麻酸中含有较多的不饱和键, 易被脂肪氧化酶氧化, 从而降低大豆油的保存期限和品质[5-6]。饱和脂肪酸含量升高可以提高豆油的稳定性, 但因其很难被人体所吸收, 摄入量过高易引发高血脂、冠心病、肥胖症等疾病, 不利于人体的健康[7-8], 因此, 依据不同的需求选育不同脂肪酸组成的大豆品种是十分必要的。根据系统进化关系, 大豆种质可分为野生()、半野生()、栽培大豆() 3种类型。前人利用大豆形态学分类方法研究种质间驯化关系, 并对不同类型大豆种质的脂肪含量和脂肪酸组分分析发现, 栽培豆中的脂肪含量显著高于野生豆[9]; 且不同类型大豆间的油酸、亚油酸和亚麻酸组成存在显著差异[1]。随着分子生物学技术的迅速发展, AFLP、SSR和SNP等分子标记被广泛应用于大豆种间亲缘关系和演化关系的研究[10-12]。本文采用近红外光谱和气相色谱分析方法分别分析野生、半野生和栽培大豆籽粒中的脂肪含量和脂肪酸组成, 结合大豆形态学和分子标记分类方法, 研究其油脂组成特点, 探讨在大豆驯化过程中油脂组成的演化规律, 为大豆品质改良育种提供理论参考。
1 材料与方法
1.1 大豆试验材料
选用不同类型的大豆种质58份, 根据形态学特征将其分成3种类型, 即27份野生大豆、7份半野生大豆和24份栽培大豆(表1)均由本单位大豆基因资源创新研究组邱丽娟研究员提供。2017年6月将材料种植于中国农业科学院作物科学研究所北圃场基地, 采用完全随机区组设计, 单行区, 行长2.0 m, 行距0.5 m, 株距0.1 m, 按株行收获脱粒, 4℃保存待用。

表1 58份不同类型的大豆种质
1.2 大豆叶片DNA的提取
于苗期取每份大豆种质0.1~0.2 g幼叶放入研钵, 加液氮充分研磨, 取100 mg样品放入1.5 mL离心管。使用TIANGEN新型植物基因组DNA提取试剂盒(离心柱型)提取大豆叶片基因组DNA。利用1%琼脂糖凝胶电泳检测DNA质量, 使用NanoDrop 2000紫外-可见分光光度计检测DNA的浓度和纯度。
1.3 大豆种质基因型分型
参照王彪等[13]的研究方法选用32对均匀分布在大豆20个遗传连锁群上的SSR引物, 根据SoyBase网站(https://soybase.org/)提供的SSR引物序列, 由北京梓熙生物科技有限公司合成, 并使用FAM (蓝光)和HEX (红光) 2种荧光基团修饰上游引物。PCR主要试剂来自全式金生物技术有限公司。PCR反应体系总体积15 µL, 其中1.5 µL 10×PCR buffer、1.5 µL 2.5 mmol L-1dNTP、正反向引物各0.5 µL、0.2 µLpolymerase (5 U µL-1)、大豆基因组DNA 50 ng、9.8 µL ddH2O。PCR扩增条件为95℃预变性3 min; 95℃变性30 s, 50℃退火30 s, 72℃延伸30 s, 扩增35个循环; 72℃延伸10 min。
利用毛细管电泳法对58份大豆种质材料的PCR扩增产物进行基因型检测。取100~200 ng的PCR产物放入96孔板中, 加入50 µL无水乙醇, 震荡混匀, 4℃, 3000 ×离心30 min, 弃上清液; 加入70 µL预冷的(-20℃) 70%乙醇, 震荡混匀, 4℃, 2000 ×离心15 min, 弃上清液; 室温避光放置10~20 min; 加入10 µL Hi-Pi甲酰胺(混有0.3% ROX内标), 震荡混匀, 95℃, 变性5 min; 冰浴5 min, 1000 ×瞬时离心后利用ABI 3730XL测序仪进行毛细管电泳。
1.4 大豆脂肪和脂肪酸组分含量测定
1.4.1 大豆脂肪含量检测 采用傅里叶近红外光谱分析仪(MATRIX-1, Bruker, 德国)扫描样品, 每个样品扫描3次, 利用OPUS 5.0软件对大豆种质的脂肪含量进行预测, 取3次检测结果的平均值为脂肪含量。
1.4.2 大豆脂肪酸提取 采用加热甲酯化法提取脂肪酸, 每份大豆种质取20粒种子, 用磨样机(Retsch ZM100,= 1.0 mm, Rheinische, 德国)磨成细粉, 准确称取150.0 mg豆粉于10.0 mL试管中, 加入5.0 mL正己烷, 60℃浸提20 min; 然后加入5.0 mL 0.5 mol L-1甲醇钠溶液, 充分摇匀10 min, 使其充分甲酯化, 静置, 取上清液置色谱专用样品瓶中检测[14]。
1.4.3 大豆脂肪酸气相色谱检测条件 采用岛津GC-2010气相色谱仪对大豆脂肪酸含量进行定性定量检测。用色谱柱RTX-Wax (30 m × 0.25 m × 0.25 m); 自动注射l μL; 分流比40∶1; 注入口温度250℃, 载气氮气54 mL min-1, 氢气40 mL min-1, 空气400 mL min-1, 采用程序升温模式(180℃保持1.5 min, 以10℃ min-1升到210℃, 保持2 min, 然后以5℃ min-1升到220℃, 保持5 min)。检测器FID温度为300℃; 采用面积归一化法计算5种主要脂肪酸(棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸)的百分比作为大豆脂肪酸组分含量[15]。
1.5 数据分析
利用Microsoft Excel 2007和SAS 9.2软件进行数据统计与方差分析。利用PowerMarker V3.25软件进行标记的遗传多样性和系统进化树分析。使用Mcquitty方法[16]对脂肪酸含量进行聚类和主成分分析等。
2 结果与分析
2.1 58份不同类型大豆种质脂肪和脂肪酸组成特点
58份不同类型大豆种质的脂肪和脂肪酸组分含量存在显著差异。由表2可知, 大豆种质脂肪含量的变异系数高达34.64%, 其中, 栽培大豆品种合丰50的脂肪含量最高(24.71%), 野生大豆ZYD01694的脂肪含量最低(6.97%); 5种脂肪酸组分含量的变异系数也各不相同(8.59%~42.82%), 其中亚麻酸的变异系数最大(42.82%), 野生大豆BY019的亚麻酸含量最高(15.97%), 栽培品种合丰50含量最低(3.45%); 油酸的变异系数次之(38.16%), 其中野生大豆ZYD3263油酸含量最低(11.00%), 半野生大豆ZYD0001油酸含量最高(39.61%)。总体上看, 饱和脂肪酸含量的变异系数为10.23%, 不饱和脂肪酸含量的变异系数为2%, 由此可见, 大豆种子中饱和、不饱和脂肪酸比例是相对比较稳定。对58份大豆资源材料的油脂特征频率分布分析发现, 脂肪含量和脂肪酸组分均呈现连续分布。尽管5种脂肪酸含量在58份材料中不是典型的正态分布, 但饱和脂肪酸和不饱和脂肪酸含量却呈现典型的正态分布(图1)。
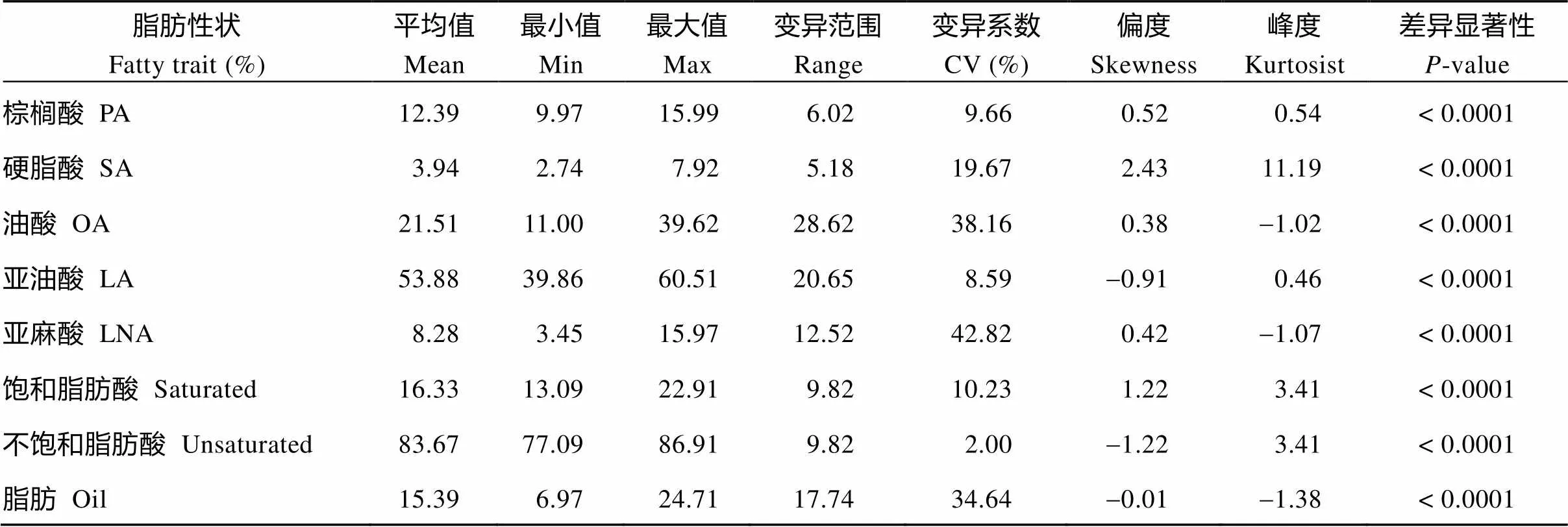
表2 58份大豆种质的脂肪和脂肪酸组成含量变异分析
PA: palmitic acid; SA: stearic acid; OA: oleic acid; LA: linoleic acid; LNA: linolenic acid.

图1 58份材料油脂性状的频率分布
缩写同表2。Abbreviations are the same as those given in Table 2.
2.2 不同类型大豆种质脂肪和脂肪酸组分的差异比较分析
按照形态学分类方法将58份不同类型大豆种质分为野生、半野生和栽培大豆3种类型(表1)。通过对3种类型大豆种质油脂组成的方差分析发现, 野生大豆的脂肪含量和脂肪酸组分与栽培大豆均存在显著差异, 与半野生大豆除硬脂酸外也均存在显著差异。野生大豆脂肪含量(平均10.49%)显著低于栽培大豆(平均20.8%), 半野生大豆位于二者之间(平均15.71%); 野生大豆不饱和脂肪酸含量(平均82.71%)显著低于栽培大豆(平均84.7%), 而饱和脂肪酸含量(平均17.29%)显著高于栽培大豆(平均15.3%)。半野生大豆饱和脂肪酸和不饱和脂肪酸含量均与野生大豆差异不显著。野生大豆的油酸含量(平均14.37%)显著低于栽培大豆(平均28.5%), 其他脂肪酸组分含量高于栽培大豆。野生大豆亚麻酸含量(平均11.38%)显著高于栽培大豆(平均4.97%), 而半野生大豆同样位于二者之间(平均7.64%)。因此, 脂肪和亚麻酸含量在不同类型大豆中差异显著(图2)。
2.3 大豆种质的脂肪含量和脂肪酸组分相关性分析
由图3可知, 大豆种子中的脂肪含量与油酸含量存在极显著的正相关(= 0.85**), 而与其他脂肪酸组分存在极显著负相关, 特别是与亚麻酸含量呈极显著负相关(=-0.92**)。油酸与所有其他脂肪酸组分均存在负相关, 特别是与亚麻酸、亚油酸呈极显著负相关(=-0.90**和-0.89**); 而亚麻酸除了与油酸含量呈极显著负相关(=-0.90**)外, 与其他组分均存在显著正相关。另外, 2种饱和脂肪酸棕榈酸和硬脂酸呈极显著正相关(= 0.41**)。
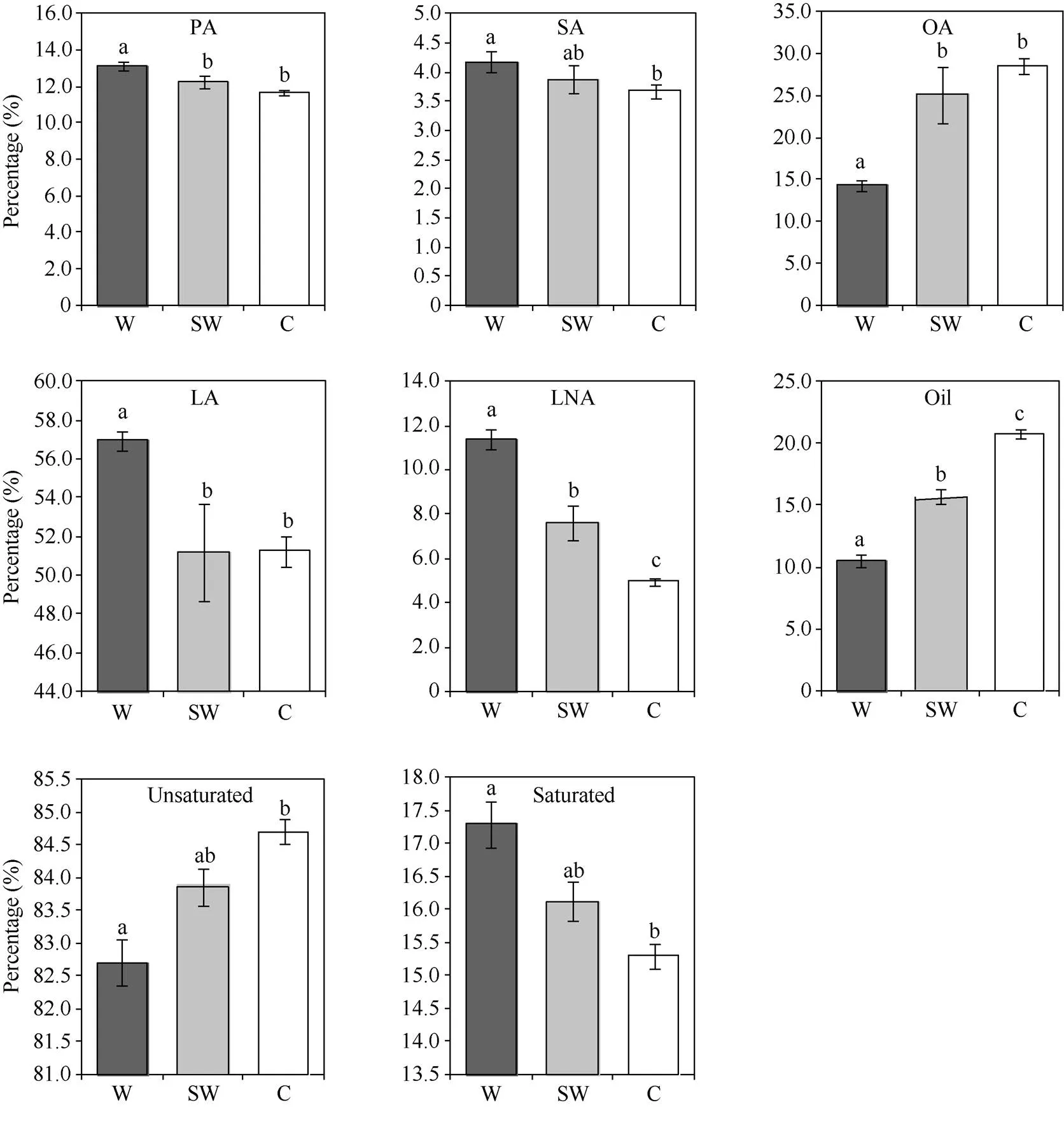
图2 基于形态学分类的野生、半野生和栽培大豆种质的油脂组成的方差分析
图中符号W、SW、C分别代表野生大豆()、半野生大豆()和栽培大豆()。标以不同字母的柱值在0.05水平上差异显著。缩写同表2。
W, SW, and C represent wild soybean (), semi-wild soybean (), and cultivated soybean (), respectively. Bars superscripted by different letters are significantly different at the 0.05 probability level. Abbreviations are the same as those given in Table 2.

图3 58份大豆种质的脂肪含量和脂肪酸组分间的Pearson相关系数
*和**分别表示0.05和0.01水平差异显著; 图中圆圈越大, 表示相关性越强, 圆圈越小, 表示相关性越弱。缩写同表2。
*and**represent the significant level at the 0.05 and 0.01 probability levels, respectively. The larger the circle, the stronger the correlation, the smaller the circle, the weaker. Abbreviations are the same as those given in Table 2.
2.4 基于油脂组成参数的不同类型大豆种质的聚类分析
以大豆种质的脂肪含量和5种脂肪酸组分含量为参数, 聚类分析(图4)表明, 58份大豆种质可分为3个亚群, 第1亚群仅由半野生大豆种质SW5组成; 第2亚群主要由野生大豆种质组成, 包含25个野生和2个半野生大豆种质, 第3亚群主要由栽培大豆种质组成, 包含24个栽培、4个半野生和2个野生大豆种质。野生大豆与栽培大豆明显分成2个亚群, 说明2种类型的大豆种质的油脂组成明显不同, 同一类型大豆种质的油脂组成分布规律较为统一, 不同类型大豆种质间存在较大差异; 而半野生大豆无明显的聚集群, 分布在野生和栽培大豆亚群中。
2.5 不同类型大豆种质基于油脂组成的主成分分析
以大豆种质的脂肪含量和5种脂肪酸组分含量为参数, 对58份大豆种质进行主成分分析(图5), 共提取解释变异最高的前3个主成分因子, 可累计反映总变异的93%, 第一主成分(PC1)主要由油酸、亚麻酸和脂肪含量组成, 第二主成分(PC2)主要由硬脂酸和亚油酸组成, 第三主成分(PC3)主要由棕榈酸组成, 3个主成分因子分别揭示总变异的65%、19.7%和8.5%。野生大豆和栽培大豆被分别聚集在2个亚群中, 半野生大豆则在2个亚群中均有分布。主成分分析与聚类分析结果基本一致, 58份大豆种质中, 野生大豆与栽培大豆脂肪含量、脂肪酸含量差异较明显, 半野生大豆则处在野生和栽培大豆之间, 无明显油脂组成性状的差异。
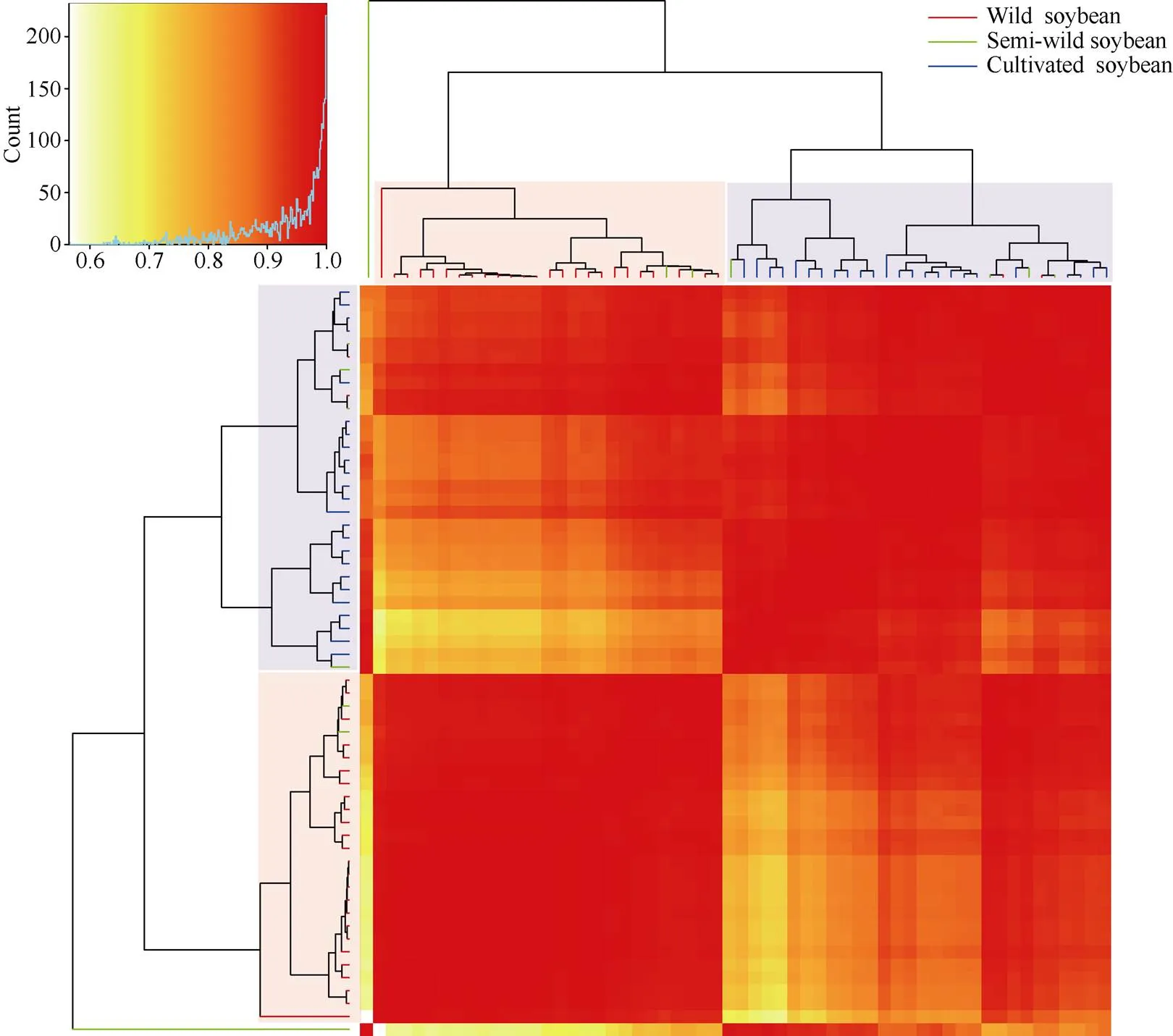
图4 58份大豆种质基于油脂组成的聚类分析
聚类结果中红色分支代表野生大豆, 绿色分支代表半野生大豆, 蓝色分支代表栽培大豆。
The red branches represent wild soybean, the green branches represent semi-wild soybean, and the blue branches represent cultivated soybean in the clustering results.

图5 58份大豆种质基于油脂组成的主成分分析
PC1~PC3代表基于脂肪和5种脂肪酸组成含量的前3个主成分。红色圆点代表野生大豆, 绿色三角形代表半野生大豆, 蓝色正方形代表栽培大豆。
PC1-PC3 represent the first three principal components based on the oil and five fatty acid contents. The red circles, green triangles, and blue squares represent wild, semi-wild, and cultivated soybean accessions, respectively.
2.6 基于SSR标记的不同类型大豆种质的遗传多样性分析
利用32对SSR引物对大豆种质进行遗传多样性分析。由表3可知, 32对SSR引物在58份大豆种质中共扩增出等位基因368个, 平均每对引物扩增出11.5个等位基因, 等位基因数目变异系数为5~18个, 引物Satt 390仅扩增出5个等位基因, 引物Satt 281和Satt 590分别扩增出多达18个等位基因。
遗传多样性代表生物种群之内和种群之间遗传结构变异程度。基因多样度和多态性信息含量(PIC)是常用来表示种群的遗传多样性的指标, 本研究结果表明, 基因多样性平均值为0.80, 各引物基因多样性值变异系数为0.61~0.91, 其中引物Satt 590基因多样性最高, 引物Satt 281次之, 引物Satt 442最低。PIC值与基因多样性呈现的结果较为一致, 其平均值为0.78, 变异系数为0.53~0.90, 引物Satt 590与Satt 281的PIC值最大, 均为0.90, 引物Satt 442的PIC值最低(0.53)。
(续表3)

引物Primer连锁群Linkage group染色体Chr.等位基因数目Allele number基因多样性Gene diversity多态性信息含量PIC Satt 586F13110.830.81 Satt 309G1860.730.69 Satt 442H1280.610.53 Satt 239I20120.870.85 Satt 571I2080.790.76 Sct 189I20120.830.81 Satt 431J16150.890.89 Satt 596J16100.860.84 Satt 242K9110.870.86 Satt 588K9110.800.78 Satt 373L19120.800.79 Satt 308M7130.850.84 Satt 346M790.730.69 Satt 590M7180.910.90 Satt 530N3120.820.80 平均Mean——11.50.800.78
2.7 基于SSR标记的不同类型大豆种质的聚类分析
基于Nei (1983)氏距离, 采用邻位相连算法(Neighbor-Joining tree, NJ)[17]对58份大豆种质进行聚类分析。由图6可以看出, 58份大豆种质可明显分为两大亚群, 第一亚群(CI)主要由野生大豆组成, 包含23份野生和5份半野生大豆; 第二亚群(CII)主要由栽培大豆组成, 包含24份栽培、2份半野生和4份野生大豆; 半野生大豆分布于两大亚群之中, 表明利用32对SSR标记, 可以大致区分栽培大豆和野生大豆类群, 但不能准确区分半野生大豆类群。第一亚群中的G1类群(全部为野生大豆类型)与第二亚群中的G2类群(全部为栽培大豆类型)遗传距离最远, 表明这2个类群的大豆亲缘关系较远, 可作为典型的野生和栽培大豆类型。本研究从这2个典型类群中发现了14个特异性标记, 分别为Satt 236、Satt 346、Satt 586、Satt 409、Satt 300、Satt 596、Satt 308、Satt 590、Satt 286、Sct_189、Satt 556、Satt 530、Satt 242和Satt 431。
2.8 基于SSR标记的不同类型大豆种质的主成分分析
基于32对SSR标记对58份大豆种质进行主成分分析发现, 前3个解释变异最高的主成分因子PC1a、PC2a、PC3a分别揭示总变异的17.83%、9.42%和7.76% (此处PC1a~PC3a代表不同SSR标记组合所构成的主成分因子)。由图7可以看出, 58份不同类型的大豆种质可明显分为2个亚群, 野生大豆和半野生大豆聚集在一个亚群中, 栽培大豆聚集在另外一个亚群, 其中有少量野生大豆。主成分与聚类分析结果均表明, 58份大豆种质中, 野生大豆与栽培大豆亲缘关系较远, 而半野生大豆与两者均存在一定的亲缘关系。
2.9 基于SSR标记分类的典型野生和栽培大豆种质的油脂组成特点
SSR标记遗传分类结果(图6)及典型野生大豆(9份)和栽培大豆(12份)脂肪含量和脂肪酸组成含量的方差分析(图8)显示, 野生大豆脂肪含量(平均9.02%)极显著低于栽培大豆(平均21.6%); 野生大豆油酸含量(平均12.1%)显著低于栽培大豆(平均29.07%), 其他脂肪酸组分野生大豆均高于栽培大豆, 特别是野生大豆的亚麻酸含量(平均12.26%)显著高于栽培大豆(平均4.71%); 野生大豆饱和脂肪酸含量高于栽培大豆, 不饱和脂肪酸正相反。这与基于形态学区分的野生和栽培大豆种质的油脂组成规律基本一致。

图6 基于SSR标记的大豆种质的NJ聚类图
图中红色、绿色和蓝色分支分别代表野生、半野生和栽培大豆; CI和CII表示2个主要亚群, G1和G2分别表示聚类结果中的亲缘关系较远且形态差异明显的典型野生大豆()和栽培大豆()。
The red, green, and blue branches represent the wild, semi-wild, and cultivated soybean accessions, respectively; CI and CII indicate two major subgroups, G1 and G2 represent typical wild soybean () and cultivated soybean () with distant genetic relationships and obvious morphological differences in clustering results.
3 讨论
3.1 野生大豆和栽培大豆的油脂组成存在显著差异
大豆起源于中国, 早在5000年前野生大豆()就被驯化为栽培大豆()[12], 二者存在紧密的亲缘关系, 但油脂组成特点不同。徐豹等[18]分析了中国1595份野生大豆的脂肪含量, 平均为9.94%, 低于栽培大豆(平均19.05%)。王连铮等[19]针对东北地区收集的大量野生大豆资源分析了野生大豆和栽培大豆的脂肪酸组成差异, 发现野生大豆的油酸含量(平均15.58%)低于栽培大豆(平均28.86%), 亚麻酸含量(平均18.69%)高于栽培大豆(平均7.35%)。本研究针对分子数据分类的典型野生大豆的平均脂肪含量为9.02%, 典型的栽培大豆的平均脂肪含量为21.61%; 野生大豆油酸含量(12.10%)同样低于栽培大豆(29.08%), 亚麻酸含量(12.26%)同样高于栽培大豆(4.71%), 表明野生大豆和栽培大豆的油脂组成存在显著差异, 这与前人的大样本研究结果吻合。
3.2 通过分子标记方法可以对野生和栽培大豆种质进行准确分类
大豆属种间遗传关系的研究有多种方法, 利用形态学特征区分大豆不同类型最为常用。然而, 大豆形态学特征易受环境条件影响, 不能准确用于判定种质材料的种属关系[20]。本研究利用大豆形态学特征、品质特性及种间分子亲缘关系, 对58份大豆种质进行了种属分类, 并鉴定种质间的进化关系, 获得了9份典型野生大豆和12份典型栽培大豆类型, 针对2种类型的大豆种质筛选出了特异性标记和特征条带。赵洪馄等[21]研究表明BARC-sat39标记在野生大豆和栽培大豆之间有特异谱带, 推断该SSR标记是栽培大豆和野生大豆有关的一个等位基因点。本研究筛选出的14个野生大豆和栽培大豆的特异性SSR标记, 未见相关报道, 可能是新的特异标记, 下一步将在包含栽培和野生大豆群体的更大范围内进一步验证其有效性。
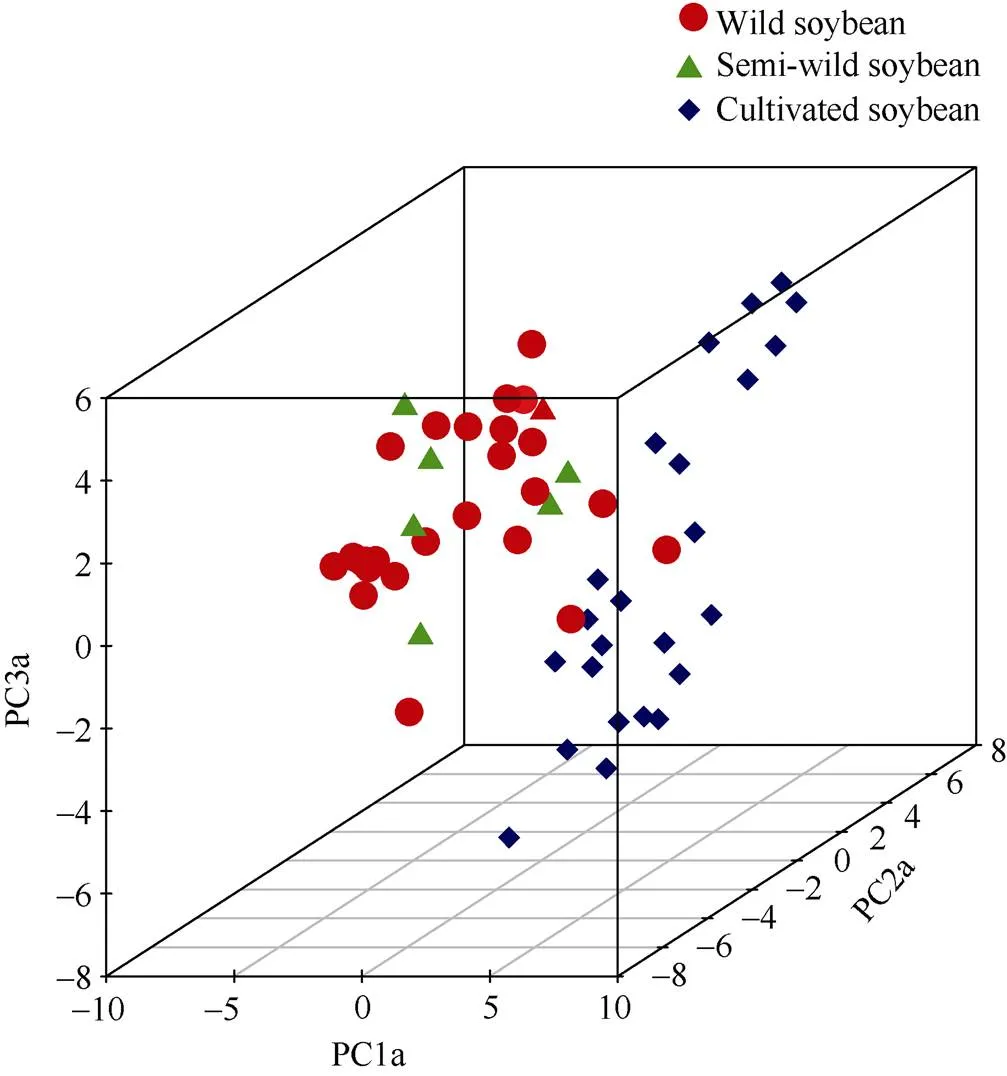
图7 58份大豆材料基于32对SSR遗传标记的主成分分析
PC1a~PC3a代表基于32对SSR引物的前3个主成分因子。红色圆点代表野生大豆, 绿色三角形代表半野生大豆, 蓝色正方形代表栽培大豆。
PC1a-PC3a represent the first three principal components based on the 32 pairs of SSR markers. The red circle, green triangle, and blue square represent wild, semi-wild and cultivated soybean accessions, respectively.
3.3 大豆油脂组成特点与大豆的驯化与分类有关
栽培大豆是野生大豆在栽培条件下通过人工定向选择而来[22], 半野生豆是野生大豆和栽培大豆中间的过渡类型[23]。本文利用分子标记方法结合大豆形态学特征对58份大豆种质进行聚类分析和主成分分析, 发现野生大豆与栽培大豆可以明显分为2个亚群, 而半野生大豆则同时分布于2个亚群, 这可能是本研究选取的分子标记数目较少, 不能完全区分野生和半野生大豆, 也可能是半野生大豆无论亲缘关系还是油脂组成特征均居于栽培大豆和野生大豆之间。
方差分析表明, 大豆从野生大豆到栽培大豆的演化过程中, 脂肪含量显著增加; 在脂肪酸组成上, 主要趋势是油酸含量大幅增加, 亚油酸和亚麻酸含量显著降低。食用过多的饱和脂肪酸不利于人体健康, 而不饱和脂肪酸有益于心血管疾病的预防[24], 同时由于多不饱和脂肪酸亚麻酸容易被氧化造成豆油的保存期缩短, 因此提高油酸含量可以保证大豆油健康品质, 是大豆品质育种的主要研究方向。由此推测, 栽培大豆从野生的演化过程中, 脂肪含量和脂肪酸组成可能受到了人工选择。近年来对302份野生和栽培大豆的重测序分析也表明, 控制油脂合成的多个重要位点和基因(等)均受到了显著的选择[12], 这些位点和基因在驯化过程中的定向选择可能是大豆油脂组成演化的重要遗传基础。同时, 发掘这些重要基因的优异等位变异, 并结合常规育种技术、分子标记辅助选择技术、以及转基因技术将这些基因的优异等位变异聚合是进一步优化大豆油脂组成的有效途径。
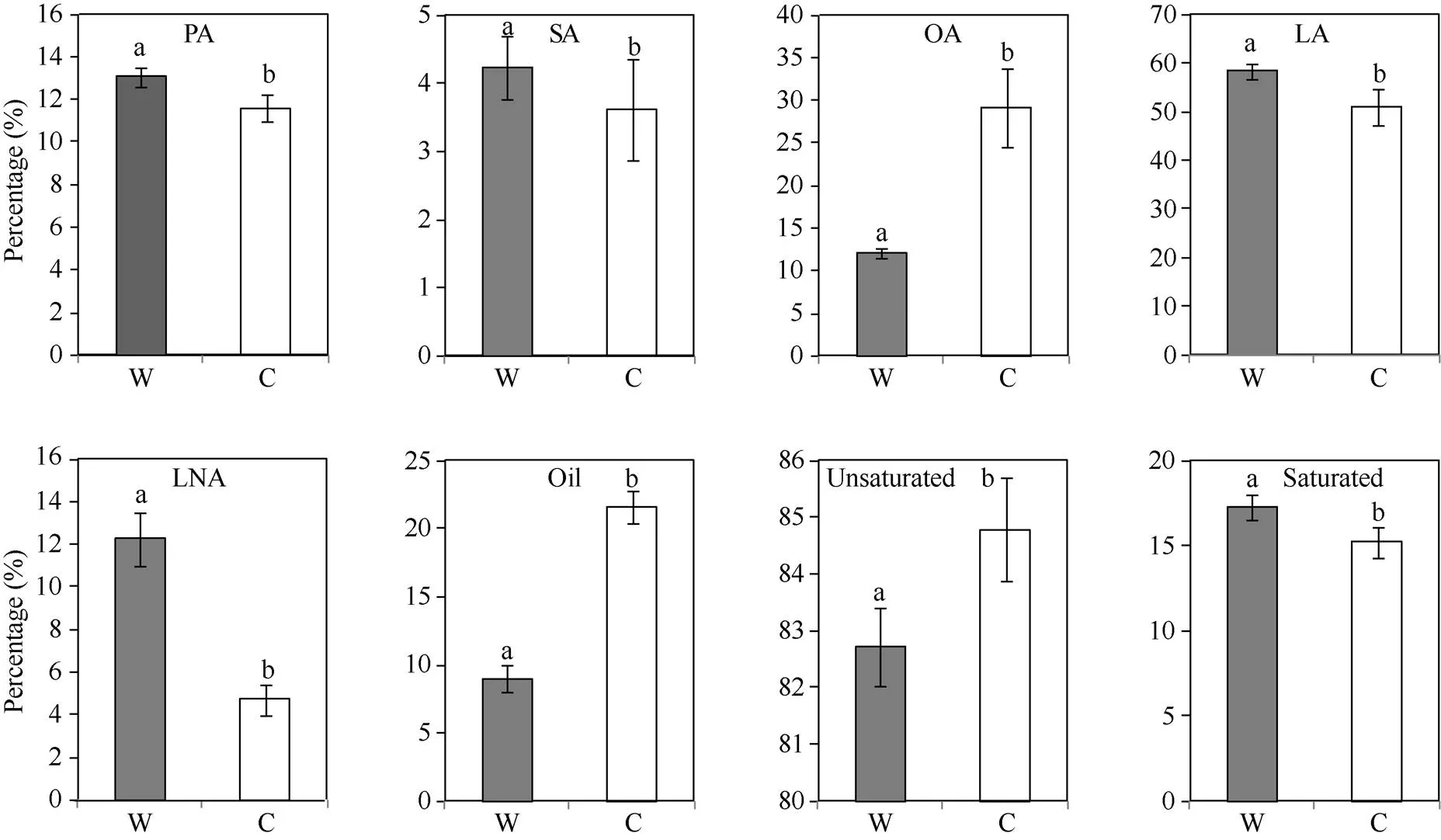
图8 基于遗传距离分析结果对野生和栽培大豆种质油脂组成的方差分析
W、C分别代表野生大豆()和栽培大豆(); 标以不同字母的柱值在0.05水平上差异显著。缩写同表2。
W and C represent wild soybean () and cultivated soybean (), respectively. Bars superscripted by different letters are significantly different at the 0.05 probability level. Abbreviations are the same as those given in Table 2.
α-亚麻酸是2种重要n-3长链脂肪酸EPA和DHA的合成前体, 这2种脂肪酸在大脑发育、心血管健康以及炎症反应中具有重要的作用[25], 而野生大豆中的亚麻酸含量高达15%以上, 因此, 在大豆品质育种中可以利用野生大豆资源, 通过杂交组配, 提高栽培大豆中的亚麻酸含量, 用于专用营养大豆品种的选育。
3.4 脂肪含量和亚麻酸含量可以作为野生和栽培大豆进化分类的参考指标
庄无忌等[1]、吕景良等[2]和徐豹等[18]研究发现亚麻酸含量在栽培和野生大豆间存在显著差异, 并提出了将亚麻酸含量作为大豆种或类型鉴定的一个参考指标。本文从油脂特征和亲缘关系2个方面对58份大豆种质聚类分析和主成分分析显示, 野生大豆与栽培大豆被分别聚集在2个亚群内, 半野生大豆则在2个聚集群内均有分布; 其中, 51份(88%)大豆种质基于油脂性状聚类结果与基于分子亲缘关系的聚类结果一致, 说明从野生大豆到栽培大豆的演化过程中油脂组成发生了显著的改变, 特别是, 脂肪含量和亚麻酸含量在不同类型大豆种质中差异十分显著, 而且随着演化程度的提高而呈规律性的变化, 因此可将其作为大豆演化与分类研究的参考指标。
4 结论
大豆油脂组成与大豆种质的驯化程度有关, 栽培大豆脂肪含量及油酸含量均显著高于野生大豆, 而亚麻酸含量显著低于野生大豆。依据油脂组成和分子标记作为分类参数的聚类结果基本一致, 野生和栽培大豆明显分为2个亚群, 而半野生大豆分布在2个亚群中。栽培和野生大豆的脂肪含量和亚麻酸含量存在明显分布规律, 可以作为大豆演化分类的参考指标。
[1] 庄无忌, 韩华琼, 谢发明, 张乔, 李福山, 舒世珍, 常汝镇. 栽培、野生、半野生大豆脂肪酸组成的初步分析研究. 大豆科学, 1984, 3: 223–230. Zhuang W J, Han H W, Xie F M, Zhang Q, Li F S, Shu S Z, Chang R Z. Composition of fatty acid in cultivated, semi-cultivated and wild soybean.1984, 3: 223–230 (in Chinese with English abstract).
[2] 吕景良, 邵荣春, 吴百灵,梁岐, 吴桂荣. 东北地区大豆品种资源脂肪酸组成的分析研究. 作物学报, 1990, 16: 349–356. Lyu J L, Shao R C, Wu B L, Liang Q, Wu G R. Studies on the fatty acid composition of soybean germplasm resources in northeast China.,1990, 16: 349–356 (in Chinese with English abstract).
[3] Thelen J J, Ohlrogge J B. Metabolic engineering of fatty acid biosynthesis in plants., 2002, 4: 12–21.
[4] 李志香, 沈翠平. 多不饱和脂肪酸对人体的作用. 生物学通报, 1998, 33(1): 9–10. Li Z X, Shen C P. The effect of polyunsaturated fatty acids on the human health., 1998, 33(1): 9–10 (in Chinese).
[5] Willett W C, Stampfer M J, Manson J E, Hu F B, Oh K. Dietary fat intake and the risk of coronary heart disease in women., 1997, 337: 1491–1499.
[6] Mounts T L, Warner K, List G R,Kleiman R,Fehr E G,Hammond E G, WilcoxJ R. Effect of altered fatty acid composition on soybean oil stability., 1988, 65: 624–628.
[7] Judd J T, Clevidence B A, Muesing R A, Wittes J, Sunkin M E, Podczasy J J. Dietary trans fatty acids: effects on plasma lipids and lipoproteins of healthy men and women., 1994, 59: 861–868.
[8] Krisetherton P M. Trans-fats and coronary heart disease., 2010, 50: 29–30.
[9] 李福山. 中国野生大豆资源的地理分布及生态分化研究. 中国农业科学, 1993, 26(2): 47–55. Li F S. Studies on the ecological and geographical distribution of the Chinese resources of wild soybean()., 1993, 26(2): 47–55 (in Chinese with English abstract).
[10] Zhao H K, Zhuang B C, Wang Y M, Li Q J. AFLP analysis of wild () and cultivated soybean () in China., 2000, 10: 32–35.
[11] 吴晓雷, 贺超英, 陈受宜, 庄炳昌, 王克晶, 王学臣. 用SSR分子标记研究大豆属种间亲缘进化关系. 遗传学报, 2001, 28: 359–366. Wu X L, He C Y, Chen S Y, Zhuang B C, Wang K J, Wang X C. Phylogenetic analysis of interspecies in genusthrough SSR markers., 2001, 28: 359–366 (in Chinese with English abstract).
[12] Zhou Z K, Jiang Y, Wang Z, Gou Z H, Lyu J, Li W Y, Yu Y J, Shu L P, Zhao Y J, Ma Y M, Fang C, Shen Y T, Liu T F, Li C C, Li Q, Wu M, Wang M, Wu Y S, Dong Y, Wan W T, Wang X, Ding Z L, Gao Y D, Xiang H, Zhu B G, Lee S H, Wang W, Tian Z X. Resequencing 302 wild and cultivated accessions identifies genes related to domestication and improvement in soybean., 2015, 4: 408–414.
[13] 王彪, 常汝镇, 陶莉, 关荣霞, 闫丽, 张明恢, 冯忠孚, 邱丽娟. 分析中国栽培大豆遗传多样性所需SSR引物的数目. 分子植物育种, 2003, 1: 82–88. Wang B, Chang R Z, Tao L, Guan R X, Yan L, Zhang M H, Feng Z F, Qiu L J. Identification of SSR primer numbers for analyzing genetic diversity of Chinese soybean cultivated soybean., 2003, 1: 82–88 (in Chinese with English abstract).
[14] 范胜栩, 李斌, 孙君明, 韩粉霞, 闫淑荣, 王岚, 王连铮. 气相色谱方法定量检测大豆5种脂肪酸. 中国油料作物学报, 2015, 37: 548–553. Fan S X, Li B, Sun J M, Han F X, Yan S R, Wang L, Wang L Z. A quantitative gas chromatographic method for determination of soybean seed fatty acid components., 2015, 37: 548–553 (in Chinese with English abstract).
[15] Ma L, Li B, Han F X, Yan S R, Wang L Z, Sun J M. Evaluation of the chemical quality traits of soybean seeds, as related to sensory attributes of soymilk., 2015, 173: 694–701.
[16] McQuitty L L. Similarity analysis by reciprocal pairs for discrete and continuous data., 1996, 26: 825– 831.
[17] Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees., 1987, 4: 406–425.
[18] 徐豹, 庄炳昌, 路琴华, 王玉民, 胡传璞, 梁歧, 郑惠玉, 吕景良. 中国野生大豆()脂肪及其脂肪酸组成的研究. 吉林农业科学, 1993, (2): 1–6. Xu B, Zhuang B C, Lu Q H, Wang Y M, Hu C P, Liang Q, Zheng H Y, Lyu J L. A study of fat content and fatty acid composition of wild soybean () in China., 1993, (2): 1–6 (in Chinese with English abstract).
[19] 王连铮, 吴和礼, 姚振纯, 林红. 黑龙江省野生大豆的考察和研究. 植物研究, 1983, 3(3): 116–130. Wang L Z, Wu H L, Yao Z C, Lin H. Investigation and research of the wild soybean in Heilongjiang province., 1983, 3(3): 116–130 (in Chinese with English abstract).
[20] 姚利坡. 野生大豆与栽培大豆遗传关系研究. 河北师范大学硕士学位论文, 河北石家庄, 2009. Yao L P. Studies on the Genetic Relationship betweenand. MS Thesis of Hebei Normal University, Shijiazhuang, Hebei, China, 2009 (in Chinese with English abstract).
[21] 赵洪锟, 王玉民, 李启云, 张明, 庄炳昌. 中国不同纬度野生大豆和栽培大豆SSR分析. 大豆科学, 2001, 20: 172–720. Zhao H K, Wang Y M, Li Q Y, Zhang M, Zhuang B C. SSR analysis of wild soybean () and cultivated soybean from different latitude in China., 2001, 20: 172–176 (in Chinese with English abstract).
[22] 王金陵. 大豆的进化与其分类栽培及育种的关系. 中国农业科学, 1962, 3(1): 11–15.Wang J L. The evolution of soybean and its relationship with cultivating and breeding., 1962, 3(1): 11–15 (in Chinese).
[23] Han Y P, Zhao X, Liu D Y, Li Y H, Lightfoot D A, Yang Z J, Zhao L, Zhou G, Wang Z K, Huang L, Zhang Z W, Qiu L J, Zheng H K, Li W B. Domestication footprints anchor genomic regions of agronomic importance in soybeans., 2016, 209: 871–884.
[24] 宋万坤, 于妍, 高运来, 姜威, 刘春燕, 孙殿君, 陈庆山, 胡国华. 大豆饱和脂肪酸组分改良研究进展. 生物技术通报, 2008, (增刊1): 18–21.Song W K, Yu Y, Gao Y L, Jiang W, Liu C Y, Sun D J, Chen Q S, Hu G H. Genetic modification of saturated fatty acid composition of soybean., 2008, (suppl-1): 18–21 (in Chinese with English abstract).
[25] 吴俏槿, 杜冰, 蔡尤林, 梁钻好, 林志光, 邱国亮, 董立军.a-亚麻酸的生理功能及开发研究进展. 食品工业科技, 2016, 37(10): 386–390.Wu Q J, Du B, Cai Y L, Liang Z H, Lin Z G, Qiu G L, Dong L J. Research development of alpha-linolenic acid., 2016, 37(10): 386–390 (in Chinese with English abstract).
Characteristics of oil components and its relationship with domestication of oil components in wild and cultivated soybean accessions
CHEN Ying**, ZHANG Sheng-Rui**, WANG Lan, WANG Lian-Zheng, LI Bin*, and SUN Jun-Ming*
Institute of Crop Sciences, Chinese Academy of Agricultural Sciences / National Engineering Laboratory for Crop Molecular Breeding / Key Laboratory of Soybean Biology, the Ministry of Agriculture and Rural Affairs, Beijing 100081, China
In this study, 58 soybean accessions composed of wild, semi-wild and cultivated soybean were used to analyze the oil and fatty acid contents by the NIRs and GC methods. Their genetic diversity and domestication were also analyzed based on 32 pairs of SSR markers. There was a significant difference in oil content and fatty acid compositions between wild and cultivated soybeans. The oil content of cultivated soybean (an average of 20.8%) was significantly higher than that of wild soybean (an average of 10.49%). As regards fatty acid compositions, the content of oleic acid in cultivated soybean (an average of 28.5%) was significantly higher than that of wild soybean (an average of 14.37%), on the contrary, the content of linolenic acid was lower. In cultivated soybean, the oil content positively correlated with oleic acid content (= 0.85**), and negatively correlated with other fatty acids. Moreover, the oleic acid content had a negative correlation with all other fatty acids, especially, with linoleic acid (=-0.90**) and linolenic acid (=-0.89**). Similar clustering results were observed in the clustering and principal component analysis based on oil compositions and SSR molecular markers showing that the soybean accessions were clustered into two main subgroups of wild and cultivated soybean, and semi-wild soybean distributed into both subgroups. Therefore, we suggest that contents of oil and fatty acid compositions are related with the domestication level in soybean, and may be used as a reference index for the evolutionary classification in soybean.
;;; oil content; fatty acid components
2018-08-24;
2019-01-19;
2019-03-11.
10.3724/SP.J.1006.2019.84114
李斌, E-mail: libin02@caas.cn; 孙君明, E-mail: sunjunming@caas.cn
**同等贡献(Contributed equally to this work)
E-mail: 623882855@qq.com
本研究由国家重点研发计划项目(2016YFD0100201), 北京市科技计划项目(Z16110000916005)和中国农业科学院科技创新工程项目资助。
This study was supported by the National of Research and Development Program of China (2016YFD0100201), the Beijing Science and Technology Project (Z16110000916005), and the Innovation Project of Chinese Academy of Agricultural Sciences.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20190308.1044.006.html

