京尼平对脂多糖介导的血管通透性增加的影响及其可能机制
曹媛媛,邓加雄,李桂成,艾晨牧,李云峰
(湖南省郴州市第一人民医院重症医学科,郴州 423000)
脓毒症是临床常见危重症,而血管通透性增加导致的全身浮肿是脓毒症的主要症状,也是临床工作中亟待解决的问题之一[1]。血管内皮细胞激活是导致血管通透性增加的主要机制[2,3]。研究证实京尼平在调节血管内皮细胞功能、改善心血管疾病方面具有显著作用[4,5],但其对于脓毒症血管通透性增加的作用尚未见报道。本课题组前期证实线粒体凋亡信号通过激活天冬氨酸特异性半胱氨酸蛋白酶3(cysteine-containing aspartate-specific proteases 3,caspase-3)裂解内皮细胞紧密链接β-catenin蛋白,介导内皮通透性增加,而抑制内皮细胞凋亡信号激活可以减轻血管通透性增加[6]。且研究证实沉默信息调节因子1(silent information regulator 1,SIRT1)参与调节脂多糖介导的内皮屏障功能[7],但机制并未阐述清楚。因此本研究通过体内及体外脂多糖(lipopolysaccharide,LPS)处理模拟脓毒症血管通透性增加,观察京尼平对血管通透性的影响并研究其相关机制。
1 材料与方法
1.1 材料
FITC-白蛋白、京尼平及EX527购于美国Sigma公司;TUNEL检测试剂盒、线粒体膜电位JC-1试剂盒、caspase-3活性检测试剂盒及线粒体分离试剂盒购于美国Biovision公司;Sirtuin-1蛋白(SIRT1)单克隆抗体、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphatede hydrogenase,GAPDH)及辣根过氧化物酶(HRP)标记的二抗购于美国ABclonal公司。人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购于广州赛库生物公司。
1.2 分组及处理
1.2.1 体外实验 参照文献[7],HUVECs分为4组:对照组细胞仅接受0.1%二甲基亚砜(DMSO)处理24.5 h;模型组细胞接受0.1%DMSO预处理30 min后与500 ng/ml LPS共孵育24 h;治疗组细胞接受京尼平50 μmol预处理30 min后同模型组;抑制剂组细胞接受10 μmol EX527及京尼平50 μmol预处理30 min后同模型组。
1.2.2 体内实验 雌性SD大鼠24只,采用随机数表法分为4组(n=6):对照组大鼠经尾静脉注射0.5 ml DMSO 30 min后注射生理盐水0.5 ml,60 min后进行相关指标检测;模型组大鼠经尾静脉注射0.5 ml DMSO 30 min后注射LPS 10 mg/kg(溶于0.5 ml生理盐水),60 min后进行相关指标检测;治疗组大鼠尾静脉注射京尼平5 mg/kg 30 min后同模型组;抑制剂组大鼠经尾静脉注射EX527 5 mg/kg及京尼平5 mg/kg 30 min后同模型组。
1.3 体外指标检测
1.3.1 内皮细胞通透性检测 参照文献[7],HUVECs接种于24孔Transwell上层小室上,待细胞长至90%融合后,无血清DMEM/F12 培养基继续培养12 h,使细胞同步生长并处于静止期。根据实验方案处理,24 h后检测各组荧光A值(测定波长520 nm,激发波长492 nm)。内皮通透性Pa=(各组A值)/(对照组A值)。
1.3.2 caspase-3活性检测 细胞充分裂解后离心(4℃,12 000转/min,20 min),取上清。与试剂盒中反应液在37℃下孵育2 h,酶标仪检测荧光强度(波长405 nm),BCA法检测蛋白浓度,以荧光强度与蛋白浓度比值表示caspase-3活性,并以对照组进行标准化。
1.3.3 SIRT1含量测定 蛋白质免疫印迹试验(Western blotting)检测SIRT1含量。将细胞充分裂解后,4℃,12 000转/min,20 min,取上清,BCA法检测蛋白浓度。凝胶电泳后转膜,免疫化学发光法曝光并进行灰度值分析。以目的蛋白与内参GAPDH的灰度值比值表示目的蛋白的相对表达量,并以对照组进行标准化。
1.3.4 线粒体膜电位测定 处理后的HUVECs经PBS洗后重悬,与JC-1 在37℃孵育15 min 后酶标仪检测。荧光探针JC-1 的工作浓度为5 μmol/L。共聚焦显微镜下观察荧光变化,计算绿色荧光与红色荧光的比值,并以对照组进行标准化。该比值用来衡量线粒体去极化的程度:比例越高表明线粒体去极化增加,膜电位下降;反之则去极化下降,膜电位上升。
1.3.5 细胞凋亡测定 采用TUNEL法检测细胞凋亡,处理后的HUVECs经PBS洗后重悬,根据说明书步骤进行处理,hoechest标记细胞核,荧光显微镜下观察。
1.4 体内指标检测
1.4.1 血管通透性检测 参照文献[6],大鼠经苯巴比妥30 mg/kg肌注麻醉后正中剖腹,将一小段空肠缓慢拉出并寻找合适观察的肠系膜静脉,Kreb液持续缓慢滴注维持血管内环境稳定,予FITC-白蛋白50 mg/kg注射,并持续性滴注FITC-白蛋白0.15 mg/(kg·min)维持荧光稳定,荧光显微镜下连续观察60 min内血管FITC-白蛋白渗出情况,并分别测定血管内的荧光密度值(Ii)和血管外渗出的荧光密度值(Io),血管通透性由血管内外荧光强度变化(ΔI)决定,ΔI=Io/Ii,其ΔI值越大表示通透性越高。另外,大鼠麻醉后,一侧股动脉置入PE50管,并连接于PowerLab八通道生理记录仪连续记录血压。
1.4.2 Western blotting检测组织SIRT1蛋白表达 肠系膜血管组织充分裂解,4℃,12 000转/min,20 min,取上清,BCA法检测蛋白浓度。凝胶电泳后转膜,免疫化学发光法曝光并进行灰度值分析。以目的蛋白与内参GAPDH的灰度值比值表示目的蛋白的相对表达量,并以对照组进行标准化。
1.5 统计学处理

2 结 果
2.1 京尼平对内皮细胞通透性及caspase-3的影响
与对照组比较,模型组、治疗组及抑制剂组细胞Pa值及caspase-3显著增加。与模型组比较,治疗组Pa及caspase-3显著下降。与治疗组比较,抑制剂组Pa及caspase-3显著增加,差异均有统计学意义(P<0.05;表1)。
2.2 京尼平对内皮细胞SIRT1表达的影响
与对照组(100.0±8.9)%比较,模型组[(61.0±8.5)%]、治疗组[(86.7±7.6)%]及抑制剂组[(64.3±4.8)%]的SIRT1表达水平显著降低;与模型组比较,治疗组SIRT1表达显著升高;与治疗组比较,抑制剂组SIRT1表达显著下降,差异均有统计学意义(P<0.05;图1)。

表1 4组细胞内皮通透性及caspase-3活性比较
LPS: lipopolysaccharide; caspase-3: cysteine-containing aspartate-specific proteases 3. Compared with control group,*P<0.05; compared with LPS group,#P<0.05; compared with treatment group,△P<0.05.

图1 4组细胞SIRT1表达比较
SIRT1: silent information regulator 1; LPS: lipopolysaccharide; GAPDH: glyceraldehyde-3-phosphatede hydrogenase. Compared with control group,*P<0.05; compared with LPS group,#P<0.05; compared with treatment group,△P<0.05.
2.3 京尼平对内皮细胞线粒体膜电位的影响
与对照组[(100.0±4.8)%]比较,模型组[(343.0±28.3)%]、治疗组[(220.0±13.3)%]及抑制剂组[(309.0±18.5)%]的JC-1绿色/红色荧光比例显著增加;与模型组比较,治疗组绿色/红色荧光比值显著下降;与治疗组比较,抑制剂组JC-1绿色/红色荧光比例显著增加,差异均有统计学意义(P<0.05;图2)。
2.4 京尼平对内皮细胞凋亡的影响
与对照组[(2.3±1.4)%]比较,模型组[(40.8±8.9)%]、治疗组[(28.2±6.6)%]及抑制剂组[(38.0±9.5)%]细胞凋亡率显著增加;与模型组比较,治疗组细胞凋亡率显著下降;与治疗组比较,抑制剂组细胞凋亡显著上升,差异有统计学意义(P<0.05;图3)。
2.5 大鼠血压变化
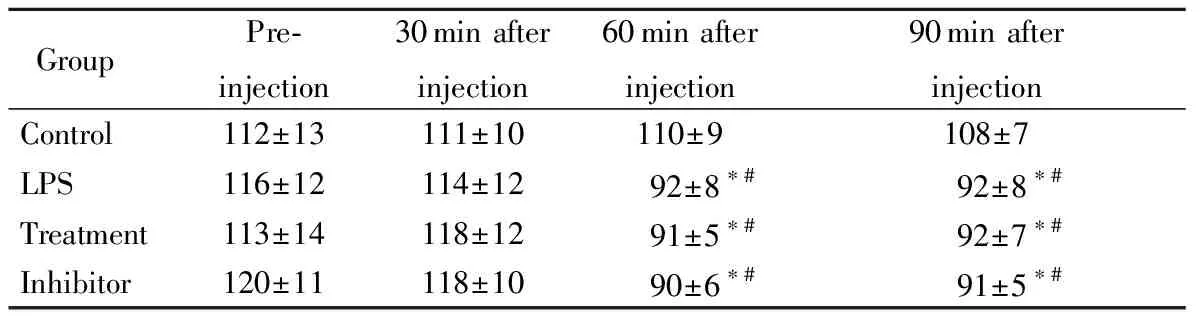
给药前各组大鼠血压差异无统计学意义(P>0.05);注射后30 min,各组大鼠血压较给药前差异无统计学意义(P>0.05);模型组、治疗组及抑制剂组大鼠在LPS注射30 min及60 min后,与处理前及对照组比较血压明显下降(P<0.05),但3组大鼠间血压比较差异无统计学意义(P>0.05;表2)。

图2 4组细胞线粒体膜电位的比较
A: fluorescent staining(×600); B: quantitative analysis results. LPS: lipopolysaccharide. Compared with control group,*P<0.05; compared with LPS group,#P<0.05; compared with treatment group,△P<0.05.

图3 4组细胞凋亡情况比较
A: TUNEL staining(×100);B: quantitative analysis results. LPS: lipopolysaccharide. Compared with control group,*P<0.05; compared with LPS group,#P<0.05; compared with treatment group,△P<0.05.
表2 各组大鼠不同时间点血压比较

Group Pre-injection30min after injection60min after injection90min after injectionControl112±13111±10110±9108±7LPS116±12114±1292±8∗#92±8∗#Treatment113±14118±1291±5∗#92±7∗#Inhibitor120±11118±1090±6∗#91±5∗#
LPS: lipopolysaccharide. 1 mmHg=0.133 kPa. Compared with control group,*P<0.05; compared with pre-injection,#P<0.05.
2.6 京尼平对肠系膜血管组织中SIRT1表达的影响
与对照组[(100.0±4.0)%]比较,模型组[(49.3±8.3)%]、治疗组[(87.3±4.7)%]及抑制剂组[(55.3±4.9)%]SIRT1表达量显著降低;与模型组比较,治疗组SIRT1表达显著上升;与治疗组比较,抑制剂组SIRT1表达显著降低,差异均有统计学意义(P<0.05;图4)。

图4 4组大鼠肠系膜血管组织SIRT1表达
SIRT1: silent information regulator 1; GAPDH: glyceraldehyde-3-phosphatede hydrogenase; LPS: lipopolysaccharide. Compared with control group,*P<0.05; compared with LPS group,#P<0.05; compared with treatment group,△P<0.05.
2.7 京尼平对血管通透性的影响
与对照组(0.12±0.03)比较,模型组(0.54±0.07)、治疗组(0.32±0.05)及抑制剂组(0.53±0.06) ΔI显著增加;与模型组比较,治疗组大鼠ΔI显著减弱;与治疗组比较,抑制剂组大鼠ΔI显著增强,差异均有统计学意义(P<0.05;图5)。

图5 4组大鼠血管通透性的比较
LPS: lipopolysaccharide. A: fluorescent staining(×100);B: quantitative analysis results. Compared with control group,*P<0.05; compared with LPS group,#P<0.05; compared with treatment group,△P<0.05.
3 讨 论
脓毒症是感染导致的全身炎症反应综合征,是临床常见的危重症[8]。LPS是格兰阴性细菌细胞壁的成分之一,由于格兰阴性细菌在脓毒症致病菌中的重要地位,许多研究将LPS应用在脓毒症的模型中[9,10]。本研究中,我们在细胞水平发现经LPS刺激,HUVECs内皮通透性显著增加;在动物水平,通过在荧光显微镜下观察肠系膜血管白蛋白的渗出来检测血管通透性发现,注射LPS后,大鼠血管内的荧光白蛋白向外渗出明显,提示血管通透性增加。以往研究证实,京尼平可以显著改善血管内皮细胞功能障碍,在心血管疾病治疗方面有一定的疗效[4,5],但是其对于血管通透性是否有影响却少见报到。我们通过研究发现,京尼平可以显著减少LPS介导的内皮细胞及血管通透性增加。
SIRT1是沉默信息调节因子2相关酶家族中的一员,参与线粒体代谢及生成,而其在调节血管内皮细胞方面具有重要作用[11,12]。研究证实,SIRT1激活剂SRT1720可以显著抑制LPS介导的血管通透性增加[7,13],那么京尼平是否通过激活SIRT1发挥其对血管通透性的保护作用呢?我们进一步研究发现,LPS导致内皮细胞及血管组织中SIRT1的表达显著下降,但京尼平可以显著提高内皮细胞及血管组织中SIRT1的表达,而SIRT1抑制剂EX527则可以显著抑制京尼平对SIRT1激活。另外我们还发现,EX527可以抑制京尼平对内皮及血管通透性的保护效应,提示京尼平可能通过SIRT1发挥作用。
本课题以往研究证实,线粒体凋亡信号在血管通透性增加中起着重要作用,抑制线粒体凋亡信号可以显著改善血管通透性增加[14]。线粒体通透性转变孔开放后导致膜电位下降,细胞色素C等线粒体小分子蛋白释放进入细胞质,进而激活下游caspase-3[15]。caspase-3的众多底物中包括β-catenin,而β-catenin是内皮之间紧密连接的重要组成部分,裂解后可导致内皮-内皮间链接破坏,间隙增大,最终引起血管通透性增加[16]。我们的研究证实,在内皮细胞中LPS可导致肠系膜血管线粒体膜电位下降、caspase-3激活及细胞凋亡,提示线粒体凋亡信号激活。而京尼平可以显著抑制内皮细胞线粒体凋亡信号激活,从而发挥血管通透性的保护作用。加之EX527可以抑制京尼平对线粒体凋亡信号的抑制作用,进一步证实京尼平可能通过激活SIRT1发挥血管通透性保护作用。
综上,京尼平可能通过抑制线粒体凋亡信号激活,最终抑制LPS介导的血管通透性增加,而这些效应可能与激活SIRT1有关。下一步的研究,我们将探讨京尼平激活SIRT1的机制。

