鸭圆环病毒ORF3蛋白多克隆抗体的制备与应用
李浩然 武专昌 刘会会 朱晓慧 韩旭 张冉 张国良 夏小静 王鑫
摘 要:鸭圆环病毒(DuCV)感染引起淋巴细胞凋亡,其ORF3蛋白是唯一具有凋亡活性的病毒蛋白,但目前ORF3特异性抗体的缺乏限制了其生物学功能的深入研究。DuCV包含基因I型和基因II型两种基因型,利用软件分析两基因型ORF3同源性,选取保守性肽段进行多肽合成,并与钥孔血蓝蛋白(KLH)偶联,多次加强免疫兔子,采集血清并纯化IgG后制备ORF3多克隆抗体。ELISA检测发现此抗体能特异性与ORF3保守肽段反应,并具有较高的效价,间接免疫荧光(IFA)显示此抗体能特异性识别两基因型ORF3蛋白,但并不能用于western blot检测,说明此多抗主要识别ORF3空间构象的表位。总之,我们成功制备了特异性识别两种基因型DuCV ORF3蛋白的抗体,为今后深入探究DuCV ORF3蛋白的生物学功能提供了良好的研究工具。
關键词:鸭圆环病毒;ORF3蛋白;多肽合成;多克隆抗体
中图分类号:Q511 文献标识码:B 文章编号:1673-1085(2019)3-0036-05
鸭圆环病毒(Duck Circovirus,DuCV)属于圆环病毒科圆环病毒属,单链环状DNA病毒,主要引起鸭的免疫抑制性疾病,感染的鸭子主要表现为羽毛凌乱、生长迟缓、体重减轻,胸腺、法氏囊、脾脏不同程度出血肿胀、淋巴细胞坏死等特征[1]。
组织病理学分析发现该病毒感染主要引起鸭法氏囊淋巴细胞减少、萎缩、组织细胞增生等[2],原位荧光检测也表明DuCV感染鸭后在鸭的脾脏、胸腺和法氏囊中形成明显的病灶[3],提示我们DuCV的致病作用可能主要与引起淋巴细胞的凋亡相关,这与PCV2的致病机理极为相似。相琪强等[4] (2012)发现DuCV基因组中除了含有编码衣壳蛋白(Cap)和复制相关蛋白(Rep)两个重要的ORF之外,位于ORF V1的互补链上的第三个功能阅读框ORF3,该蛋白大小约为9.2kD,与CAV的VP3和PCV2的ORF3蛋白大小相近,且具有诱导细胞凋亡的能力。
目前,DuCV根据基因组序列同源性分为基因I型和基因II型两种基因型[5],魏宗等[6](2011)发现ORF3基因在两基因型中也存在明显的差异,大小分别为297bp和237bp,同型之间氨基酸的同源性为88.6%~100%,而两型之间氨基酸的同源性只有72.2%~81.0%。王鑫等[7](2018)首次报道了ORF3蛋白的核定位信号,并阐明了两基因型ORF3 C端差异的20个氨基酸序列在调控ORF3胞核定位与凋亡活性中的关键作用。为进一步研究ORF3的生物学作用,阐明DuCV ORF3蛋白的生物学功能,本研究利用人工合成多肽法成功制备ORF3蛋白特异性的兔源多克隆抗体,并建立针对两基因型DuCV ORF3的间接免疫荧光检测方法,为今后深入探究DuCV的ORF3蛋白的生物学功能奠定了基础。
1 材料与方法
1.1 试验材料 质粒G2-ORF3(FJ0601株ORF3基因与GFP融合表达质粒)、G1-ORF3(WF0701株ORF3基因与与GFP融合表达质粒)由实验室保存[1];抗原多肽由上海友科生物科技有限公司合成;弗氏完全佐剂、弗氏不完全佐剂购自美国Sigma公司;GFP单抗、HRP-羊抗兔IgG均购自英国Abcam公司;ECL试剂盒购自美国Thermo Scientific公司;其余试剂均为国产分析纯。
1.2 特异性DuCV ORF3抗原肽段的合成 根据DuCV ORF3基因编码的氨基酸序列,利用在线蛋白分析软件对两基因型DuCV ORF3蛋白共同抗原表位、亲水性和抗原性进行分析,确定抗原肽段氨基酸序列,由上海友科生物科技有限公司合成并耦联KLH(耦联剂为Sulfo-SMCC),合成后置于4℃保存备用。
1.3 多肽的溶解与保存 重组多肽的溶解性与多肽的极性有关。人工合成的多肽溶解前先加入DMSO粉末(每1mg多肽溶于200~300μl的DMSO),然后用pH为7.8左右的PBS定容至1ml,所得多肽浓度为1mg/ml。溶解后的多肽分装至冻存管中置于-20℃冰箱保存备用,避免反复冻融。
1.4 多克隆抗体的制备 将溶解后的抗原与弗氏佐剂按1:1进行乳化,取一滴乳化后的液体滴在水面,若液体呈球形而不扩散,则证明抗原与弗氏佐剂乳化完全。将乳化完全后的抗原按0.6mg/只对兔子进行颈背部皮下多点注射,每隔2周加强免疫1次,首免用弗氏完全佐剂,之后用弗氏不完全佐剂,免疫5次后,颈动脉采血并分离血清,分装保存于-80℃。
1.5 ELISA测定兔源多克隆抗体的特异性与效价 将偶联KLH的多肽做包被原,采用间接非竞争ELISA测定ORF3抗体的效价,在经过4次加强免疫后,检测抗体效价,进行颈动脉采血,分离得到血清,分装保存于-80℃备用。
1.6 间接免疫荧光(IFA)检测多抗的反应性 G2-ORF3、G1-ORF3质粒转染DF-1细胞48h后,4%多聚甲醛进行细胞固定,用1:500稀释的抗ORF3多抗37℃孵育1h后,PBS清洗3次。加入1:1000稀释的Alex Fluor594标记的羊抗兔二抗37℃孵育1h,最后用DAPI染细胞核后封片,观察荧光。
1.7 western blot检测多抗的反应性 G2-ORF3、G1-ORF3质粒转染DF-1细胞48h后,收集细胞,样品进行SDS-PAGE电泳后,转印PVDF膜,5%脱脂奶粉室温封闭1h,用1:2000稀释的抗ORF3多抗4℃孵育12h,TBST洗膜5次,15min/次。加入1:10000稀释的HRP标记的羊抗兔IgG,室温孵育2h,TBST洗膜5次,15min/次,用ECL发光试剂盒显影。
2 结果
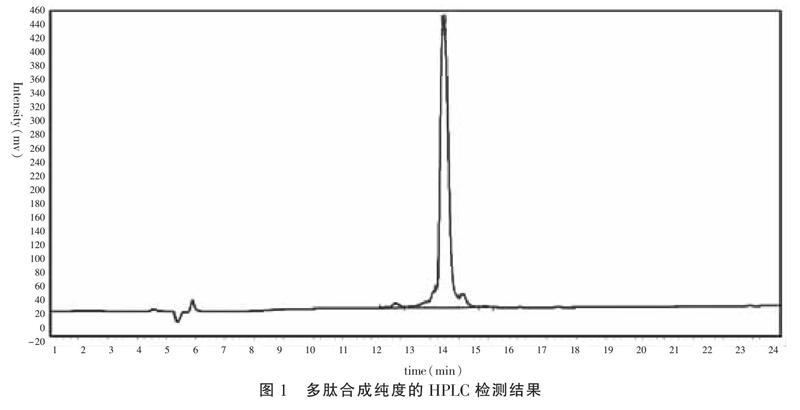
2.1 DuCV ORF3多肽氨基酸序列分析 利用在线蛋白分析软件对两基因型DuCV ORF3蛋白氨基酸序列进行分析,选择两基因型共同的抗原表位,避免选择蛋白内部重复或接近重复端的序列作为抗原,以提高获得抗体的特异性。经过蛋白信号肽、亲水性和抗原性分析,最终选择C-IPGHERARLFLPAT-NH2作为合成多肽的序列。采用固态多相合成法合成多肽,与KLH耦联后经高效层析纯化,并经高效液相色谱分析鉴定后纯度达到后续试验要求。化学合成多肽经HPLC检测其纯度,结果见图1,合成肽的多肽纯度较高,杂峰少。经计算该多肽的纯度为90.01%,符合免疫纯度要求。
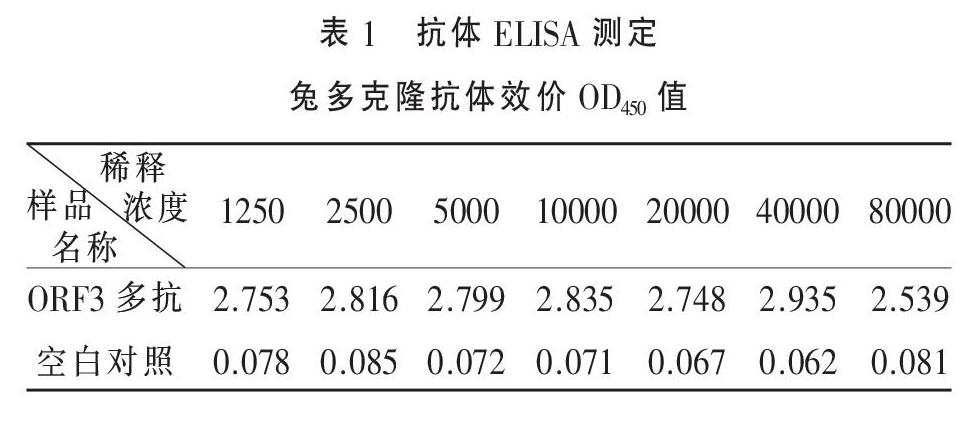
2.2 ORF3兔源多克隆抗体ELISA效价测定 间接ELISA检测兔血清抗多肽抗體OD值,采用多肽与BSA偶联物做包被原,包被浓度为1μg/ml, 进行间接非竞争ELSIA,阳性判断的依据是抗体检测OD450值/空白对照检测OD450值>2.1。5次免疫后,KLH偶联肽免疫兔子血清抗多肽抗体效价不低于1:80000。
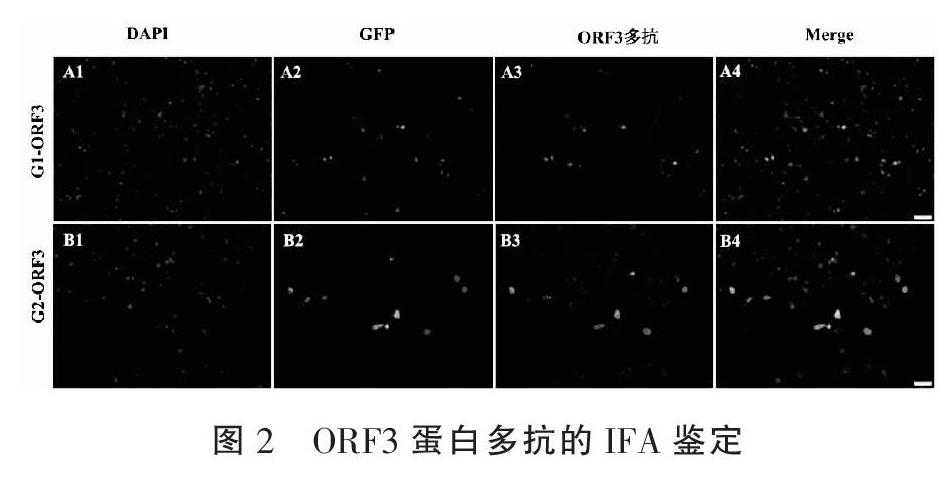
2.3 ORF3兔源多克隆抗体的应用 G2-ORF3、G1-ORF3质粒转染DF-1细胞后48h,固定细胞进行间接免疫荧光或收集细胞进行western blot,检测ORF3蛋白的表达。IFA结果显示,1:200稀释的ORF3兔源多抗能同时与G2-ORF3、G1-ORF3蛋白反应,和融合表达的GFP能很好的共定位(图2)。但将制备的兔源ORF3多克隆抗体1:2000稀释进行western blot时,并未检测到ORF3蛋白表达,而GFP抗体能检测到GFP-G2-ORF3、GFP-G1-ORF3的表达(图3)。说明制备的ORF3兔源多抗可用于两基因型ORF3蛋白的免疫荧光检测。
3 讨论
鸭圆环病毒能引起鸭免疫抑制性疾病,感染的鸭子会损害免疫系统,常伴随鸭疫里默氏杆菌、多杀性巴氏杆菌、大肠杆菌、鸭肝炎病毒、鸭瘟病毒等的感染[7-10],并且感染鸭圆环病毒后,会显著提高这些病原感染的几率[8,9],提示DuCV在鸭传染病混合感染总扮演重要角色。然而 DuCV的致病机制、病毒蛋白功能与致病性关系尚不清楚。猪II型圆环病毒(PCV2)感染仔猪可引起淋巴结中淋巴细胞凋亡,进而抑制免疫系统功能,易造成多种病原的继发感染和混合感染[11];鸡贫血病毒(CAV)感染导致鸡骨髓脂肪化和胸腺皮质萎缩,骨髓造血干细胞的破坏导致严重的贫血、粒细胞和血小板减少,前T淋巴细胞凋亡可引起细胞毒性T细胞和辅助性T细胞的减少,从而使鸡的免疫力降低,对其它病原的易感性增强[12,13]。比较CAV与PCV,说明圆环病毒诱导淋巴细胞凋亡是引起免疫损伤和免疫抑制的重要途径。原位荧光检测也显示DuCV感染鸭后在脾脏、胸腺和法氏囊中形成明显的病灶[3],并引起淋巴细胞坏死,说明DuCV致病作用可能主要与引起淋巴细胞的凋亡相关。
ORF3是目前已知的DuCV唯一具有诱导细胞凋亡活性的病毒蛋白,其核浆定位对其凋亡活性具有重要调控作用,两基因型ORF3的亚细胞定位和凋亡活性存在明显差异。但病毒自然过程中,ORF3表达与淋巴细胞凋亡的关系目前并不清楚,组织原位分析和DuCV反向遗传系统是进一步探究两者作用关系的重要手段。但目前缺乏针对ORF3的特异性抗体,限制了其功能的深入研究。为此,本研究利用在线蛋白分析软件对DuCV ORF3蛋白氨基酸序列进行分析,人工合成氨基酸序列为C-IPGHERARLFLPAT-NH2的多肽,将多肽与载体蛋白KLH耦联作为免疫原,经与弗氏完全佐剂乳化后免疫新西兰大白兔,制备了兔抗DuCV ORF3蛋白的多克隆抗体。
制备的ORF3多克隆抗体具有较高的效价和特异性,ELISA效价可达1:80000,IFA试验中,1:200稀释均能很好地识别转染的DF-1细胞表达的基因I型和基因II型ORF3蛋白。但western blot无法检测到两基因型的ORF3蛋白,而蛋白变性后多为线性表位,进一步说明此多抗可能主要针对的是ORF3蛋白的构想表位。使用本实验中制备的鸭圆环病毒ORF3蛋白的多克隆抗体进行凋亡活性相关的研究,对进一步阐明鸭圆环病毒的致病性提供了很好地生物学材料。
参考文献:
[1] Hattermann, K., Schmitt, C., Soike, D., Mankertz, A.Cloning and sequencing of Duck circovirus (DuCV)[J].Archives of virology,2003,148:2471-2480.
[2] Hong Y T, Kang M, Jang H K. Pathogenesis of duck circovirus genotype 1 in experimentally infected Pekin ducks[J].Poultry Science, 2018, 97:3050-3057.
[3] 刘少宁,杨金保,张兴晓,等.鸭圆环病毒FJ0601株Rep蛋白的原核表达及其抗血清制备[J].中国兽医学报, 2010(1):10-12.
[4] Xiang Q W, Wang X, Xie Z J, et al. ORF3 of duck circovirus:A novel protein with apoptotic activity[J].Veterinary Microbiology,2012,159(1-2):251-256.
[5] Wang D, Xie X, Zhang D, et al. Detection of duck circovirus in China: A proposal on genotype classification [J].Veterinary Microbiology,2011,147(3-4):410-415.
[6] 魏宗,鄒金峰,雷战,等.鸭圆环病毒ORF3基因的克隆及序列分析[J].中国预防兽医学报,2011,33(9):746-748.
[7] Wu Z C, Zhang R H, Li Y M, et al. C-terminal 20 residues of ORF3 protein of duck circovirus genotype 2 regulates the nuclear localization and inhibits apoptotic activity of ORF3 protein[J]. Veterinary Microbiology, 2018, 214:21-27.
[8] Banda A,Galloway-Haskins R I,Schat S K A. Genetic Analysis of a Duck Circovirus Detected in Commercial Pekin Ducks in New York (Análisis filogenético de un circovirus de pato detectado en patos pequineses comerciales en Nueva York) [J]. Avian Diseases, 2007, 51(1):90-95.
[9] Zhang X, Jiang S, Wu J, et al. An investigation of duck circovirus and co-infection in Cherry Valley ducks in Shandong Province, China[J]. Veterinary Microbiology, 2009, 133(3):252-256.
[10] Cha S Y, Kang M, Cho J G, et al. Genetic analysis of duck circovirus in Pekin ducks from South Korea[J].Poultry Science, 2013, 92(11):2886-2891.
[11] Cha S Y,Song E T, Kang M, et al. Prevalence of Duck Circovirus Infection of Subclinical Pekin Ducks in South Korea[J].Journal of Veterinary Medical Science, 2014, 76(4):597-599.
[12] Wei L, Zhu S, Wang J, et al. Regulatory role of ASK1 in porcine circovirus type 2-induced apoptosis[J]. Virology, 2013, 447(1-2):285-291.
[13] Jeurissen S H M, Wagenaar F, Pol J M A, et al. Chicken anemia virus causes apoptosis of thymocytes after in vivo infection and cell lines after in vitro infection[J]. Journal of Virology, 1993, 66(12):7383-7388.
[14] Todd D.Circoviruses: Immunosuppressive threats to avian species: A review[J]. Avian Pathology.

