肠道菌群对心血管疾病和肾脏的影响
杨晓安、潘娅综述, 陈亚丽审校
人体内有大量细菌、古细菌、病毒和单细胞真核生物,这些与宿主共存的微生物的集合被称为微生物群[1]。肠道菌群主要为厚壁菌门、拟杆菌门、放线菌门、变形菌门四类,肠道菌群的个体差异是由宿主基因组的差异所造成,但也受环境因素影响。厚壁菌门和拟杆菌门在肠道菌群中的比例约为80%~90%,厚壁菌门与拟杆菌门的比值(F/B)是反应肠道菌群紊乱的重要指标;另外,肠道菌群的丰度、多样性和均匀度也是肠道菌群的重要指标[2]。肠道菌群主要通过糖分解和蛋白水解代谢途径参与食物的消化[3]。糖分解代谢途径中肠道菌群通过分解糖类和产生短链脂肪酸(SCFA),SCFA 作为信号分子参与代谢、免疫和感染,主要包括甲、乙、丙、丁、戊酸盐,其中乙、丙、丁酸盐约为95%[4];蛋白水解代谢途径中肠道菌群通过分解蛋白质,诱导SCFAs
形成,同时生成氨、胺、硫醇、酚类和吲哚等代谢产物,这些代谢产物具有潜在的毒性[3]。肠道菌群参与肠黏膜屏障的构成和调节,控制营养吸收和代谢,协助免疫组织的成熟,防止病原微生物的传播[5]。肠道菌群可以说是体内最大的内分泌器官,能产生多种生物活性物质如激素,进入血液循环,从而影响不同的生物过程[6];同时可调节约10%的宿主转录,尤其是与免疫、细胞增殖和新陈代谢有关的基因[7]。
心血管疾病的发展过程受到许多因素的影响,其中肠道及肾脏的作用不容忽视。肠道、肾脏作为机体主要代谢产物的排泄器官,如果代谢产物不能及时有效地排除,机体各个器官将会受累,心脏也无法避免;反之,心脏功能下降后肠道、肾脏的功能也会受到影响,所以肠道-肾脏-心脏作为一个整体相互影响(图1)。
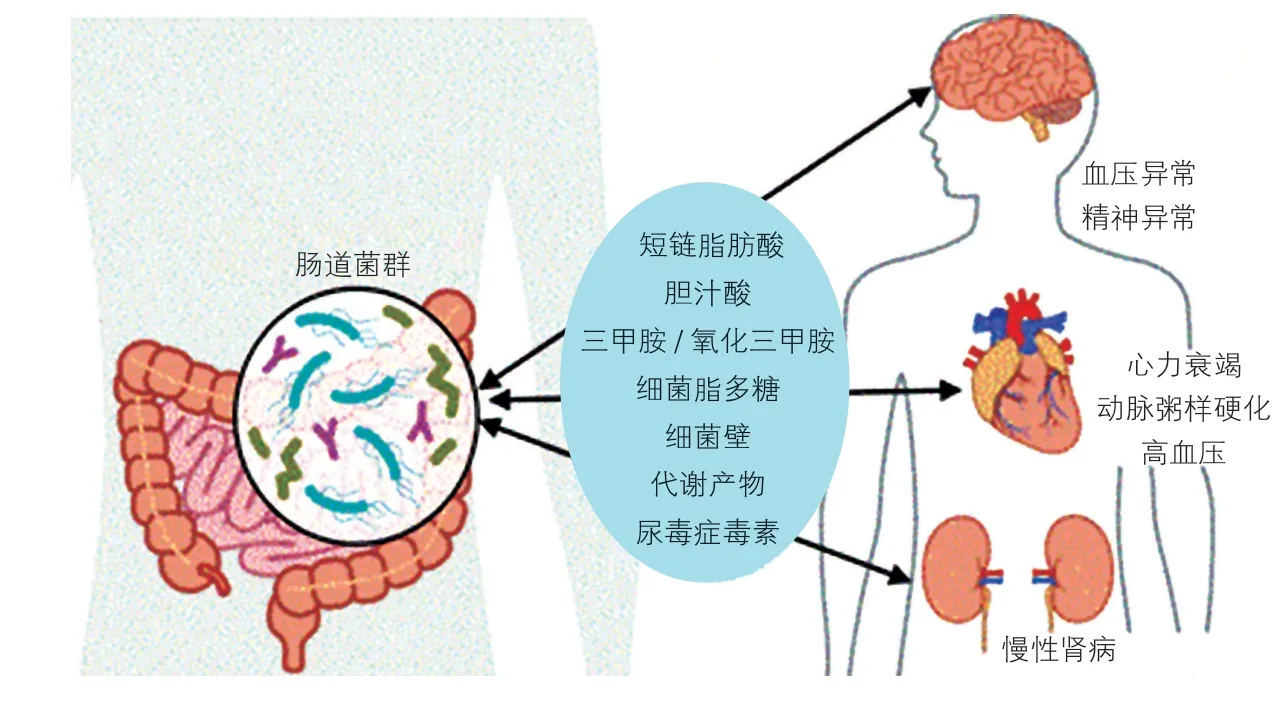
图1 肠道菌群对心脏和肾脏的影响
1 肠道菌群对心血管疾病的影响
心血管疾病(CVD)是全球人群主要的致死原因,在其发展过程中动脉粥样硬化扮演着十分重要的角色,随着他汀药物的出现,血脂水平得到控制进而有效控制了动脉粥样硬化的快速进展,但仍有部分患者使用了高强度他汀动脉粥样硬化未能有效控制。随着科学水平的发展,肠道菌群的作用进一步被发现,其在CVD 的发展中发挥了十分重要的作用,可以通过降低多种危险因素如血脂、血糖、血压等改善CVD 的预后。
1.1 肠道菌群与动脉粥样硬化、冠心病和心力衰竭
动脉粥样硬化与冠心病紧密相关,研究发现动脉粥样硬化斑块含有细菌DNA,在动脉粥样硬化斑块中观察到的细菌类群也存在于同一个体的肠道内,因此,肠道菌群可能影响斑块的稳定性和CVD的发展[8]。三甲胺(trimethylamine,TMA)是肠道菌群产生的一种有机化合物,经肝脏代谢后形成氧化三甲胺(trimethylamine N-oxide,TMAO),TMAO 具有致动脉粥样硬化作用[9-10],在富含胆碱饮食的小鼠中发现血浆TMAO 水平增加,巨噬泡沫细胞形成,主动脉粥样硬化斑块大小增加[11]。TMAO 对CVD的不利临床结果在人类的队列研究中已被报道,在最初的人体研究中证明了与TMAO 相关的胆碱、甜菜碱和左旋肉碱与CVD 的发生密切相关[10]。TMAO比起传统的CVD 危险因素,如血脂、C-反应蛋白、肾功能,有更好的预测价值,TMAO 的水平与5 年全因死亡率呈正相关[12]。TMAO 与粥样硬化斑块的破裂和长期CVD 事件风险相关,在动物模型中发现TMAO 改变血小板钙信号通路和诱发血栓;结果表明,TMAO 可能是冠状动脉斑块进展和心肌梗死风险增加的一个标志[13-15]。
心力衰竭患者由于容量负荷较重引起肠道淤血同时伴有缺血,使肠道菌群发生紊乱,肠道的通透性增加,这将使得过多的毒素进入到血液循环,同时激活细胞因子及产生全身炎症反应,加重心力衰竭的进展[16]。新研究发现,心力衰竭患者可能有肠道过度生长的致病细菌和念珠菌,心功能越差致病菌发展速度越快;并增加肠道通透性,与临床疾病的严重程度、静脉淤血、炎症相关联[17]。张媛等[18]研究发现TMAO ≥5 μmol/L 组与TMAO<5 μmol/L 组相比,N 末端B 型利钠肽原(NT-pro BNP)[(5 603.00±770.40) ng/L vs (2 472.00±383.70)ng/L,P=0.019]水平显著升高,左心室射血分数(LVEF)[(35.00%±6.50%)vs(42.00%±3.20%),P=0.024]显著降低。血浆TMAO 水平与NT-pro BNP 及心功能分级呈正相关(r=0.73,P<0.01)与LVEF 呈负相关(r=-0.58,P<0.01),结果显示TMAO 水平与老年慢性心力衰竭患者的心功能相关,心功能越差TMAO越高。
1.2 肠道菌群与高血压
高血压是CVD 中一个十分重要的危险因素,进来已有研究将高血压与肠道菌群联系在一起。Yang等[19]研究发现,无论是在动物模型,还是在人类高血压组,肠道菌群的丰度明显下降。另外,高血压大鼠模型中发现,肠道菌群丰度下降,F/B 升高,产乙酸盐及丁酸盐的肠道菌群较少。TMAO 具有一定的升高血压的作用[20];另一代谢产物SCFAs 具有降低血压的作用,研究发现在敲除了GPR41 的小鼠模型中补充SCFAs 未发现血压下降,因此GPR41可能介导SCFAs 的降压作用[21];Marques 等[22]研究发现补充SCFAs 乙酸盐的小鼠模型收缩压(85±9)mmHg(1 mmHg=0.133 kPa,P=0.0002)、舒 张 压(54±8)mmHg(P<0.0001)。因此,肠道菌群对血压的变化起着重要作用,受到多种因素共同作用,包括遗传、生活方式和抗生素的使用等[23]。
1.3 肠道菌群与血脂异常
血脂异常在CVD 同样扮演着十分重要的角色,尽管随着他汀药物的问世,血脂异常得到有效控制,心血管疾病患者受益明显,但仍有部分患者出现血脂残余[24-26]。已有研究报道肠道菌群可以影响机体血脂水平,虽然肠道菌群及其代谢产物可能影响宿主脂质代谢的潜在生物学机制尚未被列举,但由于肠道菌群产生次级胆汁酸可以调节肝脏和全身脂质代谢已被提及[26]。TMAO 的致动脉粥样硬化作用与胆固醇的逆向转运减少,组织中的胆固醇和甾醇代谢的改变及胆汁酸的组成改变有关[20]。
1.4 肠道菌群与肥胖、2 型糖尿病
肥胖患者逐年增加,被归咎于能量的过度摄入和运动量的减少,肥胖可导致胰岛素抵抗和糖尿病、CVD 风险的增加。进来研究表明肠道菌群在肥胖的发展中具有关键作用,肥胖患者中F/B 比值升高[27],肠道菌群与更高水平的促炎细胞因子有关[28],高脂饮食可能影响肠上皮的完整性,导致屏障功能受损,并增加肠道对细菌的通透性[29]。2型糖尿病患者中产SCFAs 丁酸盐细菌减少,SCFAs尤其是丁酸盐,为肠上皮细胞能量底物;而乳酸杆菌增加。SCFAs 通过GPR43 可以抑制胰岛素介导的脂肪堆积[30];在有限的人体研究中发现SCFAs 可作用于饮食中枢,使得食欲下降,预防肥胖,增加能量消耗,促进饱腹激素产生,改善糖代谢和胰岛素抵抗[31]。A. muciniphila 是一种革兰氏阴性细菌,居住在黏液层,构成3%~5%的肠道菌群[32];几个实验和人类研究表明,A. muciniphila 浓度与肥胖和糖尿病的存在负相关[33];益生元如低聚果糖显著增加A. muciniphila 水平对代谢控制具有有利影响[34]。
2 肠道菌群对肾脏的影响
慢性肾衰竭状态下肠道菌群会发生明显变化,尤其是终末期肾病患者大多存在肠道功能紊乱。慢性肾病(CKD)患者之所以会发生明显的肠道菌群改变[35],主要基于以下几点:(1)慢性肾衰竭状态下代谢废物不能充分经肾脏排泄而蓄积于体内,导致血液中的废物浓度升高,这些废物通过丰富的肠壁血管进入肠腔使肠腔内呈现高代谢废物水平状态,最终使肠道菌群的结构、数量和分布发生改变,导致肠道微生态严重失衡,可表现为益生菌的减少和腐生菌的过度生长。(2)肠道菌群种类及数量与维生素K 密切相关,而CKD 患者维生素K 明显缺乏,因此可导致肠道微生态的改变。(3)医源性因素的影响:如抗生素的过度使用及口服铁剂等因素可引起的病原菌滋生等。动物实验进一步证实高TMAO 饮食可使大鼠肾脏纤维化程度明显加重。长期的菌群失调还可加剧机体微炎症状态,进一步心血管疾病的风险及死亡率,加速CKD-矿物质和骨异常等并发症的发生发展。
3 肠道菌群与饮食的关系
饮食结构与肠道菌群息息相关,饮食结构的改变同时会引起肠道菌群的组成变化和功能改变。高脂饮食可因造成肠道内养料来源减少、改变氧化还原状态、破坏菌群赖以生存的微环境来影响肠道菌群的构成。高纤维饮食及补充SCFAs 乙酸盐可使产乙酸盐菌群数量增加,血液及粪便中乙酸盐水平升高,起到降低血压,降低心脏、肾脏与体重的比率,改善心脏功能,增加基因表达,改善心脏、肾脏纤维化的作用[20]。益生菌、益生元具有调节胃肠菌群平衡能力,能够显著地影响肠道菌群的结构和活动,使有益菌占有生态位,成为优势菌群,抑制霉菌生长和霉菌毒素的产生[36]。益生菌可使肠道中的菌群呈现多样性,群落的复杂程度增高,肠道菌群的微生态稳定性增强。低聚麦芽糖、低聚半乳糖等益生元则能不同程度的被有益菌分解利用,作为有益菌的生长促进剂,发挥其益生作用。所以高纤维饮食及补充SCFAs、益生菌、益生元有助于改善肠道菌群的组成和功能;反之,高脂及高糖饮食起到相反的作用。
4 总结
综上所述,肠道菌群代谢产物TMA 的氧化产物TMAO 的作用被进一步认识,其在CVD、CKD的发展过程中起到举足轻重的作用,心脏、肾脏及肠道三者之间相互影响,联系紧密,应该将三者视为一个整体,重视肠道菌群在心肾疾病中的作用,将肠道菌群管理纳入慢性心肾疾病管理范畴,重视饮食结构对肠道菌群的影响。由于TMAO 的明确致病作用,抑制TMAO 的生成可使CVD、CKD 的发生明显降低,从而提出了新的治疗方向,通过对抑制微生物的胆碱三甲胺酶活性,减少TMA 的生成,进而使TMAO 水平降低,该治疗方法在CVD、CKD中具有良好的发展情景[12]。

