原研诺氟沙星片与自研诺氟沙星片溶出曲线对比
吴莲琴 范师振
【摘要】 目的:比较自研诺氟沙星片与原研诺氟沙星片的体外溶出行为,评价自研诺氟沙星片的质量。方法:按照中国药典2015年版诺氟沙星片的溶出度测定法,采用紫外-可见分光光度法(中国药典2015年版四部通则0401),在277 nm的波长处测定吸光度,计算溶出量,测定自研与原研诺氟沙星片在pH 1.2盐酸溶液,pH 4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液三种溶出介质中的溶出曲线,并采用f2相似因子法对溶出曲线的相似性进行比较,结果:在不同溶出介质中,自研制剂与原研制剂比较,f2相似因子均大于50,溶出曲线相似。结论:自研诺氟沙星片与原研诺氟沙星片体外溶出行为一致,质量可靠。
【关键词】 诺氟沙星片; 原研; 溶出曲线; f2相似因子
doi:10.14033/j.cnki.cfmr.2019.13.077 文献标识码 B 文章编号 1674-6805(2019)13-0-03
诺氟沙星片为喹诺酮类抗菌药,具广谱抗菌作用,尤其对革兰阴性杆菌的抗菌活性高,临床常用于敏感菌所致的尿路感染和肠道感染等。该产品适用于敏感细菌所引起的急、慢性肾盂肾炎、膀胱炎、前列腺炎、细菌性痢疾、胆囊炎、伤寒、产前产后感染、盆腔炎、中耳炎、鼻窦炎、急性扁桃腺炎及皮肤软组织感染等,也可作为腹腔手术的预防用药[1-2]。
诺氟沙星口服制剂的原研产品为日本杏林制药株式会社生产的诺氟沙星片,1984年在日本批准上市,目前100 mg规格仍在临床中广泛应用,并且是日本《医疗用医药品品质情报集》(平成23年3月31日)收载的参比制剂(96页)。但尚未进口,也未地产化。
溶出度是指药物从片剂、胶囊剂或颗粒剂等固体制剂在规定条件下的溶出速率和程度,其重要性不言而喻[3]。近年来,溶出度试验已成为评价制剂质量和生产工艺的重要指标之一。普通口服固体制剂,可采用比较仿制制剂与参比制剂体外多条溶出曲线相似性的方法,评价仿制制剂的质量。溶出曲线的相似并不意味着两者一定具有生物等效,但该法可降低两者出现临床疗效差异的风险。在确定药物主成分稳定性满足测定方法要求的前提下,推荐选择不少于3种pH值的溶出介质进行溶出曲线考察,如选择pH值1.2、4.5和6.8的溶出介质[4]。本文根据目前进行仿制药质量一致性评价工作,选择pH 1.2盐酸溶液,pH 4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液三种溶出介质对自研和原研诺氟沙星片的溶出曲线进行考察,评价自研产品的质量。
1 仪器与试剂
1.1 仪器
天大天发RC860D溶出试验仪,普析TU-1810紫外可见分光光度计,ZA305AS分析天平。
1.2 试剂
盐酸(分析纯,莱阳经济技术开发区精细化工厂),醋酸钠(分析纯,天津福晨化学试剂厂),氢氧化钠(分析纯,国药集团化学试剂有限公司),冰醋酸(分析纯,天津市富宇精细化工有限公司),磷酸二氢钾(分析纯,国药集团化学试剂有限公司),水(纯化水),诺氟沙星对照品(中国食品药品检定研究院,批号:130450-201206),原研诺氟沙星片(规格:0.1 g,日本杏林制药株式会社,批号:T001),自研诺氟沙星片(规格:0.1 g,山东艾诺吉医药科技有限公司,批号:201710121)。
2 方法与结果
2.1 溶出方法
日本橙皮书 、中国药典、美国药典、英国药典、印度药典均选择了浆法,转速50转/min,也符合《普通口服固体制剂溶出度试验技术指导原则》和《普通口服固体制剂溶出曲线测定与比较指导原则》中推荐的转速,因此,溶出试验也采用浆法、转速50转/min,溶出介质参考《普通口服固体制剂溶出曲线测定与比较指导原则》选择pH 1.2盐酸溶液,pH 4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液三种溶液,体积1 000 ml[5-8]。
2.2 溶出介质
(1)pH 1.2盐酸溶液:取9.0 ml盐酸,用水稀释至1 000 ml,摇匀,即得。(2)pH 4.5醋酸盐缓冲液:取醋酸钠2.99 g,2 mol/L醋酸溶液14 ml,用水溶解并稀释至1 000 ml,摇匀,即得。(3)2 mol/L醋酸溶液:取冰醋酸120.0 g(114 ml)用水稀释至1 000 ml,搖匀,即得。(4)pH 6.8磷酸盐缓冲液:取27.22 g磷酸二氢钾固体,加水1 000 ml制得0.2 mol/L磷酸二氢钾溶液;取8.0 g氢氧化钠固体加水1 000 ml,制得0.2 mol/L氢氧化钠溶液;取250 ml 0.2 mol/L磷酸二氢钾溶液与112 ml 0.2 mol/L氢氧化钠溶液混合,用水稀释至1 000 ml,摇匀。
2.3 溶出度试验
分别取原研诺氟沙星片(批号:T001)与自研诺氟沙星片(批号:201710111)12片,照中国药典2015年版溶出度测定法第二法(浆法),以各溶出介质1 000 ml为溶剂,转速50 r/min,在pH 1.2盐酸溶液,pH4.5醋酸盐缓冲液分别于10、15、30 min时,在pH 6.8磷酸盐缓冲液分别于10、20、30、45、60 min时取溶液10 ml,立即补充相同温度、相同体积的溶出介质,溶液过滤,取续滤液适量,加溶出介质定量稀释至每1 ml约含5 μg的溶液作为供试品溶液。精密称取诺氟沙星对照品适量,用溶出介质稀释至约5 μg/ml,作为对照品溶液。分别照紫外-分光光度计,在波长277 nm处测吸光度,计算溶出度和累计溶出度,绘制溶出曲线[9-12]。
2.4 结果
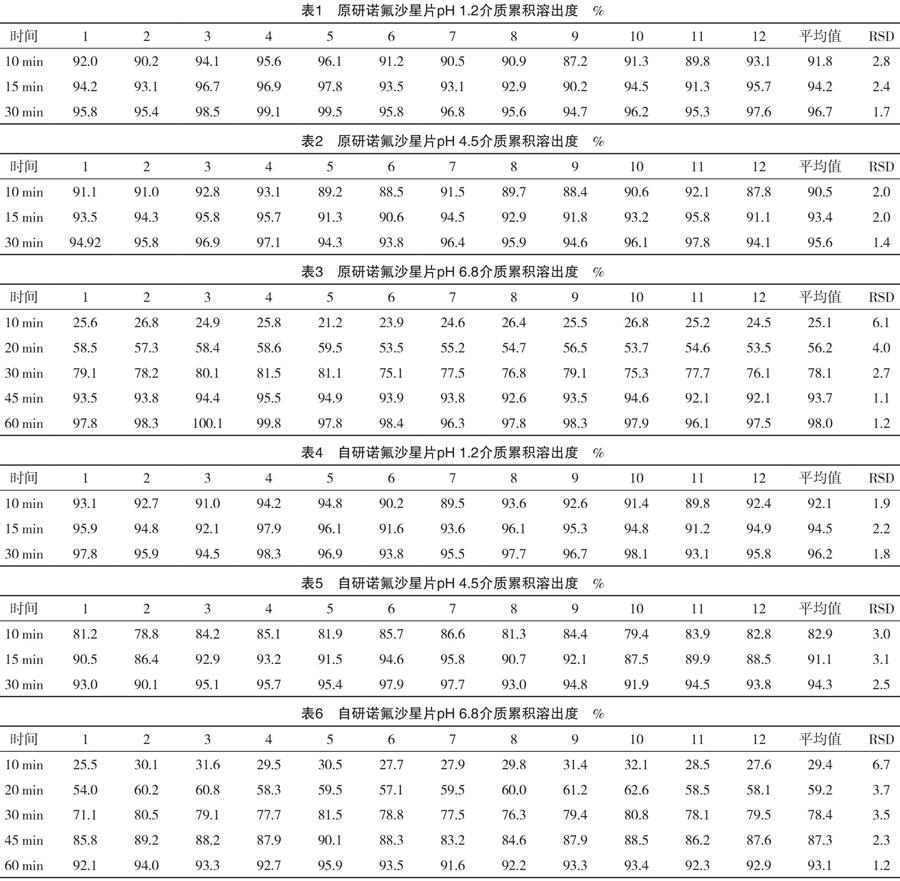
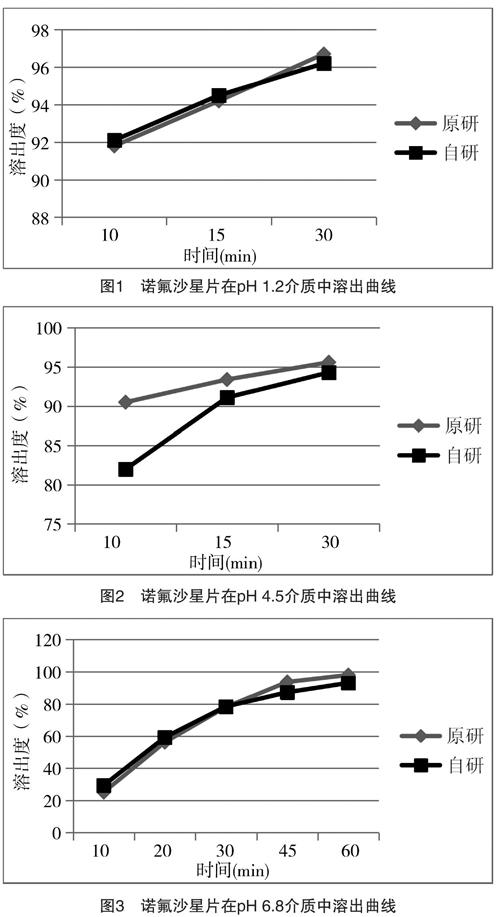
溶出度结果见表1~表6,溶出曲线见图1~图3。
2.5 不同介质中的溶出曲线相似性评价
溶出曲线相似性的比较,多采用非模型依赖法中的相似因子(f2)法。该法溶出曲线相似性的比较是将受试样品的平均溶出量与参比样品的平均溶出量进行比较。平均溶出量应为12片(粒)的均值。
计算公式:
f2=50×lg{[1+(1/n)∑nt=1(Rt-Tt)2]-0.5×100}
Rt为t时间参比样品平均溶出量;Tt为t时间受试样品平均溶出量;n为取样时间点的个数。
参照《普通口服固体制剂溶出曲线测定与比较指导原则》采用相似因子(f2)法比较溶出曲线相似性时,一般情况下,当两条溶出曲线相似因子(f2)数值不小于50時,可认为溶出曲线相似。当受试样品和参比样品在15 min的平均溶出量均不低于85%时,可认为溶出曲线相似[4]。
由表1和表2可知,在pH 1.2和pH 4.5溶出介质中,原研和自研诺氟沙星片在15 min平均溶出量均高于85%,所以在pH 1.2和pH 4.5溶出介质中,溶出曲线相似。由f2计算公式,计算在pH 6.8溶出介质中自研和原研诺氟沙星片溶出曲线的相似因子f2=68.5>50,溶出曲线相似。所以在三种溶出介质中,自研和原研诺氟沙星片溶出曲线均相似。
3 讨论
(1)诺氟沙星在水或乙醇中极微溶解;在醋酸、盐酸或氢氧化钠溶液中易溶。因此,诺氟沙星片在pH 6.8磷酸盐缓冲液介质中溶出稍慢,在pH 4.5醋酸溶液和pH 1.2盐酸溶液介质中溶出较快,10 min溶出即达到90%以上。(2)溶出曲线的对比实验是有效分辨固体药物制剂内在质量的方法,本文通过选择三种不同的溶出介质进行溶出曲线比较,充分考虑了药物在体内的环境。最终,根据溶出结果可以得出在三种溶出介质中,自研和原研诺氟沙星片溶出曲线均相似,由此可以判定自研产品和原研产品质量一致。(3)本研究的目的是基于国内仿制药品的审评政策,研究本实验室研究的诺氟沙星制剂与原研产品的溶出曲线是否一致。本实验中参比制剂为日本原研,1984年就已批准上市,事实上为30多年前的老工艺。限于国内仿制药品的审评政策,在工艺质量要求上仍力求溶出曲线与其保持一致。对于这种技术要求是否合理,笔者持保留意见。药剂学上传统理论中对制剂“三效、三小”要求中的“速效”仍应该是工艺质量追求的目标。20世纪80年代以来,各种强效崩解剂及新的制剂工艺的出现,已经使片剂胶囊的工艺出现了极大进步。现在还要求国内制剂与国外80年代的溶出曲线完全一致未免有些刻舟求剑。
参考文献
[1]陆娟.诺氟沙星胶囊在不同介质中的体外溶出度比较[J].中国医药指南,2012,10(9):400-401.
[2]谢沐风,操洪欣.溶出度测定中的若干问题[J].中国医药工业杂志,2006,37(12):859-861.
[3]谢沐风.改善溶出度评价方法,提高固体药物制剂水平[J].中国医药工业杂志,2005,36(7):447-451.
[4]国家食品药品监督管理总局通告(2016年第61号),普通口服固体制剂溶出曲线测定与比较指导原则[S].2016.
[5]杨静,李翔,刘建芳,等.诺氟沙星胶囊实时溶出度考察[J].解放军药学学报,2010,26(2):128-130.
[6]黄洋,杜一男,刘丽,等.诺氟沙星胶囊的溶出度考察[J].医药前沿,2013,14(33):149.
[7]吴琼珠,郑旭,姜慕炎,等.诺氟沙星胶囊溶出度及体内生物利用度研究[J].南京军医学院学报,1994,12(3):175-177.
[8]郁引飞,金瓯.诺氟沙星直肠栓的研制[J].中国药业,1998,15(3):35.
[9]陈加飞,王平,赵昕,等.国产与原研洛索洛芬钠片的体外溶出曲线一致性的比较[J].国际检验医学杂志,2015,36(2):198-199.
[10]姜海波.米诺膦酸水合物片与原研产品的溶出曲线对比研究[J].黑龙江医学,2013,26(4):608-609.
[11]刘振民,余鸿生.诺氟沙星片的物理稳定性[J].沈阳药科大学学报,1997,16(2):83-87.
[12]龚俊强,陈仙,徐彩虹,等.琥珀酸索利那新片自研制剂与原研制剂溶出曲线的相似性评价[J].中国药房,2016,27(30):4311-4314.

