HIF-1α对大鼠内皮细胞通透性的影响及作用机制
蒋智永,胡子健,孟承颖 ,黄海良,段声梁,蒋 薇,王 欢,余又新,孙业祥,方林森,胡德林
烧伤早期组织缺血缺氧是血管通透性改变的重要机制,大量的炎症因子及转录因子参与其中,而缺氧诱导因子-1(hypoxia-inducible factor 1α,HIF-1α)在烧伤休克早期血管通透性增加中占有重要位置;此外烧伤早期血管通透性改变主要发生在微静脉和毛细血管,微静脉由内皮细胞、周静脉、基底膜及少量平滑肌组成,而内皮细胞在血管通透性改变中起着重要作用,因此,研究血管通透性的变化及其调控机制对烧伤休克的防治以及预防烧伤早期组织器官损害均有重要意义。然而,烧伤后血管内皮细胞通透性变化的作用机制及调控途径目前尚不清楚,该实验以原代大鼠主动脉内皮细胞为研究对象,通过探讨HIF-1α/内皮素-1(endothelin-1,ET-1)信号通路的调控作用以期为进一步阐明烧伤早期血管通透性改变的机制及烧伤的临床治疗提供新思路。
1 材料与方法
1.1 材料原代大鼠主动脉内皮细胞购自武汉原生原代生物医药科技有限公司;RNA提取试剂盒购自购自天根生化科技(北京)有限公司;反转录试剂盒购自美国Thermo Fish公司;RT-PCR试剂盒购自大连TakaRa公司;细胞培养基购自美国Hyclone公司;胎牛血清购自美国Gibco公司;RIPA细胞裂解液、BCA蛋白定量试剂盒购自杭州碧云天生物技术研究所;磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH)、HIF-1α、ET-1、内皮素受体A(endothelin receptor A,ETA)、ETB和闭锁小带(zonula occludens,ZO-1)抗体购自美国Santa Cruz公司;PCR引物购自美国Invitrogen公司。
1.2 方法
1.2.1细胞培养 应用含10%胎牛血清、100 U/ml青霉素、100 g/ml的链霉素、pH 7.4的RPMI1640的培养基于37 ℃、5% CO2培养箱中培养原代大鼠主动脉内皮细胞,隔天换液,观察细胞生长状况,当细胞汇合度约为90%时,进行消化、传代、种板,按1×105/孔接种于6孔细胞培养板。继续培养细胞至汇合度为80%时,将培养基更换为无血清RPMI1640培养基,进行后续实验。
1.2.2载体构建 HIF-1α干扰、过表达及其阴性对照组载体均由上海吉凯基因化学技术有限公司构建,干扰载体分别标记为短发夹RNA(short hairpin RNA,shRNA-Ⅰ)、shRNA-Ⅱ、shRNA-Ⅲ和短发夹RNA阴性对照组(short hairpin RNA negative control group,shRNA-NC),干扰序列见表1。过表达载体标记为GV230/HIF-1α和GV230。

表1 HIF-1α干扰序列
1.2.3细胞转染及稳转细胞株筛选 按1×106/孔将细胞接种于6孔细胞培养板,继续培养细胞至汇合度为70%~80%,使用Lipofectamine 2000并参照其说明书分别将HIF-1α干扰及过表达载体转染至原代大鼠主动脉内皮细胞,同时设置阴性对照组。6 h后更换为含200 μg/ml遗传霉素G418(geneticin,G418)的细胞培养基筛选稳转细胞株。同时,抑制剂组BQ123和BQ788先于GV230/HIF-1α 1 h加入细胞培养基。
1.2.4RT-PCR 应用预冷的PBS洗涤细胞3次,参照细胞总RNA提取试剂盒说明书提取细胞总RNA。以总RNA为模板,参照逆转录试剂盒说明书合成cDNA第一链。以cDNA为模板,使用ABI7500 RT-PCR仪检测相关基因的表达。RT-PCR反应程序为:95 ℃、5 s;60 ℃、34 s,设置循环数为40。以β-actin作为内参,采用2-ΔΔCt法比较分析各基因表达,PCR引物序列见表2。

表2 RT-PCR引物序列
1.2.5Western blot 从RIPA细胞裂解物中提取细胞的总蛋白。用BCA方法定量后,将样品以50 μg/孔的剂量进行电泳和膜转化。转移完成后,5%脱脂奶粉在室温下密封1.5 h,TBST洗涤3 min,每种蛋白抗体根据抗体说明书操作,在4 ℃下孵育过夜,每次用TBST洗涤3次,每次5 min。相应的次级抗体在室温下孵育1.5 h,TBST每次洗涤3次,每次洗涤10 min,ECL发光、显影。Quantity One灰度分析软件检测各目的蛋白灰度值,以β-actin为内参计算其相对表达量。
1.2.6单层内皮细胞膜通透系数检测 将各组内皮细胞按1×105/孔接种于24孔Transwell小室,37 ℃、5% CO2培养8 h待其形成细胞单层。双层小室的顶室加入FITC-albumin,底室加入D-Hank’s液,在37 ℃、5% CO2孵育45 min并抽吸双室的顶部和底部腔室液体。在荧光分光光度计波长为488 nm下测定各样品荧光强度(optical density,OD)值OD488 nm,计算单层内皮细胞膜通透系数。

2 结果
2.1 HIF-1α shRNA有效序列筛选将3条HIF-1α shRNA分别转染原代大鼠主动脉内皮细胞,24 h后RT-PCR和Western blot分别检测HIF-1α的表达,同时设置shRNA-NC组作为对照组。结果显示:shRNA-Ⅰ、shRNA-Ⅱ 和shRNA-Ⅲ 的干扰效率分别为(67.14±7.28)%、(83.55±9.16)%和(52.84±6.48)%。shRNA-Ⅰ、shRNA-Ⅱ 和shRNA-Ⅲ组分别和shRNA-NC比较(T=22.222,P<0.001;T=24.449,P<0.001;T=15.278,P<0.001),shRNA-Ⅱ 的干扰效率最高,差异有统计学意义(P<0.01),见图1。
2.2 HIF-1α低表达及过表达对细胞膜通透性相关蛋白表达的影响分别将shRNA-Ⅱ及GV230/HIF-1α转染原代大鼠主动脉内皮细胞,应用浓度为200 μg/ml G418筛选4周,构建稳转细胞株。应用RT-PCR和Western blot分别检测HIF-1α、ET-1、ETA、ETB和ZO-1 mRNA和蛋白表达水平的变化。检测结果显示:与shRNA-NC组相比,稳转shRNA-Ⅱ组HIF-1α(T=22.73,P<0.001)、ET-1(T=17.99,P<0.001)、ETA(T=11.27,P=0.004)和ETB(T=23.19,P=0.001) mRNA和蛋白表达均明显降低,而ZO-1(T=12.46,P=0.002)则显著升高,差异有统计学意义(P<0.01),见图2A、2B。与转染GV230组比较,稳转GV230/HIF-1α组HIF-1α(T=13.23,P=0.002)、ET-1(T=14.86,P=0.001)、ETA(T=14.86,P=0.001)和ETB(T=27.29,P=0.001) mRNA和蛋白表达显著升高,而ZO-1(T=16.17,P<0.001)则显著降低,差异有统计学意义(P<0.01),见图2C、2D。
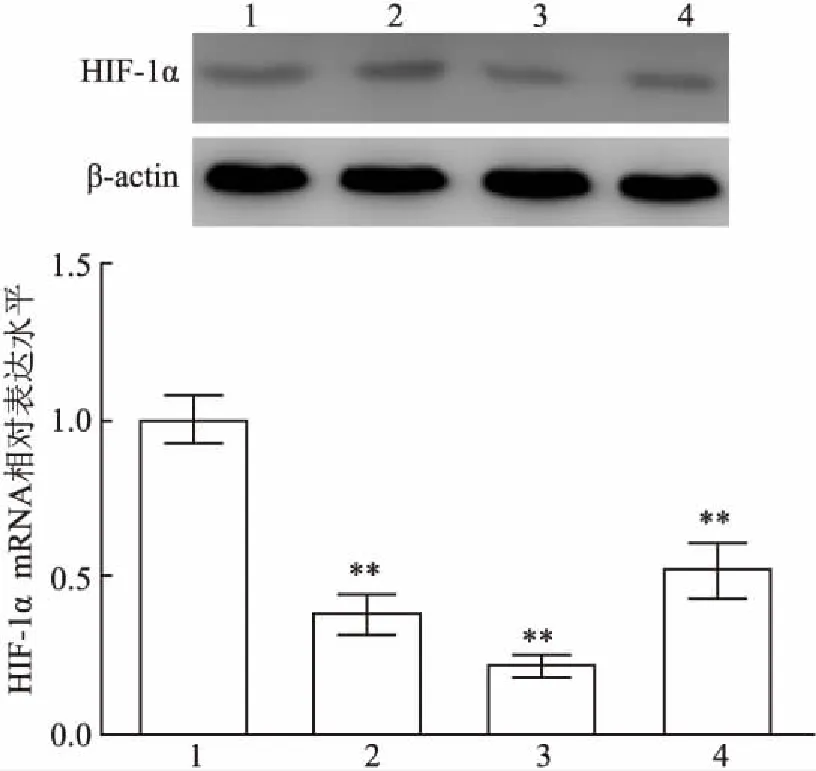
图1 转染不同shRNA对HIF-1α表达的影响
2.3 HIF-1α过表达对大鼠主动脉内皮细胞通透性系数的影响分别检测GV230组和GV230/HIF-1α组样品的荧光强度值(OD488 nm),并将GV230组细胞通透系数均一化为100%,计算GV230/HIF-1α组单层内皮细胞膜通透性系数。结果显示,与GV230组比,GV230/HIF-1α(T=6.765,P<0.001)组细胞通透性系数明显升高,差异有统计学意义(P<0.01),见图3。
2.4 阻断HIF-1α/ET-1信号通路对相关蛋白表达和细胞通透性的影响联合应用浓度分别为10 nmol/L的BQ123和1 nmol/L的BQ788预处理稳转GV230/HIF-1α大鼠主动脉内皮细胞1 h,RT-PCR和Western blot分别检测HIF-1α、ET-1、ETA、ETB和ZO-1 mRNA和蛋白表达。同时,荧光分光光度计检测各组荧光度值。结果显示,BQ123和BQ788能够抑制HIF-1α诱导的ETA和ETB表达、增强ZO-1的表达,单层细胞膜通透性系数降低,差异有统计学意义(P<0.01),见图4、5。

图2 干扰及过表达HIF-1α对细胞膜通透性相关基因表达的影响
A:HIF-1α干扰后相关mRNA表达;B:HIF-1α干扰后相关蛋白质表达;C:HIF-1α过表达后相关mRNA表达;D:HIF-1α过表达后相关蛋白质表达;1:转染shRNA-NC组;2:稳转shRNA-Ⅱ组;3:转染GV230组;4:稳转GV230/HIF-1α组;与shRNA-NC组比较:**P<0.01;与GV230组比较:##P<0.01

图3 HIF-1α过表达对内皮细胞通透性系数的影响与GV230组比较:**P<0.01

图4 阻断HIF-1α/ET-1信号通路对相关蛋白的mRNA及蛋白质表达影响
A:阻断HIF-1α/ET-1信号通路相关mRNA表达; B:阻断HIF-1α/ET-1信号通路相关蛋白质表达;1:GV230/HIF-1α组;2:GV230/HIF-1α+BQ123/BQ788组;与GV230/HIF-1α组比较:**P<0.01
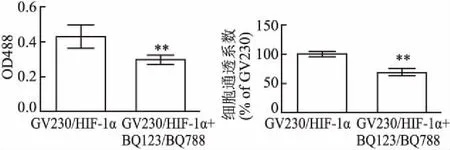
图5 阻断HIF-1α/ET-1信号通路对细胞膜通透性影响
3 讨论
细胞通透性改变是炎性反应、组织缺氧以及细胞代谢障碍等多种疾病的重要病理过程。烧伤早期血管通透性改变受多种因素调节,而内皮细胞损伤占有重要地位[1],内皮细胞在组织和血管中起生理屏障作用[2-3],这道屏障允许小分子物质通过,禁止大分子物质通过;而大分子物质通过细胞链接、细胞上的窗孔和跨细胞途径跨越细胞通过内皮细胞屏障到达组织中,大量血浆样液体及高分子物质从血管内渗出血管外,引起血容量骤减造成休克发生和发展。而机体缺氧更使血管通透性增加,这样反复形成恶性循环[4]。烧伤早期血管活性物质及炎性介质释放改变了血管结构,从而改变血管通透性[5]。但是至目前为止,烧伤早期血管通透性改变发生的具体机制仍不明确[6],因而临床更无有效的预防治疗手段来降低血管通透性。
HIF-1α是一种异源二聚体转录因子并广泛分布于人体内,它由120 ku的HIF-1α和91~94 ku的HIF-1β两个亚单位组成[7]。正常情况下,机体合成的HIF-1蛋白很快失去活性,HIF-1蛋白只有在机体缺氧条件下才能具有活性。其中α亚基决定着HIF-1的调控活性,被激活的HIF-1α通过增加与下游基因的缺氧反应元素结合,从而调控多种转录因子的转录和翻译[8]。
ET-1是内皮细胞分泌的血管活性肽,具有强烈的缩血管作用,而烧伤早期由于机体缺氧ET-1高度表达,研究[ 9]表明ET-1可以通过与其相应受体结合而发挥各种生物活性,而ET-1启动子的某位点可以结合HIF-1,从而促进内皮细胞ET-1表达的激活,ET-1在炎症反应方面有重要作用,如刺激中性粒细胞和巨噬细胞释放各种促炎因子,导致失控性炎症反应,结果导致血管内皮细胞损伤加重[10],通透性增加,组织缺氧加重细胞损伤,形成恐性循环导致多器官功能障碍综合征[11]。
研究[12-14]显示当大鼠缺血缺氧时,HIF-1α、ET-1、ETA、ETB mRNA和蛋白表达水平均显著升高,提示 HIF-1α可能参与了主动脉内皮细胞通透性的调控,但是其作用机制尚未阐明。
本研究结果显示HIF-1α能明显提高细胞膜通透性系数,应用ET-1信号通路抑制剂预处理HIF-1α过表达细胞株后细胞膜通透性系数则明显降低,该结果进一步证明HIF-1α促进血管内皮细胞通透性升高的可能性,同时说明,HIF-1α/ET-1信号轴在调控烧伤大鼠血管通透性方面具有重要作用。

