番茄漆斑病病原鉴定及防治药剂室内活性筛选
霍建飞,郝永娟,杨秀荣,姚玉荣,孙淑琴,刘春艳,王万立
(天津市植物保护研究所,天津 300384)
【研究意义】番茄是我国设施蔬菜中普遍种植的蔬菜,由于其营养价值高、口感好而备受人们喜爱。由于蔬菜大棚种植年限增加以及环境变化,在番茄上出现了一些新病害。2013年12月在天津市植保所武清创新基地温室番茄上发现一种新病害,该病主要危害叶片,严重时病斑连片,病斑褐色至深褐色,圆形至椭圆型,病斑处下陷,病斑正面具有同心轮纹,该病严重影响了番茄的产量及质量。对引起该病的病原菌进行鉴定,并对该菌进行室内药剂筛选试验,筛选高效的化学药剂,以期为防治该病害提供理论依据,对于田间有效防治该病害具有重要意义。 【前人研究进展】目前关于植物病害鉴定的研究较多,传统的形态学鉴定与分子生物学相结合的方法已广泛应用于植物病害病原的鉴定,如根腐病菌(Fusariumsporotrichioide)[1]、褐斑病菌(Alternariaalternata)[2]炭疽病菌(Colletotrichumgloeosporioides)[3-4],在番茄病害方面,番茄颈腐根腐病[5]、番茄枯萎病[6]、番茄白粉病[7]等也通过形态学特征结合rDNA-ITS 序列分析的方法鉴定出病原菌。在天津市植物保护研究所武清创新基地大棚中发现的番茄叶部病害与赵彦杰等[8]于2006-2008年在北京地区蔬菜种植基地发现的番茄漆斑病(病原为Myrotheciumroridum)症状相似,但是否由M.roridum引起还有待明确。【本研究切入点】本研究采用真菌形态学及对病菌DNA的ITS区进行序列分析相结合的方法对引起该病的病原菌进行准确鉴定,并对该菌进行室内药剂筛选试验,【拟解决的关键问题】以期筛选出高效的化学药剂,为科学防治该病奠定基础。
1 材料与方法
1.1 供试材料
供试番茄:番茄品种为“天冠”(购买于天津市西青区辛口镇佳信兴农农资店), 番茄病叶于2013年12月在天津市植物保护研究所所武清创新基地温室中发现,2013年12月10日采集病叶用于病原的分离鉴定。
供试药剂:10 %苯醚甲环唑(difenoconazole)水分散粒剂,东莞市瑞德丰生物科技有限公司;430 g/L戊唑醇(tebuconazole)悬浮剂、41.7 %氟吡菌酰胺(fluopyram)悬浮剂,德国拜耳作物科学公司;80 %多菌灵(carbendazim)可湿性粉剂,河北省化学工业研究院;250 g/L吡唑醚菌酯(pyraclostrobin)乳油、50 %醚菌酯(kresoxim-methyl)水分散粒剂,巴斯夫欧洲公司;250 g/L嘧菌酯(azoxystrobin)悬浮剂,先正达(苏州)作物保护有限公司;德国拜耳作物科学公司(红字应去掉)75 %百菌清(chlorothalonil)可湿性粉剂,江苏省新沂市科大农药厂;45 %咪鲜胺(prochloraz)水乳剂,北京北农天风农药有限公司。供试试剂:NaCl,Tris-HCl,EDTA,PVP,CTAB,β-巯基乙醇,氯仿,异戊醇,NaAc,75 %乙醇,琼脂糖等均为国产分析纯。Goldview、Gel Extraction Kit 胶回收试剂盒均为康为世纪公司生产。培养基: 马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,简称PDA)(1L 水中含葡萄糖20 g、马铃薯200 g、琼脂18 g)。仪器:Eclipse 80i荧光显微镜,尼康仪器(上海)有限公司;Bio-RAD电泳仪,北京伯乐生命科学发展有限公司;Sigma3K15离心机,美国Sigma公司;KodakGellogic 2200 凝胶成像仪,Kodak公司;RXZ-280C型人工气候箱,宁波江南仪器厂。
1.2 试验方法
1.2.1 病原菌的分离、纯化及形态学鉴定 在无菌条件下将病叶病斑剪下用5 %次氯酸钠溶液表面消毒1~2 min,用无菌水冲洗3次,置于PDA平板培养基上25 ℃下恒温培养,约2~3 d长出菌丝后挑取边缘菌落进行纯化。待菌丝生长产生分生孢子后,将分生孢子挑入灭菌蒸馏水中,配制成浓度约为1.0×106个/mL的孢子悬浮液,用灭菌毛细管吸取少量孢子悬浮液于PDA平板上,置于25 ℃下培养48 h后观察培养基上形成的微小菌落,将由单个孢子形成的微小菌落及周围培养基一起切下,转入另一PDA培养基上培养,以获得该病原菌的单孢纯化菌株[9]。
观察纯化的病原菌在PDA平板上的菌丝形态、颜色、产孢情况及孢子形状、大小、产孢器、孢子梗等形态特征。
1.2.2 病原菌的致病性测定 将纯化的菌株挑入PDA平板培养基中培养,待其产生分生孢子后将其配制成浓度约为1.0×106个/mL的孢子悬浮液,将其均匀喷施到健康番茄植株(提前在营养钵中育好的番茄苗,苗龄约30 d)叶片上,接种后置于人工气候箱中培养(白天14 h,温度25 ℃,相对湿度95 %;夜间10 h,22 ℃,相对湿度90 %),观察并记录发病情况。待其发病后再次分离病原菌,并与原接种菌株进行比较。
1.2.3 分子生物学鉴定 采用易润华等[10]的CTAB法提取病原菌DNA。用灭菌的牙签挑取50 mg左右新鲜菌丝于研钵中,加600 μl CTAB提取缓冲液(含0.7 mol/L NaCl,100 mmol/L Tris-HCl pH8.0,20 mmol/L EDTA,10 g/LPVP,20 g/LCTAB,0.1 %β-巯基乙醇),充分研磨后移入1.5 mL的Eppendorf管中,于水浴锅中65 ℃下保温30 min,加等体积氯仿/异戊醇混合液[V(氯仿)∶V(异戊醇)=24∶1]充分摇匀,4 ℃下10 000 r/min离心5 min。移取上清液至新的Eppendorf管中,加10 %体积的3 mol/L pH 6.0 NaAc溶液和2.5倍体积的冰冻乙醇,4 ℃下10 000 r/min离心5 min,弃上清液,用70 %的酒精洗2~3次,晾干,加TE缓冲液(含10 mmol/L Tris-HCl,1 mmol/L pH 8.0 EDTA)充分溶解后,在-20 ℃下保存备用。
PCR引物为真菌核糖体DNA(rDNA)的ITS区通用引物ITS1和ITS4,引物序列(北京三博远志生物技术有限责任公司合成如下:ITS1:5′-TCCGTAGGTGAACCTGCGC-3′,ITS4:(5′-TCCTCCGCTTATTGATATGC-3′)。PCR体系为50 μl:25 μl Mixture混合液,100 ng/μl模板DNA 2 μl,10 μmol/L引物ITS1 和ITS4各2 μl,ddH2O 19 μl。PCR反应条件:95 ℃ 预变性 5 min;95 ℃ 变性45 s,56 ℃ 退火 45 s,72 ℃ 延伸 45 s,共 35 个循环;最后72 ℃延伸10 min,置4 ℃保存备用。PCR产物在1.2 %琼脂糖凝胶(含0.5 μg/mL Goldview) 中电泳,凝胶成像仪上照相并保存。PCR产物经Gel Extraction Kit 胶回收试剂盒回收纯化后委托金唯智生物科技有限公司进行克隆及测序。
1.2.4 病原菌室内药剂筛选 采用平皿法[11]测定不同药剂对番茄油漆斑病菌的抑菌率。供试药剂(1.1材料中的供试药剂)直接用水溶解稀释,根据药剂活性,各药剂设置的系列质量浓度不同(10 %苯醚甲环唑水分散粒剂设置浓度分别为200、100、50、10、1、0.1 μg/mL;430 g/L戊唑醇悬浮剂设置浓度分别为200、100、50、10、1、0.1 μg/mL;41.7 %氟吡菌酰胺(悬浮剂设置浓度分别为10、1、0.5、0.1、0.01 μg/mL;80 %多菌灵可湿性粉剂设置浓度分别为10、5、1、0.1、0.01 μg/mL;250 g/L吡唑醚菌酯乳油设置浓度分别为100、50、10、1、0.1、0.01 μg/mL;50 %醚菌酯水分散粒剂设置浓度分别为100、50、10、1、0.1、0.01 μg/mL;250 g/L嘧菌酯悬浮剂设置浓度分别为100、50、10、1、0.1、0.01 μg/mL;75 %百菌清可湿性粉剂设置浓度分别为200、100、50、10、1 μg/mL;45 %咪鲜胺水乳剂设置浓度分别为100、50、10、1、0.1 μg/mL)。在无菌操作下,根据试验处理吸取预先融化的灭菌培养基36 mL加入到无菌50 mL三角瓶中,从低浓度到高浓度依次吸取4 mL药液,分别加入上述三角瓶中,充分摇匀。然后等量倒入3个培养皿中(直径为9 cm),制成相应浓度的含药平板。设不含药剂的处理作为空白对照,每个处理3个重复。
将培养好的病原菌在无菌条件下用灭菌打孔器(直径为3 mm)在菌落边缘切取菌饼,用接种器将菌饼接种于含药平板中央,菌丝面朝上,盖上皿盖,置于26 ℃培养箱中培养9 d后,用卡尺测量菌落直径,每个菌落用十字交叉法垂直测量直径各1次,取其平均值,试验设3个重复。计算各药剂对番茄漆斑病菌的抑菌率 ,利用SPSS19.0软件计算EC50、EC90及毒力回归方程。抑菌率= (空白对照菌落半径-药剂处理菌落半径 )/空白对照菌落半径×100 %。
1.3 数据分析
试验数据采用SPSS19.0软件进行统计分析。
2 结果与分析
2.1 病害症状、病原菌的分离纯化及形态学特征
该病斑褐色或深褐色,椭圆形至圆形,病斑处下陷,有的病斑周围具有黄色晕圈,病斑正面具有同心轮纹(图1-a);经分离培养该菌在PDA平板上形成的菌落颜色初为白色,绒毛状,26 ℃下培养5 d以后开始产生黑色或墨绿色的油漆状分生孢子堆(图1-b),菌落背面为淡黄色(图1-c);分生孢子座浅杯状,无刚毛(图1-d),分生孢子梗丛生,帚状(图1-e),分生孢子单胞,杆状,无色,两端各有1~2个小油球,PDA平板培养状态下孢子大小为 (6.33~9.00) μm×(1.28~2.33) μm(图1-f)。根据形态学特征,该病菌初步鉴定为露湿漆斑菌Myrotheciuroridum

a:番茄漆斑病典型病斑; b:PDA平板培养的正面菌落;c:PDA平板培养的背面菌落; d:分生孢子座;e:分生孢子梗;f:分生孢子a: Typical lesions on tomato leaves; b: Positive mycelium colony cultured on the PDA plate; c: Reverse mycelium colony cultured on the PDA plate; d: Sporodochium; e: Conidiophores; f: Conidiospores图1 番茄漆斑病症状及病原菌的形态学特征Fig.1 Symptom s of tomato myrothecium leaf spot and morphological characteristics of Myrothecium roridum
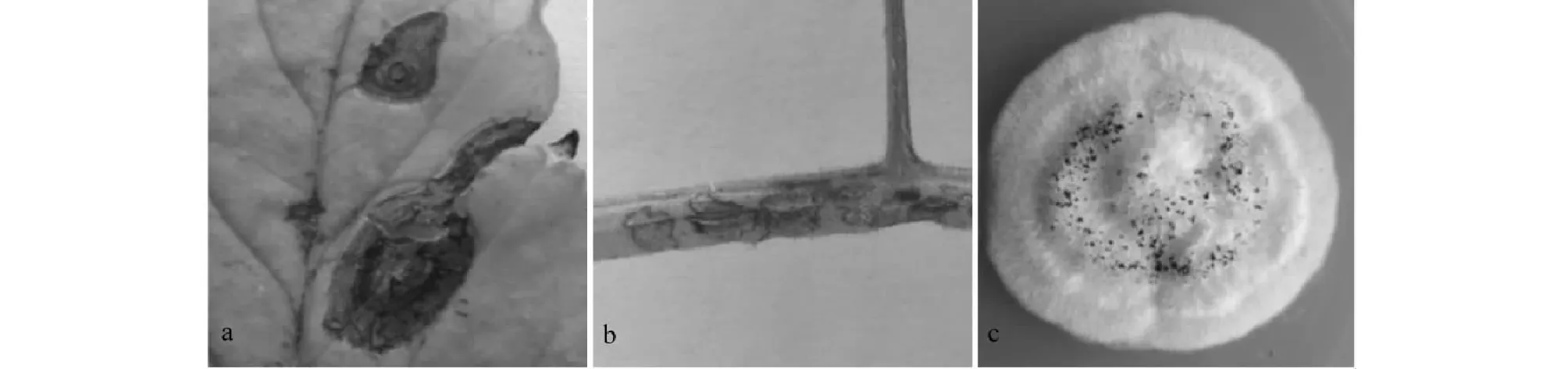
a:病原菌回接番茄叶片症状;b:病原菌回接番茄茎症状;c:病原菌回接番茄叶片后分离的病原菌a: Symptom developed on tomato leaf by artificial inoculation; b: Symptom developed on tomato stem by artificial inoculation; c: Pathogen mycelium colony isolated from inoculated tomato leaves图2 病原菌回接番茄后症状及分离的病原菌Fig.2 Symptom on tomato leaves by artificial inoculation and pathogen isolated from inoculated tomato leaves
2.2 病原菌致病性测定
将分离得到的病原菌孢子悬浮液喷施于健康植株番茄叶片及茎上,6 d后叶片的病斑症状与田间发病症状(图1-a)相似,且番茄茎上也出现凹陷病斑(图2-b);从接种发病的植株叶片及茎上分离的病原菌与前期接种菌株培养性状相同(图2-c),根据柯赫氏法则,接种的病原菌即为从田间番茄叶片上分离纯化的病原菌。
2.3 分子生物学鉴定
使用真菌核糖体DNA的18S区域引物ITS1和ITS4扩增出了大小为600 bp左右的片段(图3),将扩增产物克隆测序后拼接,获得该病原菌的最终ITS序列。将该序列输入NCBI中进行nucleotide blast比对分析,结果显示,该序列与NCBI库中的露湿漆斑菌(GenBank登录号为AB823653.1和EU927366.1)同源性达到99 %,综合形态学特征确定该致病菌为露湿漆斑菌M.roridum。
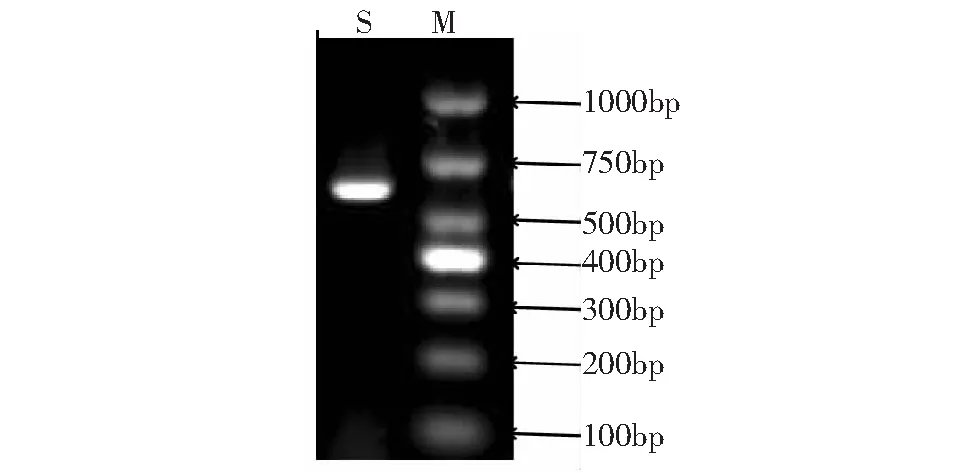
M:DL2000 DNA标准分子量;S:分离的病原菌 M: DL2000 DNA marker; S: Isolated fungi图3 分离的病原菌PCR产物电泳图谱Fig.3 Electrophoretogram of PCR products of isolated fungi on tomato leaf
2.4 室内药剂筛选
氟吡菌酰胺、嘧菌酯、吡唑醚菌酯和多菌灵对番茄漆斑菌菌丝的抑菌作用很强,其EC50分别为0.094、0.781、1.041和1.396 μg/mL;醚菌酯、咪鲜胺水乳剂对番茄漆斑菌菌丝的抑菌作用较强,其EC50分别为4.936和8.479 μg/mL;戊唑醇和苯醚甲环唑对菌丝的抑制作用略差,其EC50分别为16.018和21.584 μg/mL;百菌清对病原菌的抑菌活性最差,其EC50大于100,基本无活性(表1)。
室内药剂筛选试验表明,在氟吡菌酰胺、嘧菌酯、吡唑醚菌酯和多菌灵等4种抑菌活性较好的杀菌剂中,氟吡菌酰胺的EC50和EC90均最小,表明氟吡菌酰胺对番茄漆斑病菌菌丝的抑制能力最强;虽然多菌灵的EC50大于嘧菌酯及吡唑醚菌酯,但其EC90(2.057 μg/mL)远小于嘧菌酯SC(EC90>100)和吡唑醚菌酯(EC90为77.287),这说明多菌灵对番茄漆斑病菌菌丝生长的抑菌活性大于嘧菌酯和吡唑醚菌酯。
3 结论与讨论
目前,随着环境变化,植物上出现了一些新病害。由露湿漆斑菌引起的番茄漆斑病(也称漆腐病)最早是由Stevenson & McCollochL于1947年在美国德克萨斯州的番茄果实上首次发现[12],随后有报道称,该菌可引起番茄果实腐烂[13-14]。而国内由露湿漆斑菌引起的植物病害的相关报道较少,堵鹤鸣等在1988年首次发现该菌可引起桑树漆斑病[15],2009年贲海燕等[16]对引起瑞典常春藤(Pelctranthusoertendahlii)漆斑病的病原鉴定,确定病原为露湿漆斑菌。李宝聚和赵彦杰[17]在山东青州、北京大兴以及辽宁海城等温室茄子种植区,发现有茄子漆斑病发生,并将其病原鉴定为露湿漆斑菌。近两年来陆续有报导该菌可引起山药漆腐叶斑病[18]
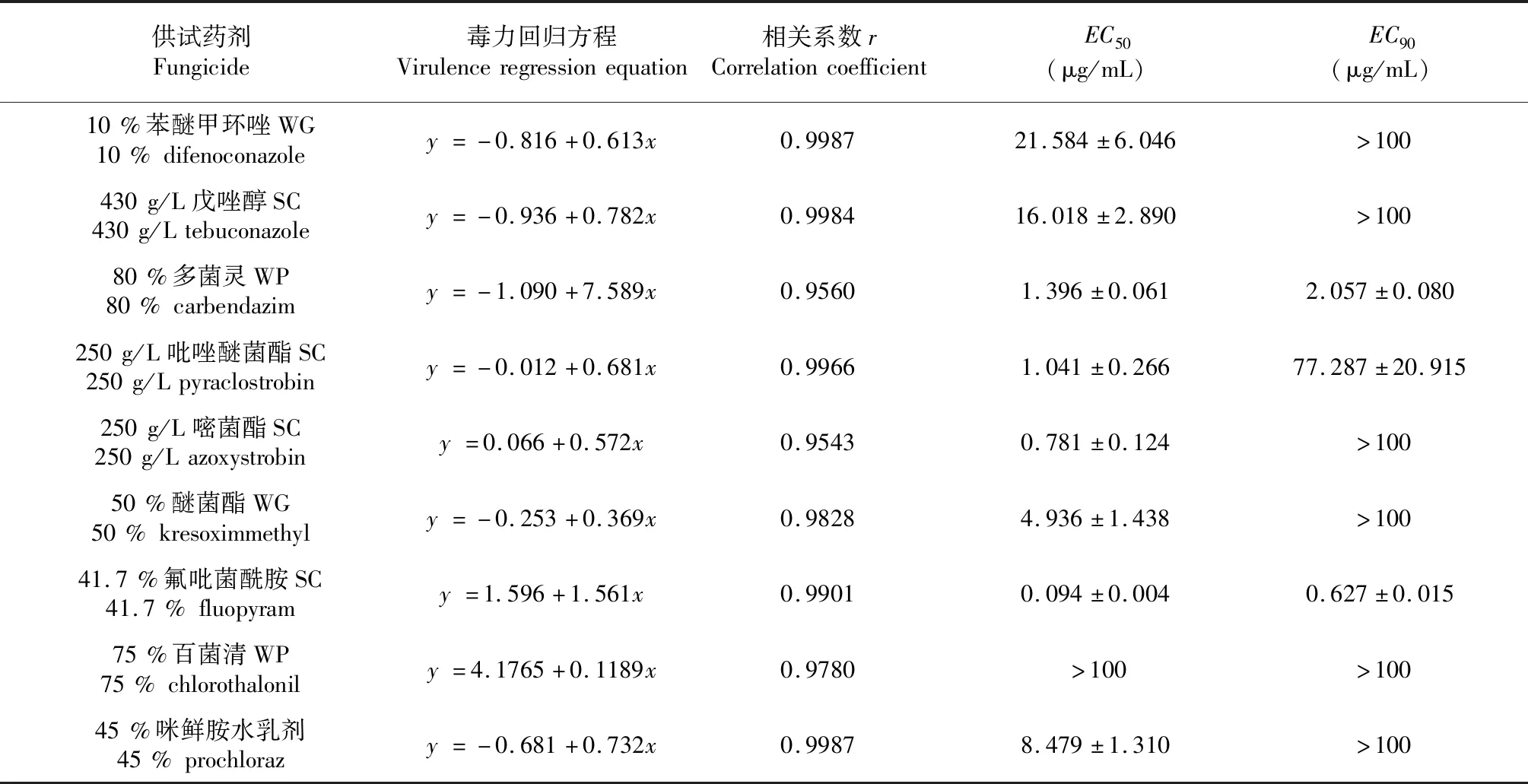
表1 9种杀菌剂对番茄漆斑病菌的室内毒力测定Table 1 Determination of the virulence of nine fungicides to Myrothecium roridum in vitro
注:表中数据为平均数±标准差/标准误。
Note : Data in the table are mean±SD/SE.
和铁皮石斛漆斑病[19]。而在我国由露湿漆斑菌引起的番茄漆斑病自赵彦杰等[8]在2009年报道以后,还未有其它报道,本试验中番茄漆斑病的症状及病原菌形态学特征与赵彦杰等[8]所做试验结果相一致。
吡唑醚菌酯、嘧菌酯和醚菌酯属于甲氧基丙烯酸酯类杀菌剂[20],通过阻止细胞色素bc1复合物中的电子传递而阻止ATP的合成,抑制真菌细胞中能量产生,干扰呼吸从而达到抑制真菌孢子萌发或菌丝生长[21-22]。本试验中吡唑醚菌酯和嘧菌酯的EC50较小,对番茄漆斑病菌菌丝的抑制率好于醚菌酯,可以作为番茄漆斑病防治药剂,至于番茄漆斑病菌菌丝为何对醚菌酯不敏感,还有待于进一步研究;多菌灵是苯并咪唑类杀菌剂,从20世纪60 年代开始广泛用于防治植物病害,该类药物的作用机制主要是与病原菌的微管蛋白结合,从而阻碍病菌的有丝分裂[23],虽然多菌灵用药历史悠久,长期使用病原菌易产生抗药性[24-25],但其具有高效低毒的优点,对于防治新病害或病害防治初期可以尝试使用;氟吡菌酰胺是一种新型吡啶基乙基苯甲酰胺类杀菌剂,通过阻碍呼吸链中琥珀酸脱氢酶的电子转移而抑制线粒体呼吸[26],氟吡菌酰胺可用于防治70多种作物上的病害,Fought et al.[27]和Klages et al.[28]证实氟吡菌酰胺对核盘菌(Sclerotiniasclerotiorum)、灰霉病菌(Botrytiscinerea)、丛梗孢属病菌(Monilia)和白粉病菌(Erysiphe)所引起的病害防效优异,而在我国陈彦等[29]证实氟吡菌酰胺对黄瓜、草莓白粉病防效达90 %以上,对甜瓜白粉病的防效达95 % 以上,而本试验中氟吡菌酰胺对番茄漆斑病菌的EC50为0.094 μg/mL,而其EC90仅为0.627 μg/mL,说明氟吡菌酰胺对番茄漆斑病菌的抑菌活性很高。因此,氟吡菌酰胺可以作为番茄漆斑病的有效防治药剂。
杀菌剂室内毒力测定应该使用原药进行试验,因实验室中缺乏部分原药,为了保证试验的一致性,本试验中的药品采用制剂代替,虽然并不能完全反映出药剂对露湿漆斑菌菌丝的抑制作用,但也能反映出药剂本身对露湿漆斑菌菌丝的抑制趋势。由于本试验番茄漆斑病菌药剂筛选试验是在室内进行,因此在应用到田间生产之前,需进一步开展田间药效试验来验证药剂对病害的防治效果,还要考虑药剂对植物和环境的影响、成本及抗药性等诸多因素,力求合理高效地使用杀菌剂。

