铬污染区地下水对大鼠肝脏功能及Caspase-3和PARP表达的影响*
赵秀娟,包翠芬,王琳,柳晓琳
(锦州医科大学 1.公共卫生学院,2.基础医学实验教学中心,辽宁 锦州 121001)
铬是一种常见的工业毒物和环境污染物,水中铬主要以三价铬和六价铬为主[1]。研究表明,六价铬的毒性比三价铬毒性大100 倍[2]。铬通过多种途径进入身体,在体内蓄积后可以引发多种疾病,如溃疡、黏膜炎等。肝脏是铬的主要代谢器官之一[3]。为探讨铬污染区地下水对人群健康的影响,本研究分别用铬污染区地下水及不同浓度重铬酸钾灌胃小鼠,观察其对大鼠肝功能及肝细胞Caspase-3 和聚腺苷二磷酸-核糖聚合酶(poly-ADP-ribose polymerase,PARP)表达的影响,探讨铬可能导致人体肝脏疾病及其损伤的机制。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物选取健康情况相近、SPF 级、同一批次的SD 孕鼠10 只,购自锦州医科大学动物实验中心(合格证号:SCXK 辽2014-0004)。于室温(22±1)℃下喂养,相对湿度为50%~70%,室内昼夜分明,实验期间小鼠可自由活动、摄食及饮水。
1.1.2 实验试剂重铬酸钾K2Cr2O7(分析纯,含量≥ 99.8%,天津市华东试剂厂),铬污染区地下水(锦州市金厂堡村张卫东家深度18 ~20 m、铬浓度为28.64 mg/L 地下水,由环境保护部华南环境科学研究所检测),铬标准品(北京有色金属研究总院),苏木精-伊红(HE)染色液(上海多烯公司),PARP 抗体、Cleaved Caspase-3(Asp 175)(Cell Signaling Technology 公司)。
1.2 仪器与设备
7600-110 型全自动生化分析仪(日本Hitxchi 公司),AAnalyst 800 原子吸收分光光度计(美国Perkin Elmer 公司),ST-60 型全自动消解仪(北京普立泰科仪器有限公司),DK-8A 型电热恒温水槽(上海精宏实验设备有限公司),DHG-9240A 型电热恒温鼓风干燥箱(上海一恒科学仪器有限公司),BX41 型荧光显微镜(日本Olympus 公司),TGL20M 型高速冷冻离心机(湖南凯达科学仪器有限公司)。
1.3 研究方法
1.3.1 慢性染毒试验将10 只SD 孕鼠随机分成空白组、地下水组、低铬组、中铬组及高铬组,每组2 只。分别灌胃蒸馏水、铬含量为28.64 mg/L 的铬污染区地下水,以及剂量为0.8、4.0 和20.0 mg/kg 的重铬酸钾溶液。母鼠共产仔76 只(5 组小鼠只数分别为15、17、14、17 和13 只),第21 天小鼠断奶,直接灌胃,灌胃剂量不变(0.5 ml/100 g),1 次/d,灌胃期间小鼠自由进食饮水,连续灌胃21 周。最后1 次灌胃后,禁食24 h 但不禁水。处死全部子代大鼠,采集肝脏组织及血液备用。
1.3.2 肝脏铬含量的检测将肝组织从-80℃冰箱中取出,用微量天平精确称量肝脏(0.40±0.03)g 于消解管中。在电脑软件中设置消解管位置,再依次将消解管对应放入消解仪中,按照设定条件进行全自动消解,同时做试剂空白,最后用去离子水定容至50 ml。将原子吸收仪设定为石墨炉法,调定肝脏铬含量的检测方法后,先绘制铬标准溶液的标准曲线,再将所有样品按照检测方法中设定的位置依次对应放入石墨炉中,检测肝脏铬的含量。
1.3.3 肝功能检测染毒结束后,称量每只子代大鼠体重,2%戊巴比妥钠(0.1 ml/100 g)腹腔注射。待其充分麻醉后,抽取腹主动脉血,分装在含有抗凝剂及非抗凝剂的采血管中。采血后,将含有抗凝剂的血样置于-80℃冰箱中保存备用。将非抗凝剂采血管中的血样静置30 min 后放入离心机中,3 500 r/min,4℃离心10 min 后取出血清。用全自动生化分析仪检测血清总蛋白(total protein,TP)、白蛋白(Albumin,ALB)、球蛋白(Globulin,GLB)、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)的含量。
1.3.4 肝脏HE 染色解剖所有子代大鼠,取其肝脏组织,将一部分肝脏立即放入-80℃冰箱冷冻保存,另一部分放入配置好的10%甲醛溶液中固定。取出固定后的部分肝脏,经自来水冲洗(2 h)、梯度浓度乙醇(由低到高)脱水、二甲苯透明、浸蜡(3 次,每次40 min)、石蜡包埋等步骤后,制作肝脏切片(厚度5 mm)。将制作好的肝脏切片经二甲苯、梯度浓度乙醇(由高到低)脱蜡复水后HE 染色,中性树胶封片并在光学显微镜下观察。
1.3.5 免疫组织化学法检测肝脏Caspase-3 及PARP的表达制作肝脏石蜡切片,经二甲苯透明,梯度浓度乙醇(由高到低)脱蜡复水后,再经3% H2O2温室孵育15 min,应用高压抗原修复法,滴加5 % BSA 封闭血清温室孵育30 min,滴加一抗后放入4℃温室孵育20 h。次日滴加二抗,37℃孵育30 min 后滴加DAB显色,待镜下观察反应充分后放入双蒸水中终止反应。最后HE 复染,梯度浓度乙醇脱水,二甲苯透明,中性树胶封片观察Caspase-3 及PARP 的表达。
1.4 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,均进行正态性检验及方差齐性检验,两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 子代大鼠肝脏铬含量的比较
地下水和重铬酸钾染毒子代大鼠肝脏铬含量的变化显示,与空白组比较,地下水组与各剂量重铬酸钾染毒组肝脏中铬的含量均升高,且随着染毒剂量的升高,子代大鼠肝脏中铬含量呈上升趋势,差异有统计学意义(P<0.05)。地下水组肝脏铬含量与低铬组比较,差异无统计学意义(P>0.05)。见表1。
2.2 子代大鼠肝功能化验结果的比较
地下水和重铬酸钾染毒子代大鼠血清TP、ALB、GLB 含量和AST、ALT、ALP 活力的变化显示,与空白组比较,地下水组与各剂量重铬酸钾染毒组血清TP、ALB、GLB 的含量均升高,中铬组和高铬组各血清指标与空白组比较,差异有统计学意义(P<0.05)。地下水组与各剂量重铬酸钾染毒组血清AST、ALT、ALP 活力均高于空白组,各剂量重铬酸钾染毒组与空白组比较,差异有统计学意义(P<0.05)。见表2。
表1 子代大鼠肝脏铬含量的比较 (μg/L,±s)
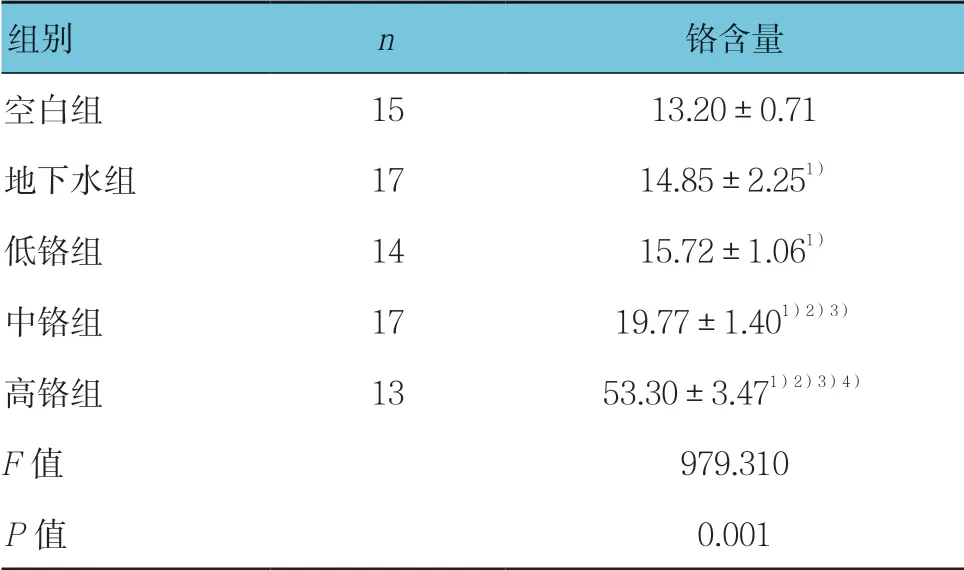
表1 子代大鼠肝脏铬含量的比较 (μg/L,±s)
注:1)与空白组比较,P<0.05;2)与地下水组比较,P<0.05;3)与低铬组比较,P<0.05;4)与中铬组比较,P<0.05
组别 n铬含量空白组 15 13.20±0.71地下水组 17 14.85±2.251)低铬组 14 15.72±1.061)中铬组 17 19.77±1.401)2)3)高铬组 13 53.30±3.471)2)3)4)F值 979.310P值 0.001
表2 子代大鼠肝功能化验结果的比较 (±s)
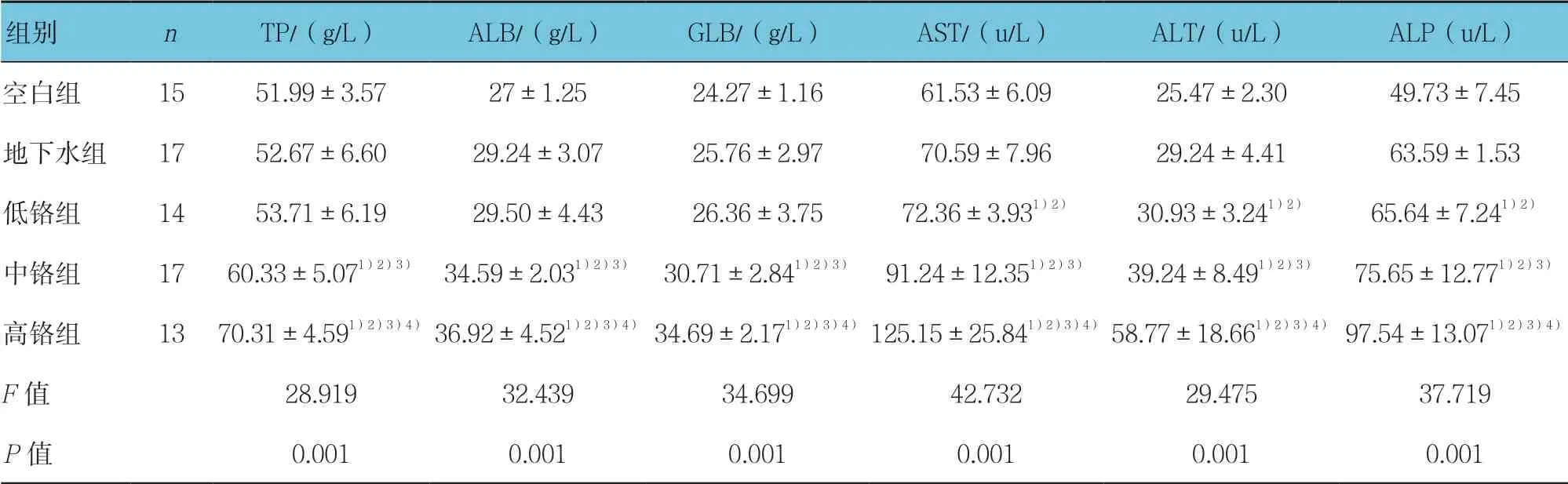
表2 子代大鼠肝功能化验结果的比较 (±s)
注:1)与空白组比较,P<0.05;2)与地下水组比较,P<0.05;3)与低铬组比较,P<0.05;4)与中铬组比较,P<0.05
组别 nTP/(g/L)ALB/(g/L)GLB/(g/L)AST/(u/L)ALT/(u/L)ALP(u/L)空白组 15 51.99±3.57 27±1.25 24.27±1.16 61.53±6.09 25.47±2.30 49.73±7.45地下水组 17 52.67±6.60 29.24±3.07 25.76±2.97 70.59±7.96 29.24±4.41 63.59±1.53低铬组 14 53.71±6.19 29.50±4.43 26.36±3.75 72.36±3.931)2) 30.93±3.241)2) 65.64±7.241)2)中铬组 17 60.33±5.071)2)3) 34.59±2.031)2)3) 30.71±2.841)2)3) 91.24±12.351)2)3) 39.24±8.491)2)3) 75.65±12.771)2)3)高铬组 13 70.31±4.591)2)3)4) 36.92±4.521)2)3)4) 34.69±2.171)2)3)4) 125.15±25.841)2)3)4) 58.77±18.661)2)3)4) 97.54±13.071)2)3)4)F值 28.919 32.439 34.699 42.732 29.475 37.719P值 0.001 0.001 0.001 0.001 0.001 0.001
2.3 子代大鼠肝脏HE 染色结果
荧光显微镜下观察可见空白组肝细胞排列整齐,呈条索状,细胞质圆润饱满。地下水组肝细胞出现嗜酸性样改变且排列不规则。随着重铬酸钾染毒浓度增加肝细胞表现为不同程度的嗜酸性样变,排列紊乱,细胞质间隙加大,甚至呈现空泡性样变。少数高铬组出现肝窦扩张,淤血及少量渗出性出血,偶见坏死灶。见图1。
2.4 肝脏组织Caspase-3 及PARP 表达
荧光显微镜下可观察空白组肝细胞排列规则,Caspase-3 及PARP 阳性细胞少见。地下水组可见肝细胞胞质充盈度增加,可见少许阳性细胞。随着重铬酸钾染毒浓度增加,肝细胞排列逐渐稀疏紊乱,阳性细胞逐渐增多。见图2、3。
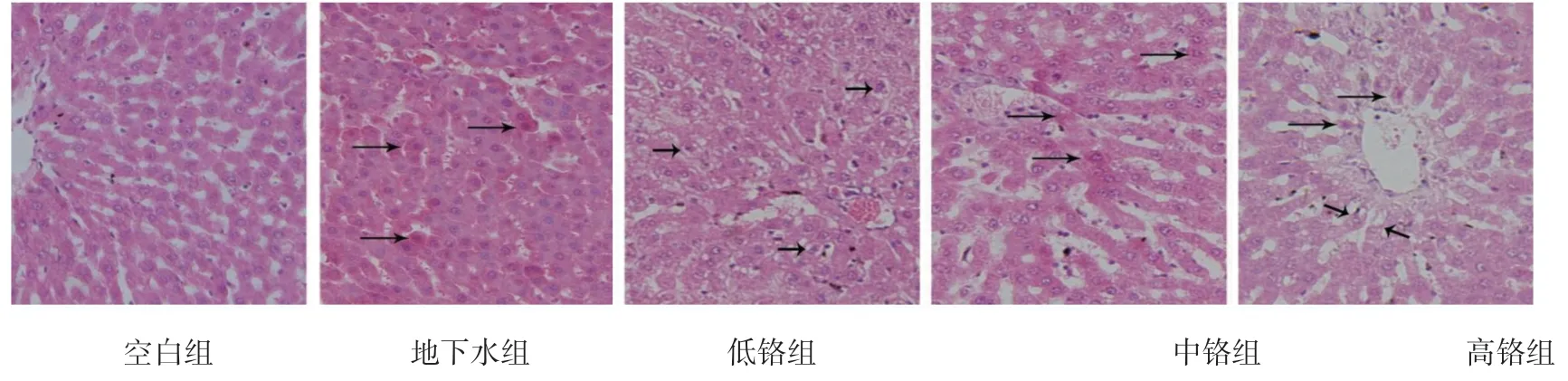
图1 子代大鼠肝脏组织病理改变 (HE×400)

图2 子代大鼠肝脏组织Caspase-3 表达 (免疫组织化学×400)
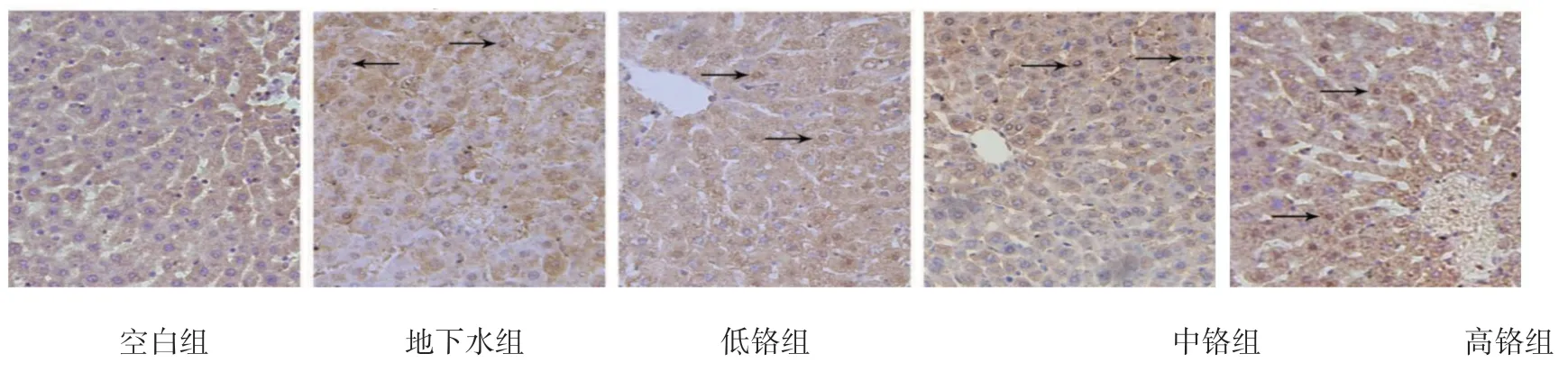
图3 子代大鼠肝脏组织PARP 表达 (免疫组织化学 ×400)
3 讨论
肝脏是铬的主要代谢器官之一,摄入过多的铬可以导致肝脏受损,甚至会致癌[4]。研究发现,长期居住在铬污染区的居民恶性肿瘤发病率明显高于其他地区[5]。血清学指标的检测对检查肝脏疾病具有十分重要的作用。TP 可分为ALB 和GLB 两类,在机体中具有维持血液正常胶体渗透压和pH 值、运输多种代谢物、免疫作用等多种功能。GLB 升高,可引起慢性炎症、感染及免疫系统等疾病。本实验结果显示,地下水组与铬染毒组TP、ALB、GLB 的含量均高于空白组;随着染毒剂量的升高,大鼠血清TP、ALB、GLB 的活力呈上升趋势。这说明六价铬能够造成血清蛋白含量发生变化,且铬剂量越高效果越明显。
反映肝细胞损伤的重要标志物包括ALT、AST[3]和ALP。ALT 主要存在于肝脏、心脏组织细胞中,AST 主要分布在心肌、肝脏、骨骼肌和肾脏等组织中。ALP是广泛分布于肝脏、骨骼、肠、肾等组织中,通常辅助ALT 鉴别肝胆疾病。正常情况下,血液中的ALT 和AST 含量较低,但当相应组织细胞受损时,细胞膜通透性增加,会使胞浆内的ALT 和AST 释放入血,从而导致血清浓度升高。刘学慧等[6]发现灌溉污水可对大鼠肝细胞造成损伤。本实验结果显示,与空白组比较,地下水组与铬染毒组AST、ALT 和ALP 的活性均增高;但地下水组与低铬组比较,差异无统计学意义;随着染毒剂量升高,大鼠血清AST、ALT 和ALP 活性呈上升趋势。该结果与陈佳等[7]研究结果相符,这说明六价铬染毒能够造成大鼠肝功能损伤,铬在肝脏内蓄积后可以干扰或破坏肝细胞生长,且铬剂量越高肝功能损伤越严重。
与空白组比较,地下水组与重铬酸钾染毒组肝脏中铬的含量均有增长,且随着铬浓度增加,除地下水组与低铬组外,各组间差异有统计学意义,这说明铬在肝脏内有蓄积作用。
HE 染色结果显示,随着重铬酸钾染毒浓度增加,肝细胞表现为不同程度的嗜酸性样变,肝索排列逐渐紊乱;部分肝细胞质间隙加大,核浓缩且偏移;部分肝细胞出现空泡性样变;少数出现脂肪性样变。陈佳等[7]发现用高剂量1/2 LD 50(85.5 mg/kg)重铬酸钾溶液灌胃小鼠35 d 后,肝细胞之间有炎症细胞浸润,部分肝细胞组织出现大片细胞液化坏死,甚至出现细胞核碎裂、溶解。本实验未发现该结果很可能是由于重铬酸钾染毒剂量差异导致。由此说明铬不仅可以在短期内对肝脏产生中毒效应,也可以产生蓄积作用,干扰肝细胞正常代谢,导致细胞器功能受损,且蓄积时间越长,铬剂量越高,肝功能损伤越明显。
Caspase-3 是细胞凋亡过程中最主要的终末剪切酶,PARP 酶是细胞凋亡核心成员半胱天冬酶(Caspase)的切割底物,PARP 失去酶活力会加速细胞的不稳定,它们在DNA 损伤修复与细胞凋亡中发挥重要作用。有学者在体外实验中证实Cr(Ⅵ)可诱导肝细胞凋亡[8]。本实验免疫组织化学结果显示,随着重铬酸钾染毒浓度增加,肝细胞排列逐渐稀疏紊乱,阳性细胞逐渐增多。由此说明铬在肝脏内蓄积后能够使Caspase-3 活性增强,PARP 失去活性,从而导致肝细胞凋亡。
综上所述,六价铬长期暴露对大鼠的肝功能造成一定损伤并且对血清生化指标产生影响。但是具体通过哪种通路发挥作用尚未可知,有待更深入研究。由于铬污染区地下水组与低铬组各项指标结果相仿,因此推断,长期饮用铬污染区地下水可能对肝脏造成一定损伤。众多调查显示,铬污染区居民慢性病及肿瘤发病率明显高于其他地区,建议当地政府采取有效措施,防止铬污染的发生。

