二氢杨梅素对糖尿病肾病大鼠肾纤维化的影响*
刘宗亮,张建东,彭 湾,吴素珍,肖 海
(赣南医学院 1.基础医学院;2.第一附属医院,江西 赣州 341000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病常见的微血管并发症,是导致终末期肾病的主要原因。随着发病率的增加,DN是糖尿病患者慢性肾功能衰竭和死亡的主要原因[1]。肾纤维化是糖尿病肾病的重要特征之一。多种因子参与糖尿病肾纤维化过程,如转化生长因子β1(Transforming Growth Factor β1,TGF-β1)、细胞因子、趋化因子、生长因子等,其中TGF-β1是最为重要的促进肾纤维化的细胞因子[2]。研究表明TGF-β1可通过激活Smads信号转导促进肾上皮向间质转换,从而导致肾纤维化,最终进展为肾功能不全[3]。迄今为止,除了通过控制血糖、血压可以减缓DN进展外,还没有较好的措施用于预防和治疗糖尿病的肾脏病变。因此,寻找有效防治DN的新方法具有重要的实际意义。
二氢杨梅素(dihydromyricelin,DMY)是藤茶中主要的活性成分之一。既往研究表明DMY具有抗炎、抗氧化、抗纤维化、抗肿瘤等多种生物活性[4]。此外,不同的糖尿病动物模型均证实了DMY具有降血糖作用,能有效改善糖耐量异常状态[5]。然而,DMY对高糖诱导的肾纤维化的作用机制尚不清楚[6]。本文通过建立DN大鼠模型,探讨DMY对高糖诱导的大鼠肾纤维化的影响,并从TGF-β1/Smads信号通路来阐明DMY治疗DN的分子机制。
1 材料与方法
1.1动物和试剂选取(200±20) g健康雄性SD大鼠40只,由赣南医学院动物中心提供。将动物置于25 ℃环境下饲养,保持正常通风,自由饮水,常规饲料摄食,适应性喂养1周。链脲佐菌素(streptozocin,STZ)、HE染色试剂盒、Masson染色试剂盒和PAS染色试剂盒均购于北京索莱宝公司,TGF-β1、Smad2和Smad7抗体均购于武汉博士德公司,二抗购于福州迈新公司,二氢杨梅素购于成都德思特公司。
1.2DN模型的制备和实验分组所有大鼠禁食不禁水12 h后,将链脲佐菌素(STZ)溶于0.1 M柠檬酸钠缓冲液(pH=4.5)中配制大剂量STZ,除正常对照组外均采用55 mg·kg-1STZ一次性腹腔注射并给以普通饲料喂养建立DN模型。造模72 h后大鼠尾静脉取血测空腹血糖,以血糖值>16.7 mmol·L-1视为建模成功。并将大鼠随机分为模型组和低、中、高剂量DMY组(125、250、500 mg·kg-1),另设正常组。DMY组采用灌胃给药,模型组以等体积的生理盐水灌胃,每天一次,持续12周。
1.3肾功能检测在第12周处死大鼠前,收集24 h尿液,测定大鼠24 h尿蛋白(24 h-Pro)。采用腹主动脉取血,待血清自然析出后,3 000×g,4 ℃离心10 min,弃去不溶物,收集血清,严格按照实验说明检测大鼠血尿素氮(bloodurea nitrogen, BUN)和血肌酐(serum creatinine,Scr)的含量。
1.4HE染色肾包埋组织4 μm厚切片,将切片常规脱蜡至水,苏木素染色5 min,流水稍冲洗;盐酸酒精分化3 s,流水冲洗1 min;氨水返蓝,流水冲洗1 min;伊红染色1 min,流水冲洗1 min;梯度酒精脱水,二甲苯透明,中性树胶封片。
1.5PAS染色切片常规脱蜡至水,高碘酸溶液氧化10 min,蒸馏水冲洗1 min;雪夫试剂染色20 min,流水冲洗1 min;苏木素染核5 min,流水冲洗1 min,常规脱水透明,中性树胶封片。
1.6Masson染色切片常规脱蜡至水,品红染色3 min,弱酸冲洗1 min;磷钼酸分化1 min,弱酸冲洗1 min;苯胺蓝染色2 min,弱酸冲洗1 min;常规脱水透明,中性树胶封片。
1.7Westernblot检测蛋白水平取肾脏组织冰上匀浆,充分裂解1 h,取上清用BCA方法进行蛋白定量,将蛋白加入上样缓冲液煮沸变性,经SDS-PAGE凝胶电泳,用PVDF膜进行蛋白电转移,5%脱脂牛奶封闭后,加入TGF-β1、Smad2、Smad7一抗4 ℃过夜,二抗室温孵育1 h。最后用Bio-Rad软件扫描蛋白条带及测定灰度值,并与对照组结果进行对比。
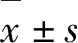
2 结 果
2.1DMY对DN大鼠肾功能的影响生化检测结果显示,与正常组相比,模型组24 h-Pro、BUN、Scr含量明显升高(P<0.01);DMY给药12周后,各剂量DMY组相较于模型组,24 h-Pro、BUN、Scr水平明显降低(P<0.01)。见表1。
2.2DMY对DN大鼠肾脏组织病理的影响HE染色显示模型组大鼠肾脏组织可见肾小球体积增大,血管扩张充血,部分肾小管轻度萎缩或管腔扩张,上皮细胞肿胀,部分上皮细胞脱落。各剂量DMY组大鼠肾组织病变较模型组病变减轻,以中、高剂量组明显。PAS染色结果显示DMY干预后,能减轻肾小球基底膜增厚。Masson染色显示模型组肾小球胶原纤维增生,各剂量DMY组治疗后胶原纤维不同程度减少。见图1。

表1 DMY对各组大鼠肾功能的影响
注:**P<0.01,与正常组比较;##P<0.01,与模型组比较。

①正常组;②模型组;③低剂量DMY组;④中剂量DMY组;⑤高剂量DMY组。
2.3DMY对DN大鼠肾组织中TGF-β1、Smad2和Smad7表达的影响Western blot检测结果显示,与正常对照组比较,模型组大鼠肾组织TGF-β1、Smad2蛋白表达水平增加,Smad7蛋白表达水平下降(P<0.05)。与模型组比较,低、高剂量DMY组TGF-β1、Smad2蛋白出现不同程度的降低,而Smad7蛋白表达水平增加(P<0.05)。见图2。
3 讨 论
糖尿病肾病是糖尿病最严重的并发症之一,在其发生发展过程中以肾小球肥大、基底膜增厚、细胞外基质积聚和足细胞丢失为主要病理特点,最终导致肾间质纤维化和肾小球硬化。TGF-β1及其调控因子在DN肾间质纤维化进程中起着关键作用,但在DN期间能有效减轻肾纤维化的方法有待进一步研究。
DMY是一种二氢黄酮醇类黄酮化合物,其具有抗肿瘤、抗氧化应激、抗皮肤老化等作用。近年来发现DMY药效学作用多样,在降血糖、抑制纤维化以及保护神经和心脑血管疾病具有重要药用价值[7-10]。许妍妍[11]发现DMY对四氯化碳致肝纤维化大鼠具有显著的保护作用,可能与抑制细胞外基质生成有关。李加林等[12]发现DMY可抑制高糖诱导的肾小球系膜细胞增殖,并降低细胞外基质蛋白的表达。陈红等[13]采用60 mg·kg-1STZ腹腔注射大鼠并正常喂养8周后建立DN模型,发现DMY能减轻糖尿病大鼠肾脏纤维化。然而,DMY对DN的作用机制尚未完全阐述清楚。本研究采用55 mg·kg-1STZ一次性腹腔注射大鼠并给以普通饲料喂养12周后建立DN模型。HE和PAS染色显示模型组大鼠肾小球肥大、部分肾小管萎缩和基底膜增厚;Masson染色显示模型组大鼠肾脏组织胶原蛋白广泛沉积,这表明本文成功建立了DN大鼠模型。DMY干预后能明显减轻上述病理病变。此外,本研究发现DMY能有效降低24 h-Pro、BUN、Scr水平。这些结果表明,DMY对糖尿病肾损伤具有明显的保护作用。

A:各组TGF-β1、Smad2及Smad7蛋白水平; B:各组TGF-β1、Smad2及Smad7蛋白灰密度值,n=4。
肾纤维化是DN的主要病理特征之一,其病理过程表现为肾小球系膜扩张,细胞外基质的广泛沉积[14]。许多细胞因子参与肾纤维化病理过程,TGF-β1是最为重要的促进肾纤维化的细胞因子[15]。TGF-β1参与多种生物学过程,包括细胞增殖、分化、凋亡、自噬和细胞外基质的产生[16]。研究发现TGF-β1不仅可以促进细胞外基质的合成,还可以激活Smad2蛋白诱导肾上皮向间质转换,从而导致肾间质纤维化[17-19]。另外,TGF-β1中和抗体可减轻糖尿病肾间质纤维化,并降低细胞外基质的表达[20]。这些研究提示TGF-β1通路在糖尿病肾纤维化进程中发挥重要的作用。本研究发现DMY可降低糖尿病大鼠肾脏组织TGF-β1、Smad2蛋白水平,增加Smad7蛋白表达水平,提示DMY可通过TGF-β1/Smads通路抑制细胞外基质表达,减轻大鼠肾脏组织纤维化。
综上所述,DMY对STZ所诱发的DN大鼠的肾损伤具有明显的保护作用,其机制可能与抑制TGF-β1/Smads通路的过度激活,从而减轻肾脏组织胶原蛋白的沉积,减轻大鼠肾脏组织纤维化有关。本研究通过建立DN大鼠模型明确了DMY具有抑制肾纤维化的作用,为预防和治疗DN提供新的思路。

