清炒方式对西兰花异硫氰酸酯含量及活性的影响
朱叶,申雨珂,JOTHAME Mupunga,吴元锋,,毛建卫
(1.浙江科技学院生物与化学工程学院,浙江 杭州 310023;2.浙江省农业生物资源生化制造协同创新中心(2011协同创新中心),浙江 杭州 310023)
西兰花又名花椰菜、青花菜,含有硫代葡萄糖苷(glucosinolate,GSL)和内源性黑芥子酶等成分。在收割、切碎、咀嚼等过程中,GSL 可被黑芥子酶水解生成异硫氰酸酯(isothiocyanates,ITCs),其主要的水解产物有萝卜硫素(sulforaphane,SF)、芥酸(1-isothiocyanato-4-methylsulfanylbutane,ERN)、1-丁烯基-4-异硫氰酸酯(1-butene-4-isothiocyanate,BITC)等[1-2]。SF 能有效抑制前列腺癌、肝癌、直肠癌等癌细胞的生长和增殖[3-5],此外SF 还具有预防Ⅱ型糖尿病、神经障碍、非酒精性脂肪肝等作用[6-8]。SF 具有上述功能主要是这种活性物能抑制I 型酶,刺激人体或动物细胞产生对机体有益的细胞醌氧化还原酶(quinone oxidoreductase,NQO1)等Ⅱ型酶,诱导转录因子NF-E2 相关因子(nuclear factor erythroid2-related factor 2,Nrf2),抑制转录因子(nuclear factor-κB,NF-κB)活性等功能[9-10]。其他的异硫氰酸酯,如ERN、苯乙基异硫氰酸酯(phenethyl isothiocyanate,PITC)、烯丙基异硫氰酸酯(allyl isothiocyanate,AITC)等也具有类似的活性[11-12]。
虽然SF 等物质具有上述活性,但是在烹饪后的蔬菜中含量较低,主要是由于黑芥子酶易失活。研究表明,不管用何种烹饪方法,都会降低黑芥子酶的活性[13-14]。作者研究表明,西兰花在微波加热4.8 min 后黑芥子酶即完全失去活性[15]。清炒是我国最常用的西兰花烹饪方法,经过清炒,西兰花的黑芥子酶也会失去活性,从而降低西兰花的ITCs 含量与营养学功效。本论文的主要目的是研究清炒方式对西兰花中SF 等ITCs 含量的影响,以期提高蔬菜中ITCs 的含量,以及研究不同清炒方式对西兰花提取物抑制小鼠黑色素瘤B16 细胞增殖、诱导B16 细胞NQO1 活性等方面的影响。
1 材料与方法
1.1 材料与试剂
西兰花:当地农贸市场;纯SF(纯度>98%)、烟酰胺腺嘌呤二核苷磷酸(nicotinamide adenine dinucleotide phosphate,NADP+)(纯度>98%)、葡萄糖-6-磷酸脱氢酶(纯度>98%)、甲萘醌(纯度>98%)、双香豆素(纯度>98%)、葡萄糖-6-磷酸(纯度>98%)、黄素腺嘌呤(flavin adenine,FAD)(纯度>98%)(以上试剂均为分析纯):美国sigma 公司;牛血清白蛋白、噻唑蓝、1,4-苯二硫醇(纯度>95%)、1640 培养基、胎牛血清、蛋白质定量检测试剂盒:上海生工生物工程公司;B16细胞:上海中乔新舟生物科技有限公司。
1.2 仪器与设备
SpectraMax M3 酶标仪:美国分子仪器公司;RE-200型旋转蒸发仪:上海亚荣生化仪器厂;EXF24086V超低温冰箱、PICO 高速离心机、BB150 CO2培养箱:美国 Thermo Fisher Scientific;A6-6BC 手持式高速匀浆机:上海殴和机械设备有限公司;G1701EA 气相色谱质谱联用仪:美国安捷伦科技有限公司;e2695 HPLC高效液相色谱仪:美国沃特世科技有限公司。
1.3 方法
1.3.1 西兰花异硫氰酸酯等成分的酶解和提取
根据清炒条件,分为3 组:新鲜西兰花(RB)、直接炒西兰花(DS)以及先酶解后炒西兰花(HS)。RB 组:100 g 新鲜西兰花花蕾切碎,加入170 mL 的磷酸缓冲液和330 mL 的二氯甲烷,搅拌浸提2 h,真空抽滤,滤液分层后收集有机相,残渣和水相再用二氯甲烷抽提2 次,合并有机相,加入无水硫酸钠去除有机相的水分,旋转蒸干,25 mL 甲醇定容,保存备用。DS 组:电磁炉功率为1 200 W,预热1 min,100 g 西兰花花蕾切碎,立即倒入并充分翻炒4 min,立即置于冰水浴冷却,后续的提取步骤与RB 组相同;HS 组:100 g 西兰花切碎,放于37 ℃保温1 h,后续的清炒、提取步骤与DS 组相同。每组试验均重复3 次。将所得样品放于4 ℃冰箱保存待测。
1.3.2 总异硫氰酸酯含量测定
ITCs 总量按照文献[16]环缩合法分析,并稍作改进。样品与20 mmol/L 磷酸钾缓冲液(pH8.5)、10 mmol/L 1,4-苯二硫醇混匀,65 ℃保温2 h。反应结束后冷却到室温 25 ℃,再经 12 000 r/min 10 min,上清液经 0.22 μm微滤膜过滤。液相分析条件:流动性为80%甲醇、20%水,流速1.0 mL/min,进样量10 μL,检测波长 365 nm。色谱柱为 4.6×250 mm i.d.,5 μm WondaCract ODS-2柱。以 1.25 μmol/L~10 μmol/L 浓度的萝卜硫素标准品绘制标准曲线。
1.3.3 气质联用分析异硫氰酸酯
西兰花水解产物的成分和含量通过气相色谱-质谱联用仪(gas chromatography-mass spectrometer,GCMS)7890A GC 气质联用仪分析[17]。色谱柱为Hp-5MS的 UI 毛细管柱(0.25 μm,30 m×0.25 i.d.),进样量为1 μL,气化室温度为300 ℃。柱程序升温:50 ℃维持2 min,以 10 ℃/min 升至 190 ℃,再以 20 ℃/min 升至300 ℃,维持5 min。载气为超高纯氦,分流比为10 ∶1。质谱条件:接口温度220 ℃,电离方式为EI,电离能量为70 eV,质量范围为35 到500 amu。以环己酮为内标物。
1.3.4 噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)法分别检测SF 和西兰花提取物对小鼠B16 细胞的抑制作用
SF 及西兰花提取物对小鼠B16 细胞的抑制作用采用噻唑蓝MTT 法检测[18]。取对数生长期的B16 细胞,用含乙二胺四乙酸的胰蛋白酶溶液进行消化,制备成单细胞悬液,接种于 96 孔板中,每孔 100 μL,1×104个细胞/孔,置于37 ℃、5%CO2的培养箱中培养。待细胞贴壁,加入含有不同SF 浓度的培养液,使SF 最终浓度分别为 2.5、5、10、20、30 和 40 μmol/L,每个浓度设置5 个复孔;各组西兰花提取物稀释相同的倍数,使RB 组中ITCs 总浓度为20 μmol/L。另设两组对照组,空白对照组仅含有培养液,正常对照组含有不同SF 浓度的小鼠B16 细胞,多余的孔内加入无菌磷酸盐缓冲液(phosphate buffer saline,PBS)。将加入药物的细胞放置37 ℃、5%CO2的培养箱中继续培养。24 h 后,在每个试验孔中加入20 μL 浓度为5 mg/mL 的无菌MTT 溶液,继续孵育4 h,将试验孔中的培养液吸去,每孔加入150 μL 的二甲基亚砜溶解孔中的甲瓒。将96 孔板置于摇床避光振荡混匀10 min,检测570 nm处各孔的OD 值,计算不同浓度的SF 作用B16 细胞24 h 后的抑制率。每个试验均重复3 次。
1.3.5 SF 或西兰花提取物对B16 细胞中NQO1 活性的影响
取生长状态良好的小鼠B16 细胞接种于6 孔板,每孔 2 mL,5×105个/孔。待细胞贴壁后,加入 SF 和稀释倍数相同的西兰花提取物,使RB 组西兰花提取物中 ITCs 的含量为 20 μmol/L。6 孔板放入 CO2培养箱中培养24 h 后,去除每孔中旧的培养液,用无菌PBS洗3 次,加入含乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)的胰蛋白酶消化液消化。细胞悬液1 000 r/min 离心5 min,沉淀加入细胞裂解液、二硫苏糖醇、蛋白酶抑制剂体积比为200 ∶1 ∶2,用手持高速匀浆机高速剪切2 min,冰敷10 min,重复3 次,再于10 000 r/min 下离心 30 min,取上清液,分装于-80 ℃保存备用。
NQO1 的活性按照文献方法[19]测定。配制混合液(25 mmol/L Tris-HCl 缓冲液,0.67 mg/mL 牛血清白蛋白,0.01% 吐温-20,0.02 mmol/LNADP+,1 mmol/L 葡萄糖-6-磷酸,5 μmol/L 腺嘌呤黄素,2U 葡萄糖-6-磷酸脱氢酶,0.72 mmol/L MTT 和 50 μmol/L 甲萘醌),混合液与样品溶液按照体积比4 ∶1 混合。混合后在610 nm下每隔1 min 测定吸光度,连续测定5 min,最后加入25 μL 0.3 mmol/L 双香豆素终止反应,每隔1 min测定吸光度,连续测定5 次,以斜率计算MTT 的还原量。样品的蛋白含量通过蛋白质定量检测试剂盒测定,以牛血清白蛋白(albumin from bovine serum,BSA)为标准蛋白。NQO1 酶活性以(nmol 还原MTT/min/mg蛋白)表示。
1.4 统计学分析
2 结果与分析
2.1 不同清炒方式对西兰花中各ITCs含量的影响
通过气质联用分析不同清炒方式对西兰花中各ITCs 含量的影响结果见图1。
结果表明提取物中主要含有SF、ERN、BITC,其中SF 的含量最高,其次是BITC,ERN 的含量最低。RB组和 HS 组中总 ITCs、SF、ERN、BITC 含量明显高于DS 组,RB 组中 ITCs 含量为(36.22±12.01)mg/100 mg,其中 SF、ERN、BITC 的含量分别为 (14.96±4.21)、(0.60±0.01)、(9.16±3.15)mg/100 mg;DS 组中 ITCs 含量为(10.64±2.41)mg/100 mg,SF、ERN、BITC 的含量分别为 (4.2±0.7)、0、(2.45±0.33)mg/100 mg;HS 组中ITCs 含量为(30.90±10.88)mg/100 mg,而 SF、ERN、BITC 的含量分别为(12.99±4.25)、(0.76±0.20)、(6.71±2.01)mg/100 mg。RB 组是新鲜西兰花,其水解液中SF、BITC 含量最高;HS 组水解液中总 ITCs、SF、ERN含量也明显高于DS 组,且RB 组和HS 组不存在显著性差异(P > 0.05),HS 组和 DS 组间存在显著性差异(P <0.05),表明酶解后再清炒西兰花的ITCs 含量与新鲜西兰花相当。
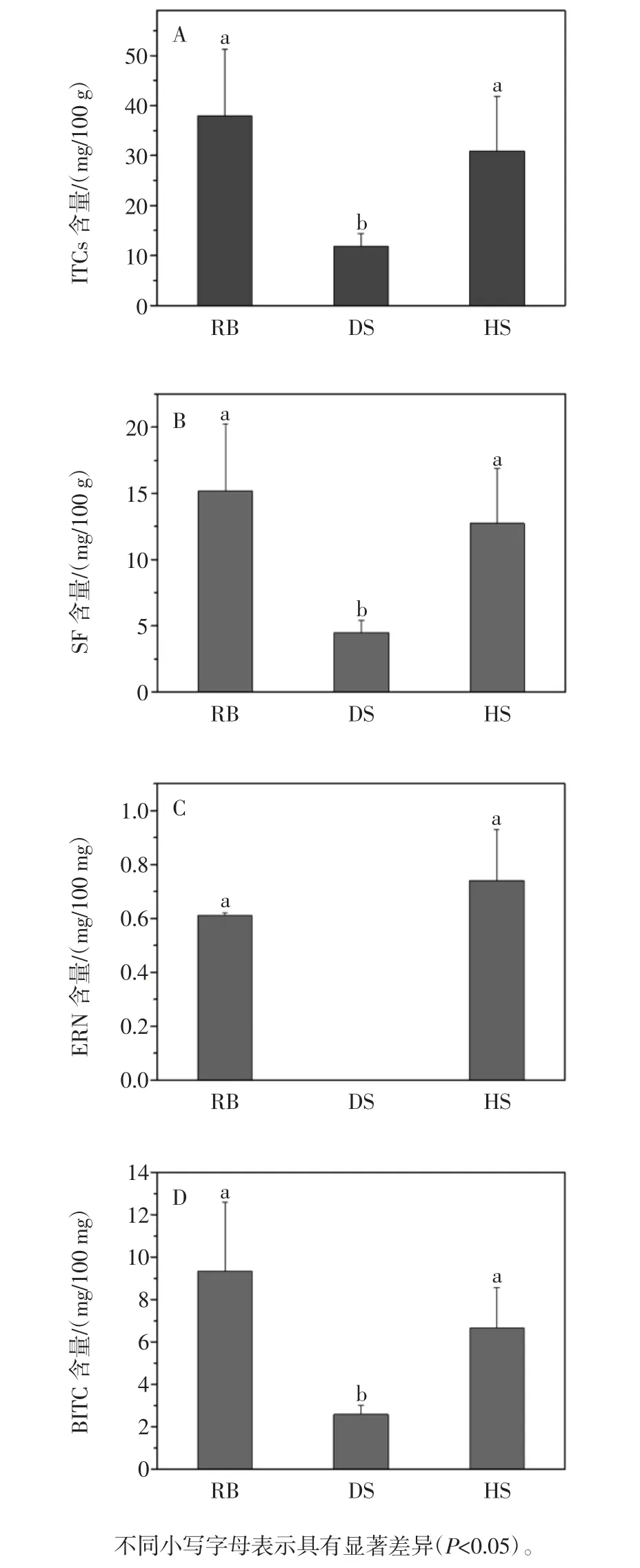
图1 新鲜西兰花(RB)、直接炒西兰花(DS)和先酶解后炒西兰花(HS)中总 ITCs(A)、SF(B)、ERN(C)和 BITC(D)组分的含量Fig.1 The contents of total ITCs(A),SF(B),ERN(C)and BITC(D)in raw broccoli(RB),direct stir-fried broccoli(DS),hydrolyzed and stir-fried broccoli(HS).
2.2 纯SF对B16细胞增殖的影响
以 MTT 法检测浓度为 2.5、5、10、20、30、40 μmol/L的纯SF 对B16 细胞抑制作用,结果见图2。
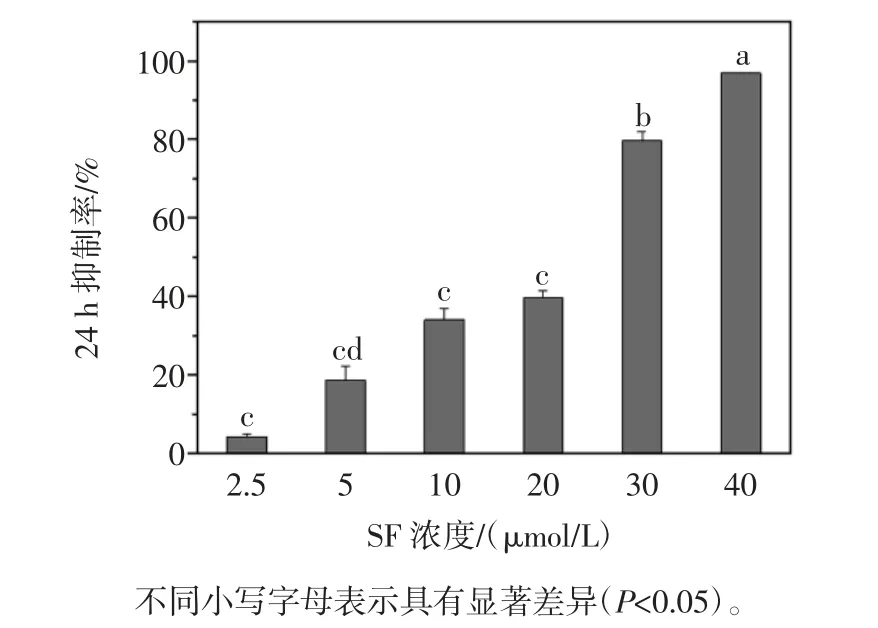
图2 SF 对B16 细胞生长的抑制率Fig.2 Proliferative inhibition of SF on B16 cells
由图2可知,B16 细胞的抑制率随着SF 浓度的增加而逐渐增大。20、30 μmol/L 和 40 μmol/L 浓度的 SF对 B16 细胞的抑制率分别为(39.72±1.66)%、(79.67±1.66)%和(96.92± 2.38)%,抑制效果较为显著,5、10、20 μmol/L 的 SF 对 B16 细胞的 24h 抑制率无显著性差异(P>0.05)。
2.3 西兰花提取物对B16细胞增殖的影响
由 2.2 可知,20 μmol/L 的 SF 对 B16 细胞有一定的抑制作用,因此将RB 组、HS 组和DS 组西兰花提取物稀释相同的倍数,使RB 组ITCs 的浓度为20 μmol/L,此时,HS 组 ITCs 的浓度为 17 μmol/L,DS组为6.57 μmol/L。将稀释好的各组西兰花提取物作用B16 细胞 24 h,并与 20 μmol/L 的纯 SF 结果做比较。结果见图3。
由图3可知,各组提取物对B16 细胞的生长都有一定的抑制作用,各组间不存在显著性差异(P >0.05),但是与纯SF 作用组相比均有显著差异(P <0.05)。
2.4 西兰花对B16细胞NQO1活性的影响
采用 20.00 μmol/L 的 SF 作用细胞,RB、DS 和 HS组也稀释相同倍数,使RB 组西兰花提取物中总ITCs浓度为 20.00 μmol/L,此时 HS 组 ITCs 的浓度为17.00 μmol/L,DS 组为 6.57 μmol/L,并与空白对照做比较(不添加西兰花提取液),结果见图4。

图3 西兰花提取物对B16 细胞生长的抑制Fig.3 Proliferative inhibition of broccoli extracts on B16 cells
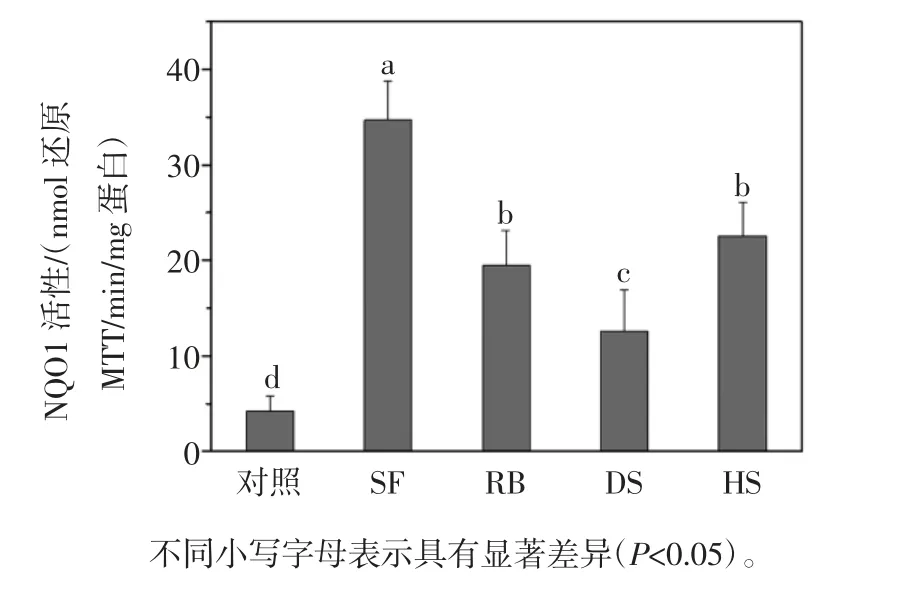
图4 西兰花对B16 细胞NQO1 活性的影响Fig.4 Effects of broccoli extracts and SF on the NQO1 activity of B16 cells
由图4可知,20.00 μmol/L 的 SF 显著提高了NQO1的活性,对照组、SF、RB、DS、HS 各组细胞中的 NQO1的活性分别为(4.22±1.60)、(34.71± 4.03)、(19.53±3.59)、(12.58 ± 4.32)、(22.57 ± 3.56)(nmol 还原 MTT/min/mg 蛋白),其中SF 组与西兰花组存在显著性差异(P < 0.05);RB 组和 HS 组提取物对 NQO1 活性的影响较为显著,与 DS 组存在显著性差异(P < 0.05),但是RB 组和 HS 组之间不存在显著性差异(P > 0.05)。
3 讨论
SF 等ITCs 是通过黑芥子酶水解GLS 得到的[20],黑芥子酶在烹饪过程中易失活,因此烹饪西兰花对ITCs 含量有很大的影响[15]。为了提高烹饪西兰花ITCs的含量,许多学者提出了有效的方法,如Ghawi 等[21]在烹饪后的西兰花中添加芥菜籽粉末,SF 的含量显著提高。熟的西兰花中添加萝卜根粉末,也得出类似的结论[22]。这是由于GLS 很稳定,烹饪过程中不会分解,通过添加含有黑芥子酶的芥菜籽或萝卜根粉末,可使GLS 酶解为ITCs。但这些方法的缺点是在西兰花中添加芥菜籽或萝卜根,可能会影响食物的口感。在本论文中,提出了一个新的方法,即把西兰花切碎并保温1 h,使GLS 被酶解为ITCs。ITCs 比黑芥子酶稳定,因此烹饪后仍然有较高的ITCs 含量。经过清炒后,尽管DS 组也有水解步骤,但此时内源性黑芥子酶已经失活,因此HS 组水解液中SF、ERN、BITC 等异硫氰酸酯的含量均比DS 高。Torres-Contreras 等[23]报道西兰花切碎后,其ITCs 的含量提高了133 %,这是由于切碎过程中GLS 即发生了酶解,提高了ITCs 的含量。本论文中,HS 组增加了酶解时间,ITCs 含量是DS 组的2.6 倍。
较高的ITCs 含量意味着较好的活性,因此,本论文又分析了不同清炒方式的西兰花提取物对B16 细胞抑制率和NQO1 活性的影响,并与纯SF 的活性作比较。细胞抑制试验表明,与西兰花提取物相比,20 μmol/L的SF 在B16 细胞的抑制率和提高NQO1 酶活方面具有更好的活性。这主要是由于本论文通过环缩合法测定西兰花提取物中总ITCs 含量,如前所述,除了SF 外,西兰花提取物中还含有ERN、BITC 等其他异硫氰酸酯,这些活性物对肿瘤细胞增殖的抑制作用比SF 弱。例如,文献表明SF 和ERN 都可以提高A549 肺癌细胞的多抗药性蛋白的表达,但是SF 的活性比ERN 要高[24]。在抑制铜绿假单胞菌等细菌的群体感应方面,SF活性也比ERN 高[25]。根据已有的文献报道,SF 活性是异硫氰酸酯中最强的[9]。因此,尽管RB 组西兰花提取物ITCs 总量也是20 μmol/L,但是由于含有其它的异硫氰酸酯,因此细胞活性相对较低。
NQO1 是绝大多数真核生物细胞中普遍存在的一种黄素蛋白酶,能够解除许多天然和合成化合物的毒性,同时又能活化一些醌类抗肿瘤药物[26]。许多天然活性物,如葡萄籽原花青素、生姜提取物、冬凌草甲素等能提高细胞或机体的NQO1 活性[27-29]。西兰花提取物中的ITCs 也可以显著提高膀胱细胞、HL-60 白血病细胞以及小鼠体内膀胱组织或肠粘膜的NQO1 活性[19,30-31]。本论文的结果也表明,西兰花提取物可显著提高 B16 细胞中 NQO1 活性(P < 0.05),因此经常食用西兰花有利于人体健康。通过先酶解再清炒,其ITCs含量和活性与新鲜西兰花没有显著差异,因此该烹饪方法能有效维持西兰花的功能成分和营养价值。
4 结论
本研究结果表明,与直接清炒相比,先酶解再清炒可有效提高西兰花中异硫氰酸酯含量,且能显著提高 B16 细胞中 NQO1 的活性(P<0.05)。但是不同清炒方式对抑制B16 细胞增殖活性没有显著性差异(P>0.05)。西兰花先酶解再清炒,其ITCs 含量和诱导NQO1活性与新鲜西兰花没有显著差异(P>0.05),与直接清炒的西兰花相比存在显著性的差异(P<0.05),该烹饪方法能有效维持西兰花的功能成分和营养价值。

