丹参酮ⅡA对乳腺癌细胞阿霉素化疗敏感度的影响及相关机制
袁源,赵千,胡占升
0 引言
乳腺癌严重威胁着女性的生命健康,其死亡率也呈逐年上升的趋势。目前,乳腺癌仍以手术治疗为主,辅以放化疗。化疗在乳腺癌的综合治疗中扮演着不可或缺的角色。阿霉素是乳腺癌化疗的一线用药,然而,阿霉素对非肿瘤组织的毒副作用尤其是心脏毒性常常会限制其临床应用[1];同时,长期化疗也易使乳腺癌细胞对阿霉素的敏感度降低,导致化疗效果不佳甚至失败。因此,如何在提高阿霉素化疗敏感度的同时降低其毒副作用成为研究热点。丹参酮ⅡA是我国传统中药丹参的有效成分,不仅具有保护心血管系统以及肝脏和肾脏、调节免疫力等功能[2],同时还具有抗肿瘤作用[3-6]。因此,我们选择丹参酮ⅡA作为研究对象,研究其对人乳腺癌MCF-7及MDA-MB-231细胞阿霉素化疗敏感度的影响与可能机制,以期为丹参酮ⅡA作为化疗增敏剂与阿霉素联合应用治疗乳腺癌提供实验依据。
1 材料与方法
1.1 材料
RPMIl640购于美国Hyclone公司;胎牛血清购于德国Serana公司;人乳腺癌MCF-7细胞购于南京凯基生物科技发展有限公司;人乳腺癌MDAMB-231细胞由中国医科大学细胞生物学教研室友情馈赠;阿霉素购于深圳万乐药业有限公司;丹参酮ⅡA(纯度≥98%)购于上海江莱生物科技公司;细胞凋亡检测试剂盒购于北京四正柏生物科技有限公司;CD24-PE和CD44-FITC抗体均购于美国eBioscience公司;GAPDH、P-gp、BCRP及MRP1抗体均购于美国Santa Cruz公司。
1.2 方法
1.2.1 MTS法评估丹参酮ⅡA对乳腺癌细胞增殖的影响 取对数生长期MCF-7及MDAMB-231细胞,调整密度至1×105个/毫升,按每孔100 μl的细胞悬液接种于96孔板内,次日用不同浓度的丹参酮ⅡA处理细胞24 h,MTS法检测细胞增殖情况。最终选用对MCF-7及MDAMB-231细胞增殖没有影响的无毒剂量的丹参酮ⅡA(没有到有影响的临界浓度)用于后续实验。细胞增殖率=(OD实验组平均值-OD空白对照组平均值)/(OD阴性对照组平均值-OD空白对照组平均值)×100%。
1.2.2 MTS法评估无毒剂量的丹参酮ⅡA干预对阿霉素处理的乳腺癌细胞增殖的影响 取对数生长期的乳腺癌细胞,调整细胞密度至1×105个/毫升,按每孔100 μl的细胞悬液接种于96孔板内,次日分别用不同浓度的阿霉素以及阿霉素联合0.02 mg/L的丹参酮ⅡA处理MCF-7细胞;不同浓度的阿霉素以及阿霉素联合0.6 mg/L的丹参酮ⅡA处理MDA-MB-231细胞。24 h后MTS法检测细胞增殖情况。
1.2.3 流式细胞术检测乳腺癌细胞的凋亡 分别用2.0 μg/ml阿霉素、2.0 μg/ml阿霉素联合0.02 mg/L的丹参酮ⅡA处理MCF-7细胞24 h;2.0 μg/ml阿霉素、2.0 μg/ml阿霉素联合0.6 mg/L的丹参酮ⅡA处理MDA-MB-231细胞24 h;以下实验方法相同。收集细胞,PBS洗涤2次后用1×Binding Buffer重新悬浮细胞并调整细胞密度至1×106个/毫升,取100 μl的该细胞悬液,分别加入5 μl的Annexin V-FITC和10 μl的PI,混匀后室温下避光孵育15 min,加入PBS至400 μl,流式细胞仪检测细胞凋亡情况。
1.2.4 流式细胞法检测乳腺癌细胞中CD44+/CD24-/low的表达 收集细胞,PBS洗涤2次后重新悬浮细胞并调整细胞密度至1×106个/毫升,取100 μl的该细胞悬液,分别加入1 μl的CD44-FITC抗体和5 μl的CD24-PE抗体,混匀后4℃下避光孵育20 min,加入PBS至400 μl,流式细胞仪检测乳腺癌干细胞表面标志物CD44+/CD24-/low的表达情况。
1.2.5 流式细胞术检测无毒剂量的丹参酮ⅡA干预对乳腺癌细胞内阿霉素积累的影响 PBS洗涤细胞3次,收集细胞,PBS重新悬浮细胞并调整细胞密度至1×106个/毫升,取500 μl该细胞悬液,流式细胞仪检测MCF-7及MDA-MB-231细胞内阿霉素的积累情况。
1.2.6 Western blot法检测乳腺癌细胞P-gp、BCRP、MRP1的表达 收集细胞,按试剂说明书提取总蛋白并测定相应蛋白的浓度。稀释各蛋白浓度至相同的终浓度,取等量蛋白经SDS-PAGE电泳后转膜至PVDF膜上,封闭液封闭1 h,加入稀释后的一抗GAPDH(1:1 000)、P-gp(1:500)、BCRP(1:500)、MRP1(1:500) 4℃下孵育过夜,次日加入稀释后的二抗(1:500)室温下孵育1 h。用增强的化学发光检测试剂盒显色,自动电泳凝胶成像分析仪采集图像,以目的蛋白与GAPDH的吸光度比值表示相对蛋白含量。
1.3 统计学方法
用SPSS13.0软件进行数据分析,所有数据均以均数±标准差表示,两组间差异的比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 丹参酮ⅡA干预对阿霉素处理的乳腺癌细胞增殖的影响
丹参酮ⅡA能剂量依赖性抑制乳腺癌细胞的增殖,其中,丹参酮ⅡA浓度不超过0.02 mg/L对MCF-7细胞增殖没有影响,而丹参酮ⅡA浓度不超过0.6 mg/L对MDA-MB-231细胞增殖没有影响,见图1A、B。因此,本研究中MCF-7细胞选用0.02 mg/L、MDA-MB-231选用0.6 mg/L的丹参酮ⅡA用于后续实验。与单用阿霉素相比较,阿霉素与无毒剂量的丹参酮ⅡA联合应用后MCF-7及MDA-MB-231细胞的增殖率呈下降趋势,见图1C、D。

图1 丹参酮ⅡA干预对阿霉素处理的MCF-7(A,C)及MDA-MB-231(B,D)细胞增殖的影响Figure1 Effects of tanshinoneⅡA intervention on proliferation of doxorubicin-treated MCF-7(A,C) and MDA-MB-231(B,D) cells
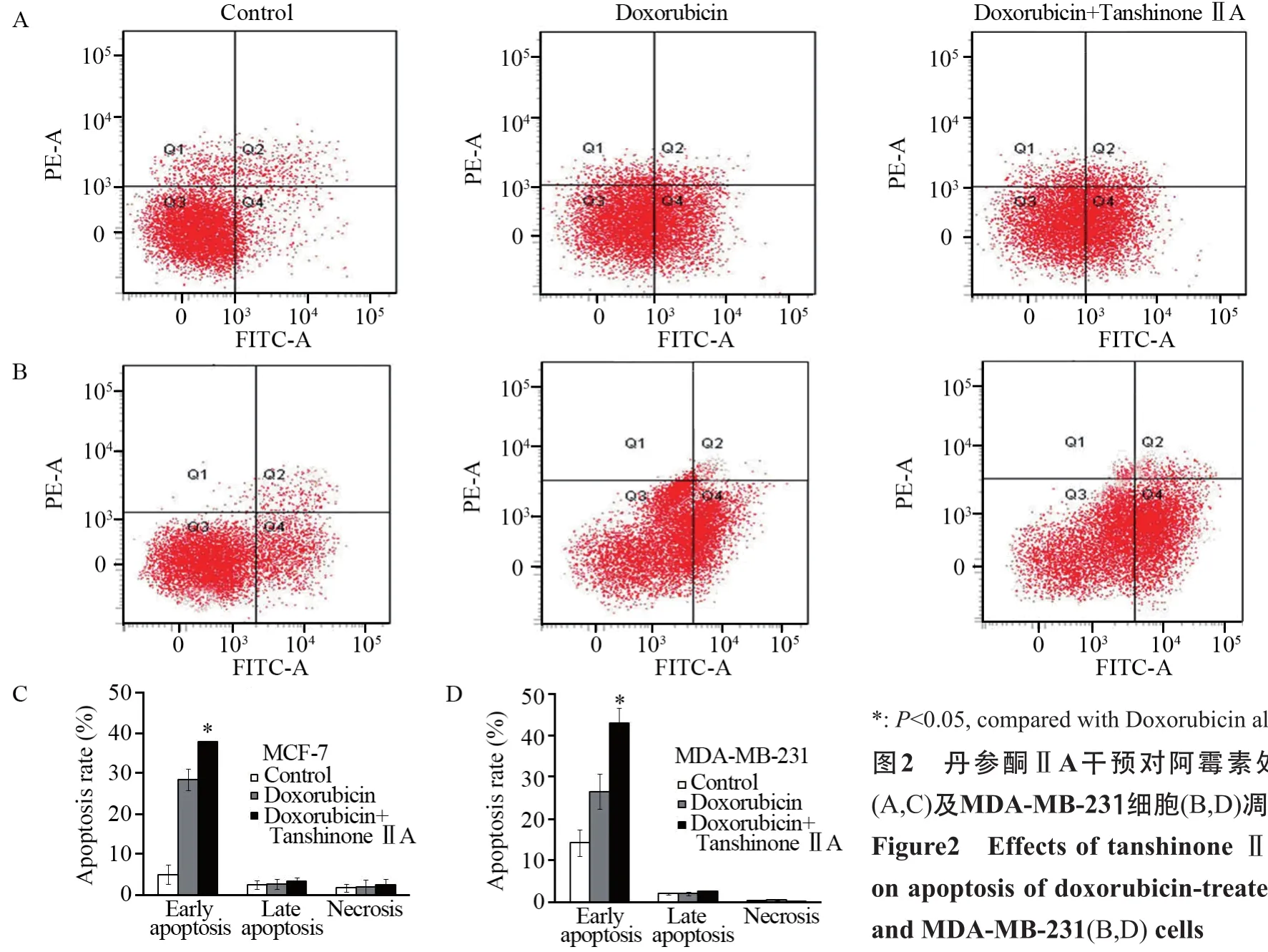
图2 丹参酮ⅡA干预对阿霉素处理的MCF-7(A,C)及MDA-MB-231细胞(B,D)凋亡的影响Figure2 Effects of tanshinone ⅡA intervention on apoptosis of doxorubicin-treated MCF-7(A,C)and MDA-MB-231(B,D) cells
2.2 丹参酮ⅡA干预对阿霉素处理的乳腺癌细胞凋亡的影响
单用阿霉素时,MCF-7及MDA-MB-231细胞的早期凋亡率分别为(28.4±2.7)%、(26.5±4.2)%;阿霉素与无毒剂量的丹参酮ⅡA联合应用后,MCF-7及MDA-MB-231细胞的早期凋亡率分别为(37.65±0.35)%、(42.9±3.6)%。与单用阿霉素相比较,阿霉素与无毒剂量的丹参酮ⅡA联合应用明显提高了MCF-7及MDA-MB-231细胞的早期凋亡率(MCF-7: P=0.021; MDA-MB-231:P=0.007),见图2。
2.3 丹参酮ⅡA干预对阿霉素处理的乳腺癌细胞CD44+/CD24-/low表达的影响
单用阿霉素时,MCF-7及MDA-MB-231细胞中CD44+/CD24-/low的表达分别为(20.9±10.9)%、(56.4±3.3)%;阿霉素与无毒剂量的丹参酮ⅡA联合应用后,MCF-7及MDA-MB-231细胞中CD44+/CD24-/low的表达分别为(17.7±10.3)%、(46.5±4.8)%。与单用阿霉素相比较,丹参酮ⅡA提高了阿霉素对人乳腺癌干细胞的杀伤作用,这种作用在MDA-MB-231细胞表现的更为明显(MDAMB-231: P=0.048),见图3。
2.4 阿霉素联合丹参酮ⅡA干预前后乳腺癌细胞外排型ABC转运蛋白P-gp、BCRP及MRP1的表达变化
与单用阿霉素相比较,阿霉素与丹参酮ⅡA联合处理的MCF-7及MCF-7/dox细胞外排型ABC转运蛋白P-gp、BCRP及MRP1的表达明显降低(均P<0.05),见图4。

图3 丹参酮ⅡA干预对阿霉素处理的MCF-7(A,C)及MDA-MB-231(B,D)细胞CD44+/CD24-/low表达的影响Figure3 Effect of tanshinone ⅡA intervention on expression of CD44+/CD24-/low in doxorubicin-treated MCF-7(A,C) and MDA-MB-231(B,D) cells
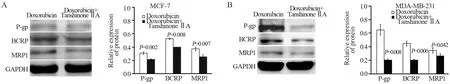
图4 阿霉素联合丹参酮ⅡA干预前后MCF-7(A)及MDA-MB-231(B)细胞外排型ABC转运蛋白P-gp、BCRP及MRP1的表达变化Figure4 Effect of tanshinone ⅡA intervention on expressions of P-gp, BCRP and MRP1 in doxorubicin-treated MCF-7(A)and MDA-MB-231(B) cells
2.5 丹参酮ⅡA干预对乳腺癌细胞内阿霉素积累的影响
单用阿霉素时,MCF-7及MDA-MB-231细胞内阿霉素积累分别为60.2±4.3、65±5.5;阿霉素与无毒剂量的丹参酮ⅡA联合应用后,MCF-7及MDA-MB-231细胞内阿霉素积累分别为76.7±4.9、80.3±8.1。在同样浓度阿霉素处理的条件下,经丹参酮ⅡA干预后的MCF-7及MDA-MB-231细胞内阿霉素积累明显增高(MCF-7: P=0.014; MDA-MB-231: P=0.042),见图5。
3 讨论
以往研究表明,不同作用机制的化疗药物在乳腺癌的治疗中显示出累加的药效[7-8],这意味着多种化疗药联合治疗乳腺癌要比一种化疗药单独治疗更有效。因此,临床上多将阿霉素与一种或两种化疗药物联合用于治疗乳腺癌。虽然这样联合用药可以降低阿霉素的使用剂量,从而减轻其不良反应,甚至一定程度弥补了由于阿霉素耐药所引起的疗效不佳的问题,但也会因此增加其他化疗药物所带来的不良反应[9]。理想的与阿霉素联合使用的药物应该在具备抗肿瘤作用的同时又具有对机体的保护作用。但是,临床上鲜有这样的药物应用。丹参酮ⅡA不仅具有抗肿瘤作用[3-6],本研究将阿霉素与其联合应用,评估了其对阿霉素抗人乳腺癌MCF-7及MDA-MB-231细胞活性的影响。结果显示:丹参酮ⅡA能剂量依赖性抑制MCF-7及MDA-MB-231细胞的增殖;与单用阿霉素相比较,即使阿霉素与无毒剂量的丹参酮ⅡA联合应用,也能明显增强阿霉素抑制细胞增殖和诱导细胞凋亡。近年来研究显示,乳腺癌干细胞与乳腺癌的发生发展、乳腺癌的耐药密切相关,因此,乳腺癌干细胞被认为是乳腺癌化疗的关键靶点。CD44+/CD24-/low被认为是乳腺癌干细胞的表面标志物[10],我们通过检测无毒剂量的丹参酮ⅡA干预对阿霉素处理的MCF-7及MDA-MB-231细胞CD44+/CD24-/low表达的影响来评估二者联合用药治疗乳腺癌的效果。结果显示,与单用阿霉素相比较,即使阿霉素与无毒剂量的丹参酮ⅡA联合应用时,也能明显增强阿霉素杀死乳腺癌干细胞的能力。以上研究结果表明,丹参酮ⅡA能够增强乳腺癌细胞对阿霉素化疗的敏感度。因此,我们对其机制进行了进一步的研究。

图5 丹参酮ⅡA干预对MCF-7(A, C)及MDA-MB-231(B, D)细胞内阿霉素积累的影响Figure5 Effect of tanshinone ⅡA intervention on accumulation of doxorubicin in doxorubicin-treated MCF-7(A, C) and MDA-MB-231(B, D) cells
ABC转运体是分布于细胞膜上的一个古老而庞大的蛋白家族,可通过调控药物的摄取和排除,参与药物在体内的吸收、分布、转化及排泄过程。按其转运方向的不同,可以分为摄取型转运体和外排型转运体两种。其中,外排型转运体能够依赖ATP水解释放的能量,将摄入细胞内的阿霉素排除,从而导致阿霉素的疗效降低,甚至发生阿霉素耐药[11]。目前发现的与药物敏感度相关的外排型ABC转运蛋白有9个,其中P-gp、BCRP和MRP1研究的最多,且结果显示这三种蛋白的表达水平与阿霉素在细胞内的积累以及乳腺癌细胞对阿霉素的敏感度呈负相关[12-13]。本研究结果显示,即使无毒剂量的丹参酮ⅡA也能增强乳腺癌细胞阿霉素化疗的敏感度,因此,我们首先检测了丹参酮ⅡA干预对MCF-7及MDA-MB-231细胞内阿霉素积累的影响。结果显示,在同一浓度阿霉素处理的条件下,无毒剂量的丹参酮ⅡA能明显增加MCF-7及MCF-7/dox细胞内阿霉素积累的量。我们接下来评估了丹参酮ⅡA干预对MCF-7及MDAMB-231细胞P-gp、BCRP、MRP1的表达的影响。结果显示,无毒剂量的丹参酮ⅡA能明显下调阿霉素处理的MCF-7及MDA-MB-231细胞P-gp、BCRP、MRP1的表达。
本研究结果表明,在同一浓度阿霉素处理的条件下,丹参酮ⅡA能够通过下调P-gp、BCRP、MRP1的表达增加乳腺癌细胞内阿霉素的积累,从而增加阿霉素在乳腺癌细胞内的生物利用度,增强乳腺癌细胞阿霉素化疗的敏感度。因此,当阿霉素与丹参酮ⅡA联合使用时,既一定程度地降低阿霉素的给药剂量,也能达到原有给药剂量的化疗效果,从而一定程度地降低阿霉素的毒副作用。以往研究表明,即使在同一浓度阿霉素处理的条件下,丹参酮ⅡA也能降低阿霉素的毒副作用[14]。因此,丹参酮ⅡA可以作为一种化疗增敏剂与阿霉素联用治疗乳腺癌。

