盐酸莫西沙星原料药微生物限度检测方法验证
孙蓉 潘玲利 张军东

摘 要 目的:建立合适的盐酸莫西沙星原料的微生物限度检测方法,对该方法进行验证,确保适用。方法:根据中国药典2015版指导原则,采用薄膜过滤法,分别以聚山梨酯80和氯化镁作为中和剂,比较对盐酸莫西沙星的抑菌活性的影响。结果:加入氯化镁作为中和剂可以较好的消除盐酸莫西沙星的抑菌活性。结论:该方法准确,可靠,操作方便,适用于盐酸莫西沙星原料的微生物限度检测。
关键词 盐酸莫西沙星 微生物限度 薄膜过滤法
中图分类号:R927.11 文献标志码:A 文章编号:1006-1533(2019)13-0068-05
Methodological validation of microbial limit test for moxifloxacin hydrochloride
SUN Rong1*, PAN Lingli2, ZHANG Jundong1**
(1. Shanghai Haohai Biotechnology Co., Ltd., Shanghai 201613, China; 2. Shanghai Li Kang Rui Biological Engineering Co., Ltd., Shanghai 201707, China)
ABSTRACT Objective: To establish a suitable method for the detection of the microbiological limit in moxifloxacin raw material and to verify the method so as to ensure its application. Methods: The effects of polysorbitol 80 and magnesium chloride as neutralizers on the antibacterial activity of moxifloxacin itsself in microbiological limit test were compared by membrane filtration method based on the Guideline of Chinese Pharmacopoeia 2015 Edition. Results: The antibacterial activity of moxifloxacin itsself could be better eliminated when magnesium chloride was added. Conclusion: This method is accurate, reliable, and convenient to operate and is suitable for the detection of microbial limits in moxifloxacin hydrochloride raw materials.
KEy WORDS moxifloxacin hydrochloride; microbial limit; membrane filtration method
盐酸莫西沙星为第四代新型喹诺酮类抗菌药物,具有广谱抗菌活性,抗菌的作用机制为抑制拓扑异构酶Ⅱ和拓扑异构酶Ⅳ,阻断细菌DNA合成,主要优势是耐药性极低,为1.8×10-9~1×10-11,特别是不易与其他喹诺酮类抗生素产生交叉耐药。与第三代喹诺酮类药物相比,它进一步提高了对革兰阳性菌如肺炎球菌的抑制活性,同时也可以有效抑制厌氧菌。抗非发酵菌(假单胞菌属和洋葱伯克霍尔德菌(Burkholderia cepacia)除外)、葡萄球菌、肺炎链球菌、肠球菌和厌氧菌的活性是环丙沙星和氧氟沙星的2~16倍;抗大肠埃希菌的活性是环丙沙星的50%,而抗沙眼衣原体、肺炎衣原体和支原体的活性都比环丙沙星高[1]。盐酸莫西沙星开发的制剂包括片剂,滴眼液,注射液,疗效显著[2-6]。
由于盐酸莫西沙星自身的抗菌活性,常规检测方法未必能真实反映其原料药中的微生物负载,但药品微生物限度是药品安全性的重要指标之一,法规文件也对此提出了明确要求[7]。所以,进行微生物限度检查时,要求供試品自身在试验的条件下能有效排除其抑菌作用,使其不干扰染菌的限度检验,检测方法通过验证可以确认供试品所采用的检查方法和检验条件适用[8-9]。
为消除盐酸莫西沙星的抑菌活性,准确检测出每克原料实际微生物负载量,本研究确认培养基适用性之后,采用薄膜过滤法,选择氯化镁溶液作为中和剂,并以聚山梨酯80作为中和剂同时比较,旨在验证该方法适用于盐酸莫西沙星原料药中微生物限度的检测。
1 材料和方法
1.1 菌株与培养基
实验所用菌株为即用型定量菌株,金黄色葡萄球菌CMCC(B)26003(批号20181008);枯草芽胞杆菌CMCC(B)63501(批号20180908);铜绿假单胞菌CMCC(B) 10104(批号20180809);白色假丝酵母CMCC(F) 98001(批号20180904);黑曲霉CMCC(F) 98003(批号20180817)。以上菌株均为3代,全部购自浙江泰林生物技术股份有限公司。其冻干粉直接用商品配套溶液复溶,配制成菌悬液浓度为每0.1 ml不超过100 cfu。
胰酪大豆胨琼脂培养基(批号20181025)和沙氏葡萄糖琼脂培养基(批号20170837),均购自浙江泰林生物技术股份有限公司;胰酪大豆胨琼脂对照培养基(批号135025-201603)和沙氏葡萄糖琼脂对照培养基(批号135013-201502),购自中国食品药品检定研究院。
1.2 药品与试剂
盐酸莫西沙星原料(印度瑞迪实验制药股份有限公司,批号ABKH005846),氯化镁(国药集团化学试剂有限公司,批号20181130),pH 7.2无菌磷酸盐缓冲液(自制,批号20181127)。
1.3 仪器
BHC-1300IIA2生物安全柜(苏州时金净化设备科技有限公司);LRH-250生化培养箱(上海合恒仪器有限公司);LRH-100生化培养箱(上海合恒仪器有限公司);ES-315全自动灭菌锅(日本Tomy公司);KBF220一次性使用集菌过滤培养器(温州维科生物实验设备有限公司);XK97-A菌落计数器(邦西仪器科技(上海)有限公司)。
1.4 方法
1.4.1 培养基适用性检查
按定量菌株要求分别配制好菌悬液,使每0.1 ml菌液浓度不超过100 cfu;按照培养基说明书要求,配制好培养基。取金黄色葡萄球菌、铜绿假单胞菌和枯草芽胞杆菌菌悬液各0.1 ml,分别各注入2个无菌平皿中,立即倾注胰酪大豆胨琼脂培养基,混匀,凝固,于30~35℃倒置培养3 d。白色假丝酵母和黑曲霉同法操作菌,但于30~35 ℃倒置培养5 d;同时,还将他们置于沙氏葡萄糖琼脂培养基20~25 ℃培养5 d。细菌和真菌均须用相应的对照培养基替代被检培养基进行上述试验。
逐日观察需氧菌和真菌的菌落生长情况,进行菌落计数,取平均值计算比值。观察比较试验菌在被检培养基上与相应的对照培养基上的菌落的数量、形态和大小。
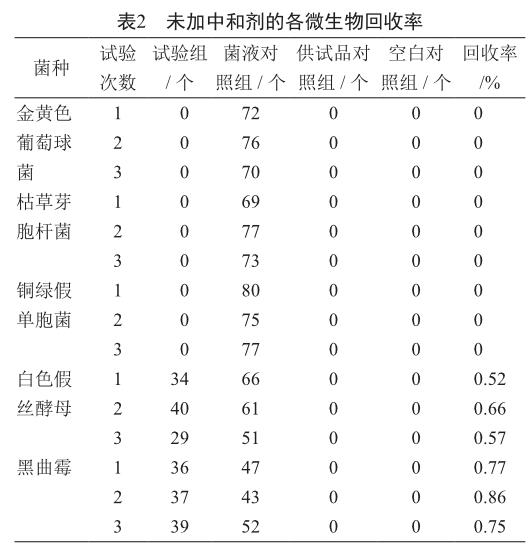
1.4.2 未加中和剂
称量盐酸莫西沙星原料10 g,溶于1 000 ml pH 7.2无菌磷酸盐缓冲液,作为1∶100的供试液。
1)试验组 取供试液100 ml与0.1 ml的金黄色葡萄球菌的菌悬液混匀,过滤,用700 ml pH 7.2无菌磷酸盐缓冲液冲洗,每次100 ml,冲洗7次;将滤膜取出,菌面向上,贴于胰酪大豆胨琼脂培养基平皿上(平行制备2个平皿),于30~35 ℃倒置培养不超过3 d,进行菌落计数。铜绿假单胞菌和枯草芽胞杆菌同法操作。而白色假丝酵母和黑曲霉须同法操作各制备2张滤膜,分别贴于胰酪大豆胨琼脂培养基平皿和沙氏葡萄糖琼脂培养基平皿上,置于30~35 ℃和20~25 ℃倒置培养不超过5 d。
2)菌液对照组 取稀释液100 ml代替供试液,加入0.1 ml的菌悬液(不超过100 cfu),混匀,过滤,按试验组同法操作。
3)供试品对照组 取供试液100 ml,不接入试验菌,按照试验组同法操作。
4)空白对照组 用稀释液100 ml代替供试液,不接入试验菌,按照试验组同法操作。
试验组菌数回收率=(试验组菌落数-供试品对照组菌落数)/菌液对照组菌落数×100%。
上述试验独立平行操作3次。
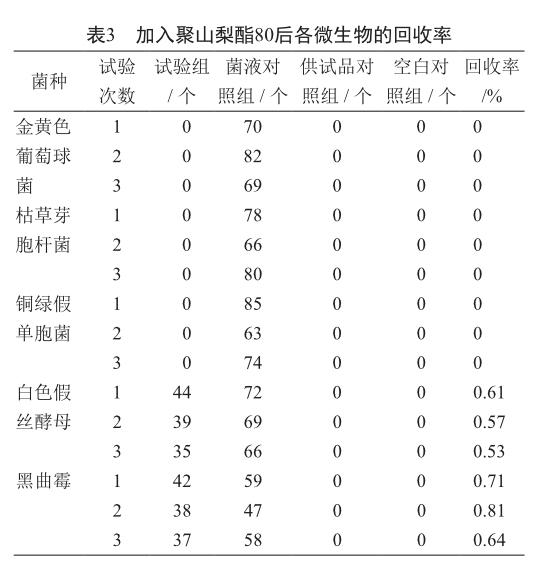
1.4.3 中和剂加入试验
分别以4.0%聚山梨酯80和2 mol/L氯化镁为中和剂,各组每100 ml培养基中加入了5 ml中和剂,其余按1.4.2操作。
2 结果
2.1 培养基适用性
被检与对照培养基菌落平均数的比值均在0.5~2范围内,且菌落形态大小与对照培养基的菌落一致(表1),说明培养基适用性检查符合要求。
2.2 不加中和剂
盐酸莫西沙星对细菌的抑菌活性较强,检测需氧菌总数时需要添加合適的中和剂抑制其自身的抗菌活性;白色假丝酵母和黑曲霉的回收率在0.5~2.0之间(表2),符合药典规定要求,表明可直接进行霉菌和酵母菌的微生物限度检测。
2.3 加入中和剂
2.3.1 聚山梨酯80
加入聚山梨酯80对需氧菌的生长没有明显影响,表明其不能抑制盐酸莫西沙星自身的抗菌活性,但其对霉菌和酵母菌的检测没有影响(表3)。
2.3.2 氯化镁
氯化镁作为中和剂加入可较好地消除盐酸莫西沙星的抑菌活性,适用于需氧菌总数的检测,而对霉菌和酵母菌的检测没有影响(表4)。
3 讨论
不同的产品,或者同一产品用途不同,微生物限度的检测方法都存在差异,需要建立合适的方法[10-17]。根据中国药典2015版通则1105要求[18],本研究首先确认了培养基适用性,然后验证计数方法适用性,即微生物限度检测方法适用性。
盐酸莫西沙星在水中溶解度不是特别好,选择pH 7.2磷酸盐缓冲液,可以提高溶解度,并且溶液pH稳定。盐酸莫西沙星配成1∶100的供试液,取100 ml,采用薄膜过滤法,单张薄膜菌落数即可为每克原料的微生物负载量,无需换算,符合检测限度要求的量。
盐酸莫西沙星属于喹诺酮类药物,对金黄色葡萄球菌、铜绿假单胞菌,枯草芽胞杆菌有明显抑制作用,未加中和剂或加中和剂聚山梨酯80时,这三种细菌的回收率均为0。据文献报道[19],氟喹诺酮类药物与Mn2+、Mg2+等金属离子络合,可降低其生物活性。本研究比较了培养基中不加中和剂、加入中和剂聚山梨酯80和氯化镁对其自身抗菌活性的影响,结果显示氯化镁作为中和剂具有较好的抑制其自身抗菌活性的效果,与文献报道一致。细菌和真菌的回收率大都可达0.5以上,仅枯草芽胞杆菌有一次回收率为0.49。中国药典2015版规定[18]:若各试验组菌数的回收率均符合要求,照所用的供试液制备方法及计数方法进行该供试品的需氧菌总数、霉菌和酵母菌总数计数。方法适用性确认时,若采用上述方法还存在一株或多株试验菌的回收达不到要求,那么选择回收最接近要求的方法和试验条件进行供试品的检查。
根据微生物限度验证结果可知,盐酸莫西沙星对白色假丝酵母和黑曲霉的抑菌活性不强,无论加中和剂与否,回收率均在0.5~2.0之间。根据中国药典2015版要求,回收率在0.5~2.0之间,可认为该方法适用,即可用于霉菌和酵母菌的检测。
本研究表明,胰酪大豆胨琼脂培养基中加入氯化镁中和剂,可用于检测需氧菌总数;沙氏葡萄糖琼脂培养基不加中和剂,可用于检测霉菌和酵母菌总数。符合中国药典检测抗菌药物微生物限度的有关要求。也许还有更合适的试剂或更合适的浓度可以更好地消除盐酸莫西沙星自身的抑菌活性,研究人员将继续探索,以期发现更合适的抑菌中和剂。
参考文献
[1] 张英, 赵志刚, 张杰. 莫西沙星——一种新的氟喹诺酮类药物[J]. 中国临床药理学杂志, 2002, 18(5): 396-400.
[2] Keating GM. Moxifloxacin 0.5% ophthalmic solution: in bacterial conjunctivitis[J]. Drugs, 2011, 71(1): 89-99.
[3] McDonald MB, Protzko EE, Brunner LS, et al. Efficacy and safety of besifloxacin ophthalmic suspension 0.6% compared with moxifloxacin ophthalmic solution 0.5% for treating bacterial conjunctivitis[J]. Ophthalmology, 2009, 116(9): 1615-1623.
[4] Garg P, Mathur U, Sony P, et al. Clinical and antibacterial efficacy and safety of besifloxacin ophthalmic suspension compared with moxifloxacin ophthalmic solution[J]. Asia Pac J Ophthalmol (Phila), 2015, 4(3): 140-145.
[5] Mather R, Karenchak LM, Romanowski EG, et al. Fourth generation fluoroquinolones: new weapons in the arsenal of ophthalmic antibiotics[J]. Am J Ophthalmol, 2002, 133(4): 463-466.
[6] Kowalski RP, Dhaliwal DK, Karenchak LM, et al. Gatifloxacin and moxifloxacin: an in vitro susceptibility comparison to levofloxacin, ciprofloxacin, and ofloxacin using bacterial keratitis isolates[J]. Am J Ophthalmol, 2003, 136(3): 500-505.
[7] 国家食品药品监督管理局药品审评中心. 已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)[EB/OL].(2017-12-22) [2019-01-28]. http://www.cde.org.cn/news. do?method=largeInfo&id=314333.
[8] 谢委, 马永贵, 张光勋, 等. 阿托伐他汀钙片微生物限度检查方法学验证[J]. 中国药师, 2013, 16(3): 471-473.
[9] 黄依玲. 医院制剂微生物限度检查方法的重新验证[J]. 中国现代药物应用, 2013, 7(9): 3-4.
[10] 刘涛, 朱斌, 韦涛, 等. 氧氟沙星栓微生物限度检查方法探讨[J]. 临床合理用药杂志, 2010, 3(20): 4-5.
[11] 万进, 林蒙, 谢委, 等. 盐酸左氧氟沙星凝胶微生物限度检查方法验证[J]. 医药导报, 2015, 34(11): 1486-1489.
[12] 李春梅. 阿可拉定原料微生物限度检查方法验证研究[J].山东化工, 2016, 45(20): 47-48; 52.
[13] 胡文红, 程春雷, 王德利. 应用中和剂对氟喹诺酮类药物微生物学检查方法的影响[J]. 食品与药品, 2011, 13(11): 417-420.
[14] 殷建国. 微生物限度检查应注意的若干问题[J]. 中国药事, 2004, 18(7): 456.
[15] 刘戈, 邱唯佳, 费夷敏. 替硝唑栓微生物限度检查方法适用性试验研究[J]. 上海医药, 2016, 37(13): 73-76.
[16] 张媛媛 张玥莉. 丹参多酚酸盐微生物限度检查方法的建立[J]. 上海医药, 2017, 38(3): 72-74.
[17] 占景华, 石鹤坤, 钟渊福, 等. 他克莫司胶囊微生物限度检查法验证的探讨[J]. 实用药物与临床, 2014, 17(11): 1442-1445.
[18] 国家药典委員会. 中华人民共和国药典2015版四部[M].北京: 中国医药科技出版社, 2015: 140-144.
[19] 张加玲, 樊慧芝, 潘景浩. 电化学方法研究氟喹诺酮类药物与金属镁、锰离子的相互作用[J]. 山西临床医药, 1996, 5(4): 311-313.

