基因多态性与肾移植患者急性排异反应的系统评价再评价*
田方圆,吴斌,占美,罗敏,徐珽
(四川大学华西医院临床药学部,成都 610041)
2012年《柳叶刀》发表了首个中国慢性肾疾病横断面调查研究结果,数据显示我国慢性肾疾病总患病率为10.8%,预计有1.195亿患者[1]。肾移植作为终末期慢性肾衰竭患者最理想的肾脏替代疗法,在全球范围内迅速推广。中国肾移植科学登记系统数据中心(Chinese Scientific Registry of Kidney Transplantation Data Center,CSRKT)统计数据表明,2015年我国共完成肾移植手术7131例,仅次于美国,居世界第2位[2]。据肾移植注册库统计,出院时无排斥反应患者的1年肾存活率为80%,而已有一次或多次排斥患者的1年肾存活率仅为67%[3]。随着药物基因组学的发展,编码药物代谢酶、药物转运体和药物作用靶点的基因序列多态性研究,受到人们的重视。基因多态性被认为是影响钙调神经磷酸酶抑制剂(calcineurin inhibitor,CNI)免疫效果存在个体化差异的重要原因,如CYP3A和药物转运体P糖蛋白相关基因[4]。CNI的代谢和转运受CYP3A和P糖蛋白的影响。基因多态性对药物的代谢、排泄产生影响,从而影响药物浓度,进一步影响免疫抑制效果。因此,明确基因多态性与肾移植患者急性排异反应的关系,对制定个体化给药方案具有重要意义。本研究旨在通过系统评价再评价方法,评价基因多态性与肾移植患者急性排异反应的关系,以期为临床提供参考。
1 资料与方法
1.1纳入与排除标准
1.1.1研究类型 纳入基因多态性与肾移植患者急性排异反应关系的系统评价或Meta分析,语种限制为中文和英文。
1.1.2研究对象 使用CNI治疗的肾移植患者,患者的国籍、种族、性别、年龄、检测方法不限。
1.1.3干预措施 对纳入研究患者使用免疫抑制药,病例组为肾移植急性排异反应组,对照组为肾移植无急性排异反应组。
1.1.4结局指标 不同基因型与肾移植急性排异反应的相关性。
1.1.5排除标准 ①专家述评、书信及会议摘要;②重复发表的文献;③未报导目标结局指标研究。
1.2检索策略 以“genotype”,“kidney transplantation”等为检索词计算机检索The Cochrane Library(2017年8期),Medline,EMBase,包括主题词检索和自由词检索;以“基因多态性”“肾移植”等为检索词检索中国生物医学文献数据库(Chinese biomedical database,CBM)、中国知网(China national knowledge internet,CNKI)、维普网(VIP)和万方数据库(wan fang data),检索时限截止至2017年8月。同时手工检索纳入文献的参考文献。以OVID Medline为例,检索式为:#1 Genotype/;#2 Polymorphism,Genetic/;#3 Cytochrome P-450 CYP3A/;#4 P-Glycoproteins/;#5 Genes,MDR/;#6(Genotype* or Genogroup* or Genetic* or Cytochrome P?450 or P-450 or CYP3A or MDR Gene or Multidrug Resistance Gene or P Glycoproteins or P-gp).ti,ab;#7 1 or 2 or 3 or 4 or 5 or 6;#8(review or review,tutorial or review,academic).pt;#9(medline or medlars or embase or pubmed or cochrane).tw,sh;#10(scisearch or psychinfo or psycinfo).tw,sh;#11(psychlit or psyclit).tw,sh;#12 cinahl.tw,sh;#13((hand adj2 search$) or(manual$ adj2 search$)).tw,sh;#14(electronic database$ or bibliographic database$ or computeri?ed database$ or online database$).tw,sh;#15(pooling or pooled or mantel haenszel).tw,sh;#16(peto or dersimonian or der simonian or fixed effect).tw,sh;#17(retraction of publication or retracted publication).pt;#18 or/9-17;#19 8 and 18;#20 meta-analysis.pt;#21 meta-analysis.sh;#22(meta-analys$ or meta analys$ or metaanalys$).tw,sh;#23(systematic$ adj5 review$).tw,sh;#24(systematic$ adj5 overview$).tw,sh;#25(quantitativ$ adj5 review$).tw,sh;#26(quantitativ$ adj5 overview$).tw,sh;#27(quantitativ$ adj5 synthesis$).tw,sh;#28(methodologic$ adj5 review$).tw,sh;#29(methodologic$ adj5 overview$).tw,sh;#30(integrative research review$ or research integration).tw;#31 or/20-30;#32 19 or 31;#33 kidney transplantation/;#34(Kidney Transplant* or Renal Transplant* or Kidney Graft* or Renal Graft*).ti,ab;#35 33 or 34;#36 7 and 32 and 35。
1.3文献筛选和资料提取 由2位研究人员按照纳入与排除标准独立进行文献筛选和资料提取,并交叉核对,如遇分歧,则通过协商或请求第3名研究人员辅助解决。首先阅读问题和摘要,排除明显不相关的文献后,进一步阅读全文,确定最终是否纳入。数据提取内容包括:① 研究的基本信息,包括作者、发表年份、患者样本量等;②系统评价的方法学情况,包括文献检索、纳入研究、研究样本以及对纳入研究的方法学质量评价;③统计分析结果,对各个结局指标定量分析。
1.4纳入研究的方法学质量评价 采用AMSTAR工具对纳入的系统评价或Meta分析从11个方面,即是否提供了前期设计方案、纳入研究的选择和数据提取是否具有可重复性、是否实施广泛全面的文献检索、发表情况是否已考虑在纳入标准中,如灰色文献、是否提供了纳入和排除的研究文献清单、是否描述纳入研究的特征、是否评价和报道纳入研究的科学性、纳入研究的科学性是否恰当地运用在结论的推导上、合成纳入研究结果的方法是否恰当、是否评估发表偏倚的可能性以及是否说明相关利益冲突进行方法学质量评价[5]。
2 结果
2.1文献检索和筛选结果 初检剔除重复文献后获得104篇备选文献。根据纳入和排除标准,最终纳入符合标准的文献共11篇[6-16]。其中,8篇来自Medline、2篇来自EMbase、1篇来自CNKI。文献筛选过程及结果见图1。

图1 文献筛选流程及结果
Fig.1Processandresultsofliteraturescreening
2.2纳入研究的基本特征 纳入的11个[6-16]系统评价均为期刊发表论文,其中10个[6-15](90.9%)研究为英文,1个[16](9.1%)研究为中文,发表于2008—2016年之间,纳入研究的基本特征见表1。
2.3纳入系统评价的方法学质量评价结果 运用AMSTAR条目对纳入的系统评价或Meta分析进行方法学质量评价。AMSTAR条目为11条:①是否提供了前期设计方案;②纳入研究的选择和数据提取是否具有可重复性;③是否实施广泛全面的文献检索;④发表情况是否已考虑在纳入标准中,如灰色文献;⑤是否提供了纳入和排除的研究文献清单;⑥是否描述纳入研究的特征;⑦是否评价和报道纳入研究的科学性;⑧纳入研究的科学性是否恰当地运用在结论的推导上;⑨合成纳入研究结果的方法是否恰当;⑩是否评估了发表偏倚的可能性;是否说明相关利益冲突。以“Y”表示满足,“N”表示不满足,“CA”表示不清楚,“UC”表示不完全。结果显示,11篇均未报告 条目1“是否提供了前期设计方案”、条目4“发表情况是否已考虑在纳入标准中”和条目7“是否评价和报道纳入研究的科学性”。整体纳入研究质量偏低。详细结果见表2。
2.4系统评价结论汇总 5个[6,9,12,15-16]系统评价中CTLA4+49A/G、TNF-A-308、IL-10-1082 G/A、CTLA-4 CT60中不同基因位点与肾移植患者急性排异反应有关,其中CTLA4+49A/G、TNF-A-308中的AA/AG基因型患者与GG基因型患者相比,发生肾移植急性排异反应的风险更高,CTLA4+49A/G中的G基因型患者高于A基因型患者;IL-10-1082 G/A中DD+ID基因型患者与Ⅱ基因型患者相比,发生肾移植急性排异反应的风险更高;CTLA-4 CT60 中AG/GG、GG基因型患者与AA基因型患者相比,G基因型患者与A基因型患者相比,发生肾移植急性排异反应的风险更高,差异均有统计学意义(P<0.05)。其他基因型不同位点并未发现与肾移植患者急性排异反应有关。
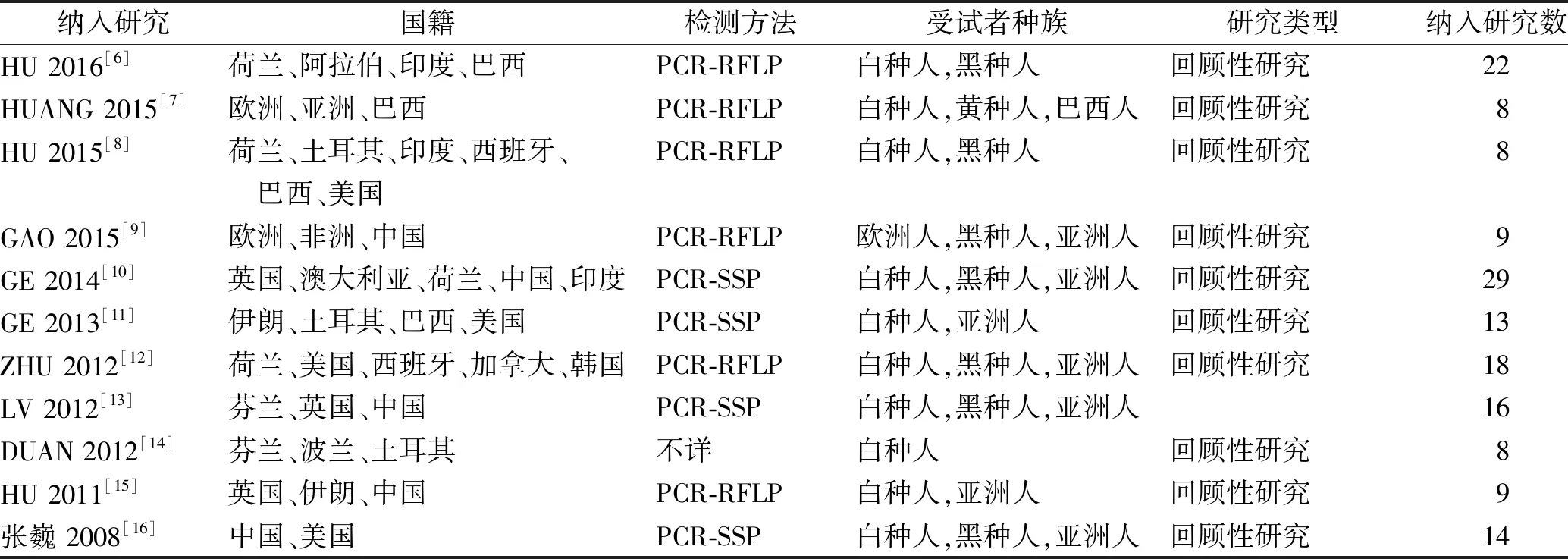
表1 纳入研究的基本特征
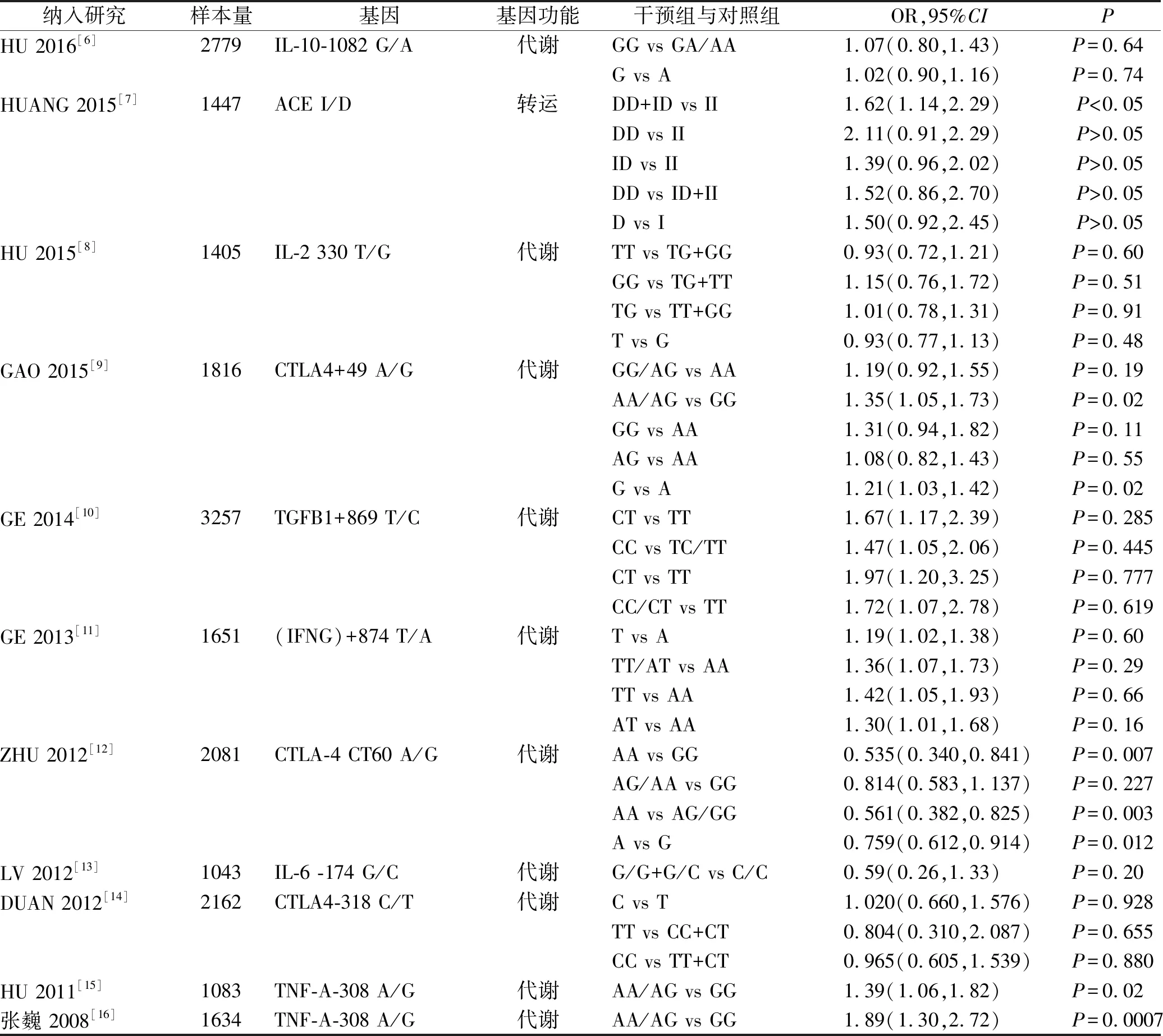
续表1 纳入研究的基本特征
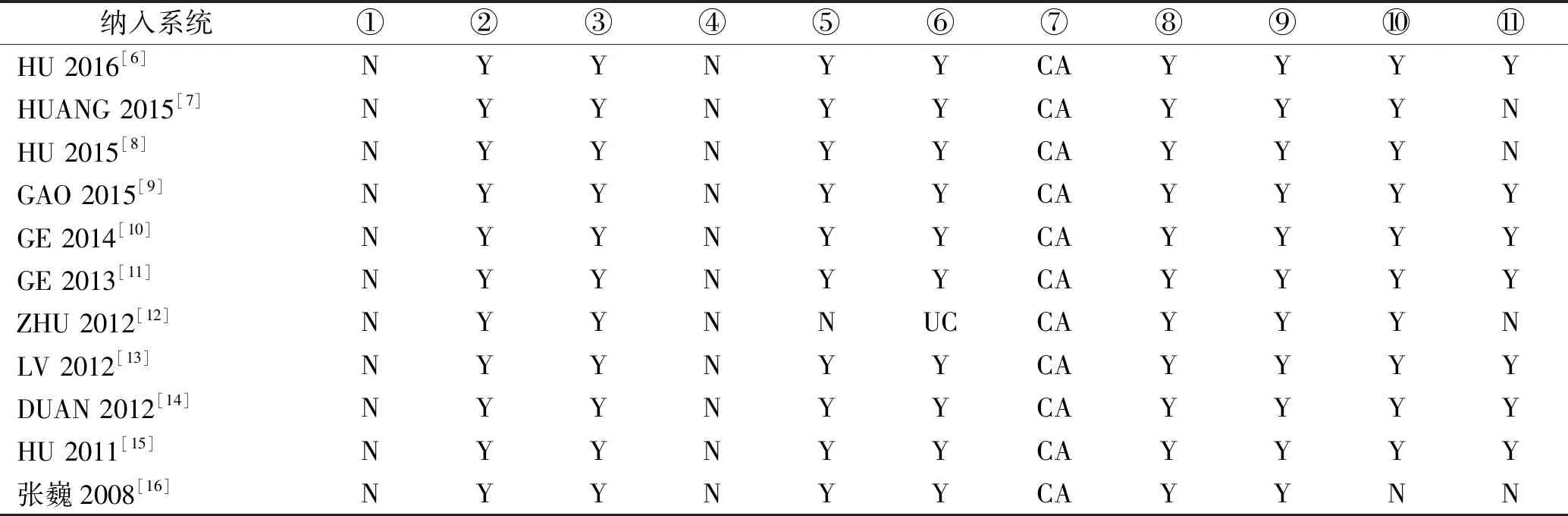
表2 纳入系统评价AMSTAR结果
3 讨论
患者在器官移植术后须使用免疫抑制药来预防排异反应的发生。但是,长期服用免疫抑制药患者个体间所存在的疗效差异,起初主要归结于一些非遗传因素如肝、肾功能,药物相互作用。然而,这些因素仅部分解释了免疫抑制效果的个体差异,而药物代谢酶、药物转运体基因等基因多态性研究则对此作出了很好的补充。系统评价再评价是全面搜集针对同一疾病或同一健康问题的病因、诊断、治疗或预后等方面的相关系统评价进行再评价的一种综合研究方法,能够鉴别系统评价存在的方法学偏倚及其结论证据质量的高低,为决策者提供更为集中的高质量证据[17]。在基因多态性研究领域引入循证医学方法及其理念,将有助于提高免疫抑制药治疗安全性和有效性。尽管系统评价作为循证医学重要的研究方法和最佳证据的重要来源之一[18]。但只有质量高的系统评价才能为临床医师、患者及其他决策者提供科学依据[19]。在系统评价方法学质量的评价过程中,11个系统评价均未提供前期设计方案,这可能会对系统评价的严谨性产生影响;在评估发表偏倚的题目得分均较低,其主要原因是由于系统评价纳入研究数目较少时,未进行发表偏倚检测,若系统评价存在发表偏倚,可能会高估研究措施的效果;4个系统评价未报告利益冲突。CTLA4+49A/G中的AA/AG基因型患者与GG基因型患者相比、G基因型患者与A基因型患者相比,发生肾移植急性排异反应的风险更高,其他基因型患者与AA基因型患者相比,则并无差异。两个系统评价分析了TNF-A-308不同基因型对肾移植急性排异反应的影响,其中AA/AG基因型患者与GG基因型患者相比,发生肾移植急性排异反应的风险更高。IL-10-1082 G/A中DD+ID基因型患者与Ⅱ基因型患者相比,发生肾移植急性排异反应的风险更高。CTLA-4 CT60中AG/GG、GG基因型患者与AA基因型患者相比,G基因型患者与A基因型患者相比,发生肾移植急性排异反应的风险更高。其他基因型不同位点并未发现与肾移植患者急性排异反应有关。
本次研究的局限性表现为:①部分系统评价纳入研究数量少,样本量偏少,不排除假阳性结果的可能性。②纳入研究仅对不同时间下中基因多态性和药物代谢之间关系进行评价,并未考虑不同种族具体差异,因此,难以完全展现基因多态性对肾移植患者术后急性排异反应的影响。
综上所述,本次研究结果提示CTLA4+49A/G、TNF-A-308、IL-10-1082 G/A、CTLA-4 CT60中不同基因位点与肾移植患者急性排异反应存在一定影响,但仍需要更高质量的研究证明。

