刺盘孢属真菌PCR检测方法的建立
李 凤,张祥林,王 翀,罗 明
(1.新疆农业大学农学院,乌鲁木齐 830052;2.乌鲁木齐海关技术中心,乌鲁木齐 830063)
0 引 言
【研究意义】刺盘孢属 (Colletotrichum)真菌种类多,分布广,常引起多种植物炭疽病,为害许多农作物、果树、蔬菜等,影响农产品的质量及产量,对农业生产带来严重的损失[1-2]。刺盘孢属真菌中的咖啡浆果炭疽病菌主要为害小粒种咖啡,是咖啡上的一种毁灭性病害[3]。该属在植物病原真菌中占有重要的地位。【前人研究进展】以往对刺盘孢属真菌的分类鉴定主要依靠传统的形态学特征进行,包括分生孢子和附着胞的形态、大小,刚毛、菌核、有性型等[4]。随着分子生物学的发展,核糖体DNA内转录间隔区(Internaltranscribedspacers,ITS)序列分析被越来越多的应用到真菌分类鉴定中。在真核生物核糖体DNA内转录间隔区的18S rRNA(smallsubunit,SSU)和 28S rRNA(largesubunit,LSU)的基因序列较长且进化速度慢,较为保守,可用在属以上分类单元的系统学分析中[5]。陈汝等[6]对有炭疽病症状的红富士果实利用rDNA-ITS 序列分析结合形态学特征,将病原菌鉴定为胶孢炭疽菌。李河等[7]利用形态学检测结合多基因系统学方法对从油茶叶上分离的病原菌进行鉴定,鉴定出病原菌为暹罗刺盘孢。邓维萍等[8]对在云南省葡萄主产区采集的炭疽病菌菌株利用形态学鉴定结合特异性引物分子检测,明确了病原菌为胶孢炭疽菌。李海云等[9]对从大豆茎秆上分离的大豆炭疽病菌,通过菌落及分生孢子形态、病原菌的致病性及ITS与ACT序列特征,将该病原菌鉴定为Colletotrichumchlorophyti。【本研究切入点】目前对该属真菌的研究多集中在属间分类和病原菌的种类鉴定等方面,对该属真菌快速检测的报道很少。设计出检测该属真菌的特异性引物,建立快速检测该属真菌的PCR方法。【拟解决的关键问题】通过对刺盘孢属及其近似属的ITS基因序列分析,设计出能够快速检测刺盘孢属的特异性引物。
1 材料与方法
1.1 材 料
研究所用的40株不同种的刺盘孢属(Colletotrichum)真菌菌株,3株刺盘孢属近似属Cryptosporiopsiscaliforniae、Monochaetiakansensis、Pestalotiopsissp.菌株由中科院微生物所提供,2株Hainesialythri、Ascochytopsisvignae菌株购买自中国普通微生物菌种保藏管理中心,1株PestalotiatheaeSaw菌株购买自中国农业微生物菌种保藏管理中心,详细的菌株名称、寄主及来源。表1
表1 供试菌株
Table 1 The strain used in this study

序号NO.菌株 Strain 寄主 Strain 菌种来源 Source1Colletotrichum acutatum complex野茶树Camellia sinensis中科院微生物所,编号LC34432Colletotrichum aenigma印第安魔力海棠Malus Indian Magic中科院微生物所,编号LC30343Colletotrichum alienum野茶树Camellia sinensis中科院微生物所,编号LC31144Colletotrichum bletillum黄花白芨Bletilla ochracea中科院微生物所,编号LC23407Colletotrichum caudasporum黄花白芨Bletilla ochracea中科院微生物所,编号LC23118Colletotrichum cereale黄花白芨Bletilla ochracea中科院微生物所,编号LC23069Colletotrichum clavatum中科院微生物所,编号LC517410Colletotrichum cliviae野茶树Camellia sinensis中科院微生物所,编号LC354611Colletotrichum coccodes番茄Lycopersicon esculentum Mill.中科院微生物所,编号LC004112Colletotrichum conoides辣椒Capsicum annuum中科院微生物所,编号LC622613Colletotrichum cordylinicola兴山马醉木Pieris formosa 中科院微生物所,编号LC068714Colletotrichum dematium吉祥草Reineckia carnea 中科院微生物所,编号LC100415Colletotrichum destructivum黄花白芨Bletilla ochracea中科院微生物所,编号LC232917Colletotrichum duyunensis黄花白芨Bletilla ochracea中科院微生物所,编号LC230718Colletotrichum endophytum黄花白芨Bletilla ochracea中科院微生物所,编号LC231819Colletotrichum excelsum-altitudum黄花白芨Bletilla ochracea中科院微生物所,编号LC234420Colletotrichum fioriniae细叶香桂Cinnamomum chingii Metcalf中科院微生物所,编号LC068921Colletotrichum fragariae中科院微生物所,编号LC057622Colletotrichum fructicola野茶树Camellia sinensis中科院微生物所,编号LC629823Colletotrichum gloeosporioides柑橘Citrus reticulata Blanco中科院微生物所,编号LC697624Colletotrichum grossum辣椒Capsicum annuum中科院微生物所,编号LC622725Colletotrichum guizhouensis黄花白芨Bletilla ochracea中科院微生物所,编号LC230526Colletotrichum hemerocallidis萱草Hemerocallis fulva (L.) L.中科院微生物所,编号LC056027Colletotrichum henanensis野茶树Camellia sinensis中科院微生物所,编号LC303028Colletotrichum higginsianum中科院微生物所,编号LC759529Colletotrichum horii刨花楠Machilus pauhoi中科院微生物所,编号LC071930Colletotrichum hymenocallidis中科院微生物所,编号LC003931Colletotrichum jasmini-sambac芒果Mangifera sp.中科院微生物所,编号LC015532Colletotrichum jiangxiense野茶树Camellia sinensis中科院微生物所,编号LC346033Colletotrichum kahawae芭蕉Musa basjoo中科院微生物所,编号LC706234Colletotrichum karstii野茶树Camellia sinensis中科院微生物所,编号LC357036Colletotrichum liriopes黄花白芨Bletilla ochracea中科院微生物所,编号LC235137Colletotrichum musae中科院微生物所,编号LC0084
续表1 供试菌株
Table 1 The strain used in this study
序号NO菌株 Strain 寄主 Strain 菌种来源 Source38Colletotrichum ochracea黄花白芨Bletilla ochracea中科院微生物所,编号LC230339Colletotrichum orchidearum中科院微生物所,编号LC004040Colletotrichum parsonsiae黄花白芨Bletilla ochracea中科院微生物所,编号LC234342Colletotrichum siamense油茶Camellia oleifera中科院微生物所,编号LC296943Colletotrichum spaethianum草grass中科院微生物所,编号LC281544Colletotrichum thailandicum咖啡Coffea中科院微生物所,编号LC013945Colletotrichum tofieldiae黄花白芨Bletilla ochracea中科院微生物所,编号LC233646Cryptosporiopsis californiae中科院微生物所,编号LC492347Monochaetia kansensis中科院微生物所,编号LC163748Pestalotiopsis sp.山茶Camellia中科院微生物所,编号LC292949Hainesia lythri红树 Rhizophora apiculata Bl.中国普通微生物菌种保藏管理中心,编号3.904250Ascochytopsis vignae元宝槭 Acer truncatum Bunge中国普通微生物菌种保藏管理中心,编号3.1212151Pestalotia theae Saw茶叶Tea中国农业微生物菌种保藏管理中心,编号ACCC 36934
主要仪器有:Retsch MM400研磨仪,Hitachi高速离心机,ND1000核酸检测仪,ABI梯度PCR仪,TY-C型多功能电泳仪,通用凝胶成像系统(Intas Gel Jet Imagery)。实验所用PCR 试剂、核酸提取试剂盒等均购于天根生化科技(北京)有限公司;引物由上海生工生物技术有限公司合成。
1.2 方 法
1.2.1 菌丝体的收集及供试菌株基因组DNA的提取
供试菌株在PDA培养基上25℃黑暗条件下培养7 d。用无菌刀片刮取PDA平板上适量菌丝放入2 mL离心管中,离心管内放入直径0.5 cm的钢珠,盖上离心管盖子放入液氮中5 min后取出,立刻将液氮冷冻过的离心管装在预冷过的研磨盒里并放在研磨仪上研磨30 s,将钢珠倒出,按照北京天根生化科技有限公司新型植物基因组DNA提取试剂盒(DP305-03)说明书提取菌株基因组DNA。提取的DNA置于-20℃冰箱保存备用。
1.2.2 特异性引物设计与PCR扩增
刺盘孢属真菌的ITS基因序列参考Cannon、Damm、Weir等[10-14],刺盘孢属近似属真菌的ITS基因登录号为MG828 958、JN871 203、JN871 199、MG828 961、MG386 033、FJ430 600、KC005 785、DQ278 919、DQ278 918、HM535 736、KX721 589、AF377 286、KM979 722、KC345 693、JN542 546、KY464 140、AY620 998、HQ339 998、KT268 764、EF413 595、GU973 504、KY814 539、HQ874 466、EU707 430、DQ323 542、EU167 609、DQ323 528、KU143 712、EU622 267、KR476 746、MF190 121、JN943 495、AY739 018、JN943 491、KT001 450,所有基因序列均从Gen Bank下载。用DNAMAN软件对刺盘孢属及刺盘孢属近似属的ITS序列进行同源性比对,根据序列比对结果,选取序列属间有差异位点的区域,利用Primer5 软件设计刺盘孢属特异性引物并合成。
用设计的引物对刺盘孢属菌株基因组DNA进行PCR扩增,扩增体系为25L,包括10×TaqBuffer 2.5L,2.5 mmol/L dNTP 2L,2.5 U/LTaqDNA酶0.2L,上下游引物(10mol/L)各0.5L,模板DNA 1L,ddH2O 18.3L。反应程序为:94℃预变性3 min;94℃变性30 s,60℃退火30 s,72℃延伸1 min,35个循环;72℃延伸10 min。反应结束后取5L PCR产物在1.2%的琼脂糖凝胶上电泳30 min(1×TAE电泳缓冲液,GeneGreen核酸染料染色,110V 电压),在凝胶成像系统上检测并拍照。
1.2.3 引物特异性验证
用设计的引物对序号为46~51号的刺盘孢属近似属真菌菌株进行PCR扩增,扩增条件及检测拍照同1.3,由检测结果分析设计的引物扩增刺盘孢属的特异性。
1.2.4 引物灵敏度检测
用核酸检测仪测定菌株的基因组DNA浓度,以序号15号的Colletotrichumdestructivum菌株的DNA为模板,用灭菌的超纯水将其DNA(起始DNA浓度为2.2 ng/L)按10倍梯度稀释到100、10-1、10-2、10-3、10-4、10-5、10-6、10-7g /L,以不同浓度的DNA分别进行PCR反应,其反应体系和程序同1.4。反应结束后取5L PCR产物在1.2%的琼脂糖凝胶上电泳30 min(1×TAE电泳缓冲液,GeneGreen核酸染料染色,110V 电压),在凝胶成像系统上检测并拍照。
1.2.5 样品检测
对采集的带炭疽病梨果实、健康梨果实、人工接种刺盘孢属病原菌的梨果实样品进行检测。其中对带炭疽病梨果实样品分别取发病处的植物组织与发病周边的植物组织,人工接种刺盘孢属病原菌的梨果实取有病变症状处的植物组织,健康样品取健康组织,研磨后用天根新型植物基因组DNA提取试剂盒(DP305-03)提取DNA,用设计的引物按照1.3的扩增体系及程序对提取的DNA进行PCR扩增,产物在1.2%琼脂糖凝胶上电泳检测。
2 结果与分析
2.1 特异性引物设计及PCR扩增
利用DNAMAN软件对刺盘孢属及刺盘孢属近似属真菌的ITS基因序列进行比对,找到刺盘孢属内保守的区域,属间有明显差异的区域,用软件Primer5对刺盘孢属特异性区域设计得到扩增其ITS基因的特异性引物:ITS-c3:5'-GAGTTWMCGCTCTAYAACCCT-3',ITS-c4:5'-CTCCGGATCCCAGTGCGAGA-3',产物大小449 bp。
用设计的引物ITS-c3/c4对序号1~45号的刺盘孢属菌株进行PCR扩增(图1A,B),特异性引物ITS-c3/c4从40株不同种的刺盘孢属菌株DNA中扩增得了到449 bp的条带,条带明亮单一,说明引物ITS-c3/c4能够扩增不同种的刺盘孢属真菌ITS基因序列。图1

A、B:刺盘孢属PCR扩增电泳。A图中,M:DL2000 Marker;1~24:菌株1~27号。B图中,M:DL2000 Marker;1~16:菌株28~45号。17:阴性对照。菌株序号见表1
A、B:PCR amplified electrophoresis ofColletotrichum. In Fig A, M:DL2000 Marker; 1-24: Strain 1-27. In Fig B,M: DL2000 Marker; 1-16: Strain 28-45. 17:Negative control. The Sequenceno of strains is shown in
Table 1
图1 刺盘孢属真菌PCR扩增产物电泳图谱
Fig. 1 PCR amplified products electrophoresis ofcolletotrichum
2.2 引物特异性验证
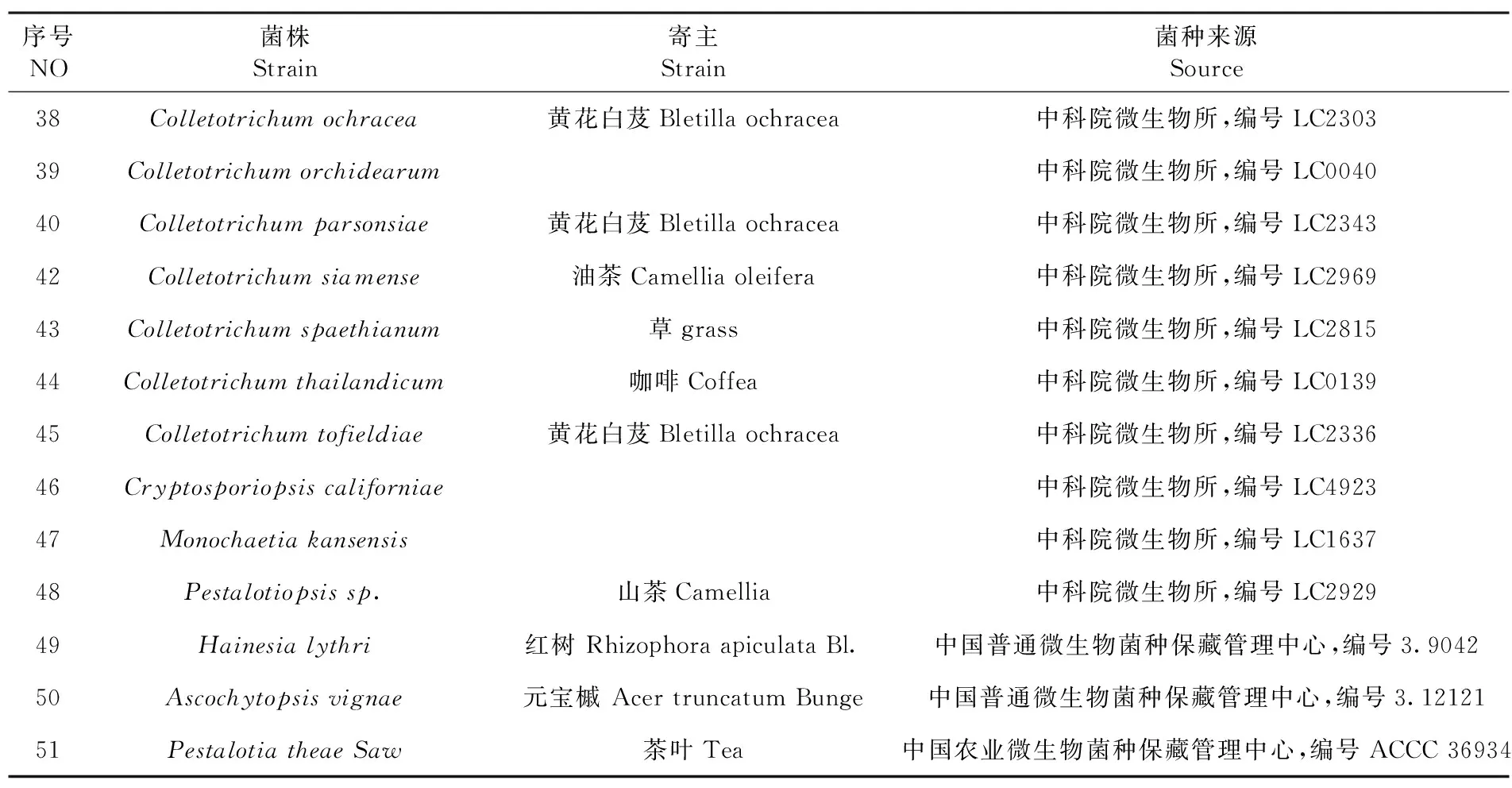
用设计的引物ITS-c3/c4对序号为46~51号的刺盘孢属近似属真菌菌株进行PCR扩增,选取1、23、33号刺盘孢属菌株做阳性对照,以灭菌超纯水做阴性对照。从图中可看出第1~6电泳带的刺盘孢属近似属未有扩增条带,而第7~9电泳带上的刺盘孢属菌株扩增到449 bp的条带,第10条电泳带的阴性对照也未有扩增出条带,说明设计的引物对检测刺盘孢属真菌具有特异性。图2

M:DL2000 Marker;1~6:菌株46~51;7:菌株1;8:菌株23,9:菌株33;10:阴性对照。菌株序号见表1
M:DL2000 Marker; 1-6: Strain 46-51; 7: Strain 1; 8: Strain 23; 9: Strain 33 ; 10:Negative control .The Sequenceno of strains is shown in
Table 1
图2 引物特异性验证
Fig. 2 Primer Specificity Verification
2.3 引物灵敏度检测
以不同浓度的Colletotrichumdestructivum菌株的DNA为模板进行PCR检测,到第4个浓度(2.2 pg/L)梯度时,扩增到的条带依然较亮,到第5个浓度(0.22 pg/L)梯度时,扩增到的条带则明显变暗,但依然有条带,说明该对引物具有较高的灵敏度。图3
2.4 样品检测
用设计的引物对采集的带炭疽病梨果实的发病处与发病周边组织、健康的梨果实、人工接种刺盘孢属病原菌的梨果实样品进行检测,以刺盘孢属Colletotrichumgloeosporioides菌株为阳性对照,灭菌的超纯水为阴性对照进行PCR扩增。图中阴性对照未扩增出条带,阳性对照扩增出条带,说明扩增体系正常。其中第1至4电泳带的带炭疽病梨果实样品都扩增出与阳性对照片段大小一致的条带,第7、8电泳带的人工接种刺盘孢属病原菌的梨果实样品也扩增到了条带,而健康的梨果实样品中未扩增到条带,说明引物ITS-c3/c4能够特异性检测出炭疽病发病组织中的刺盘孢属病原菌。图4
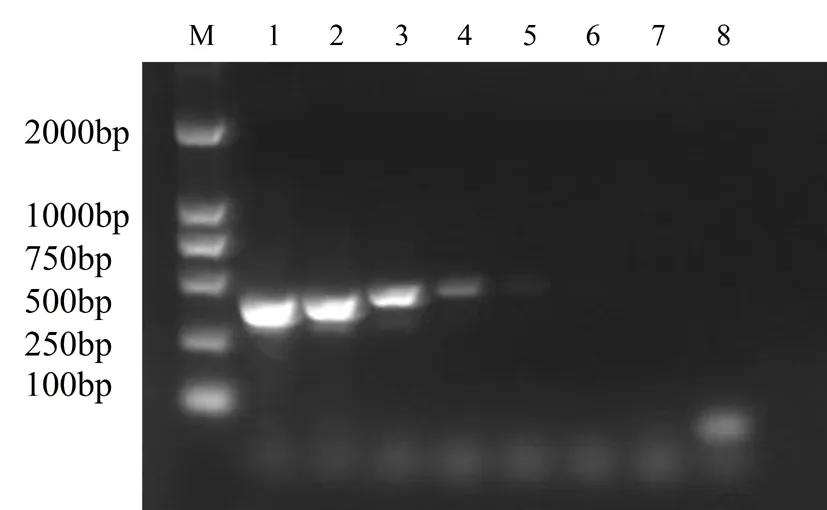
M:DL2000 Marker;1~9:Colletotrichumdestructivum菌株的DNA浓度稀释到100、10-1、10-2、10-3、10-4、10-5、10-6、10-7后PCR扩增电泳
M:DL2000 Marker; 1-9: PCR amplified electrophoresis of DNA concentrations withColletotrichumdestructivumto 00、10-1、10-2、10-3、10-4、10-5、10-6、10-7
图3 刺盘孢属PCR灵敏度检测
Fig. 3 PCR sensitivity detection ofColletotrichum
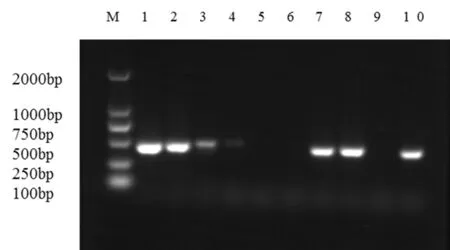
M:DL2000 Marker;1~2:带炭疽病梨果实发病处组织;3~4:带炭疽病梨果实发病周边处组织;5~6:健康的梨果实;7~8:人工接种刺盘孢属病原菌的梨果实;9:阴性对照;10:阳性对照
M:DL2000 Marker; 1-2: Tissue of the diseased pear fruit with anthracnose; 3-4:Peripheral Tissue of Pear Fruit with Anthracnose; 5-6: Healthy pear fruit; 7-8:Artificial inoculation of pear fruits; 9: Negative control; 10; Positive control
图4 用设计的引物对样品检测
Fig. 4 Sample Detection with Designed Primers
3 讨 论
实验用设计的引物对40株不同种的刺盘孢属菌株进行PCR扩增检测,均能得到一条明亮的、目的片段大小的条带,说明该对引物对刺盘孢属属内的种都能检测到。在设计引物找寻ITS基因序列刺盘孢属及其近似属属间有差异的片段时,由于在NCBI上并非所有的近似属都有ITS基因序列提交,因此,在对属间ITS基因序列比对时,只选取了有序列提交的近似属ITS基因序列作为比对,并选取差异区域设计引物;在验证刺盘孢属引物特异性时,由于近似属菌株资源受限,只对5个近似属的6株菌株进行了验证,验证结果为该引物具有较强的特异性,只能扩增刺盘孢属,其它近似属未能扩增到条带。用设计的引物对炭疽病发病样品及人工接种刺盘孢属病原菌样品进行检测,均可从发病组织中检测出刺盘孢属真菌。
实验在设计刺盘孢属特异性引物时,选取的是属内保守区域,因此,ITS-c3/c4该对引物只能检测到属,对属以下的种不能鉴定;通过对刺盘孢属内菌株的ITS基因序列比对发现,靠ITS一个基因是很难完全对种间进行检测鉴定的,需要考虑多个基因同时检测。研究能通过PCR方法快速的将病原菌鉴定到属,为今后该属真菌的分类鉴定研究奠定科学基础。
4 结 论
对刺盘孢属及其近似属的ITS基因序列进行比对,针对刺盘孢属特异性位点设计出常规PCR检测刺盘孢属的特异性引物ITS-c3/c4,引物序列为:ITS-c3:5'-GAGTTWMCGCTCTAYAACCCT-3',ITS-c4:5'-CTCCGGATCCCAGTGCGAGA-3';用该对引物对40株不同种刺盘孢属菌株PCR扩增,均扩增得到449 bp条带;通过对该对引物特异性验证,6株刺盘孢属近似属菌株均未扩增到条带;对该引物灵敏度进行检测,其灵敏度达2.2 pg/L;用建立的体系对炭疽病发病样品及人工接种样品检测,均可从发病组织中检测出刺盘孢属病原菌;建立了刺盘孢属真菌PCR检测体系。建立的PCR方法可靠,可将刺盘孢属与近似属区分开,能够快速、准确检测出刺盘孢属真菌。

