替莫唑胺联合氟桂利嗪对胶质瘤细胞体外作用机制
卢家潮 寿记新 李龙龙 王冰冰
【摘要】 目的:探讨替莫唑胺(TMZ)联合氟桂利嗪(FZ)对人脑胶质瘤细胞体外清除作用及可能机制。方法:用伊格尔培养基培养胶质瘤U87、U251、CHG-5、SHG-44细胞株,用CCK-8试剂检测并评价TMZ、FZ两者单药及联合用药处理后的U87、U251、CHG-5、SHG-44细胞增殖抑制率及观察TMZ的半数抑制浓度(IC50);流式细胞仪检测细胞凋亡。结果:FZ单独处理胶质瘤细胞株后能起到一定的抑制作用,而远远起不到治疗效果;在同类细胞中,TMZ单药作用细胞株后IC50分别为(562.3±56.7)、(370.5±40.2)、(480.9±29.6)、(420.5±61.4)μg/mL。在不同浓度的FZ联合TMZ应用后TMZ IC50均有不同程度下降(P<0.05);与对照组、替莫唑胺、氟桂利嗪单药作用组比较,TMZ联合FZ用药诱导胶质瘤细胞凋亡率显著提高。结论:FZ可抑制胶质瘤U87、U251、CHG-5、SHG-4增殖,与TMZ联合应用后能提高化疗效果。
【关键词】 替莫唑胺; 氟桂利嗪; 胶质瘤
【Abstract】 Objective:To investigate the effect of Temozolomide(TMZ)combined with Flunarizine(FZ)on glioma cell lines in vitro.Method:The glioma U87,U251,CHG-5 and SHG-44 cell lines were cultured in Eagles medium,Cell Counting Kit-8(CCK-8)assay was used to evaluate the cell proliferation in glioma cell lines which treated with TMZ combined with FZ either alone or in combination.Result:FZ inhibited the proliferation of glioma cell lines,but it was far less therapeutic effect.In the same kind of cells,the 50% inhibitory concentration(IC50)of FZ in cell lines U87,U251,CHG-5,SHG-44 were(562.3±56.7),(370.5±40.2),(480.9±29.6),(420.5±61.4)μg/mL.The IC50 of TMZ was significantly decreased after different concentrations of FZ combined with TMZ(P<0.05).Compared with the control group,TMZ and FZ monotherapy group,the apoptotic rate of TMZ combined with FZ induced a significant increase of glioma cells.Conclusion:FZ could inhibit the proliferation of glioma U87,U251,CHG-5 and SHG-4,and it could improve the chemotherapy effect when combined with TMZ.
【Key words】 Temozolomide; Flunarizine; Glioma
First-authors address:The Fifth Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China
doi:10.3969/j.issn.1674-4985.2019.03.002
神經胶质瘤是人类中枢神经系统中最常见的原发性肿瘤,占恶性脑瘤的81%,影响胶质瘤发病的因素较多,如基因突变、电离辐射等[1],最新的权威报道,胶质瘤发病率(1~5)/10万,超过3年的生存率仅5%[2]。约50%胶质瘤患者存在癫痫风险,氟桂利嗪(Flunarizine,FZ)为双氟化哌啶衍生物,是强效的钙通道拮抗剂,临床上常用的抗癫痫药物之一[3]。替莫唑胺(Temozolomide,TMZ)是一种口服的烷基化广谱抗肿瘤药物,通过DNA上的鸟嘌呤在O-6或N-7位上诱导DNA烷基化,致使肿瘤细胞凋亡[4],其作为临床上一线的抗肿瘤药物,能明显延长胶质瘤患者生存期,但Chio等[5]研究发现,长期使用替莫唑胺作用于胶质瘤细胞会使其产生耐药性,临床上同样见有类似报道[6]。如何提高胶质瘤细胞对TMZ的敏感性,增强抗肿瘤作用已经成为目前研究热点,而关于TMZ与FZ联合应用对U87、U251、CHG-5、SHG-44细胞株的影响目前尚未见相关报道。本研究拟探讨体外FZ能否增加胶质瘤细胞对TMZ的敏感性、增强TMZ对肿瘤细胞的杀伤作用,为临床治疗胶质瘤患者提供相关的理论依据。
1 材料与方法
1.1 试剂和仪器 流式细胞仪(BD calibur)、酶联免疫检测仪(上海基因科技有限公司)、胎牛血清(Gibco)、Eagle培养基(DMEM)(Hyclone公司)、0.25%胰酶(杭州四季青生物科技有限公司)、超净工作台(美国贝克曼公司)、CO2恒温培养箱(Cell Signaling公司)、TMZ(天士力公司)、FZ(西安杨森制药有限公司)、Annexin V-FITC细胞凋亡检测试剂盒(上海碧云天生物技术有限公司)、CCK-8溶液(cell counting kit-8,Dojindo)。
1.2 细胞培养 胶质瘤U87、U251、CHG-5、SHG-44细胞株购自中科院上海细胞库,于含10%胎牛血清、1%青链霉素的DMEM的高糖培养基,在室温下5%CO2的孵育箱培养。取对数生长期细胞且活性>95%用于实验。
1.3 方法
1.3.1 细胞抗增殖试验 取对数生长期的U87、U251、CHG-5、SHG-44细胞悬液接种于96孔板,每孔3 000个,预先置于37 ℃,5%CO2饱和湿度的培养箱内培养,使细胞贴壁生长并长满孔底。24 h后将各浓度药物10 μL加入培养孔,每浓度药物设4个复孔,空白组(无细胞、试剂)4个复孔,对照组(只有等量溶剂)4个复孔。各药液细胞培养孔的FZ、TMZ、FZ+TMZ浓度分别为FZ(5、10、20、40、80 μg/mL),TMZ(50、100、200、400、800 μg/mL),继续培养24 h后每孔加10 μL的CCK-8溶液,孵育2 h在酶联免疫检测仪450 nm处检测光吸收值(optical density,OD值),然后计算不同浓度的增殖抑制率。以上实验均重复3次取均值计算增殖抑制率和联合用药后TMZ的IC50,
1.3.2 流式细胞术检测细胞凋亡率 取同步培养的对数生长期U87、U251、CHG-5、SHG-44细胞加入对照组以及用DMSO配置的FZ、TMZ、FZ+TMZ(FZ终浓度为10、20、40 μg/mL,TMZ的终浓度为100、200、400 μg/mL),每组药物设3个复孔,按照凋亡试剂盒的说明进行操作后经流式细胞仪检测。
1.4 统计学处理 采用SPSS 21.0软件对所得数据进行统计分析,计量资料用(x±s)表示,多组间比较采用方差分析,两两比较采用Students t检验。以P<0.05为差异有统计学意义。
2 结果
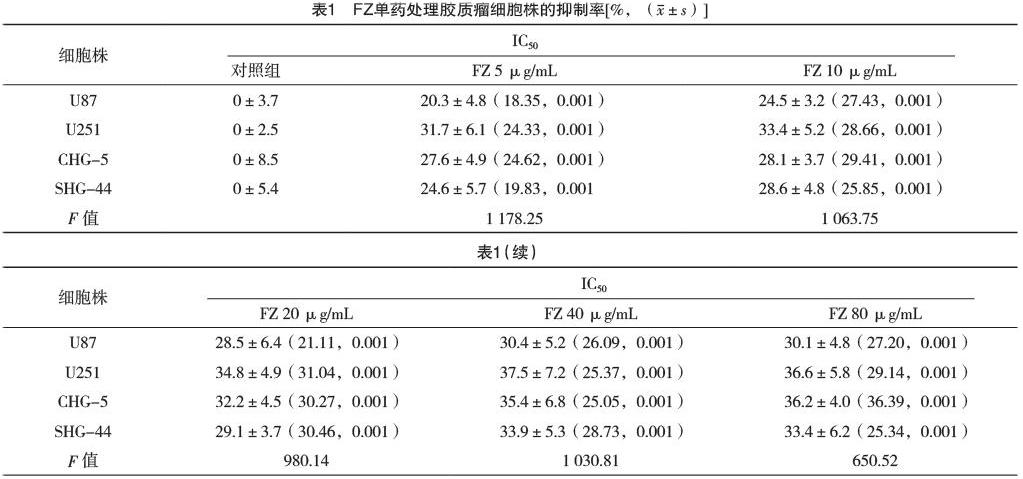
2.1 FZ、TMZ单药作用于U87、U251、CHG-5、SHG-44细胞的增殖抑制率比较 FZ单药对胶质瘤细胞有一定的抑制作用,但达不到治疗效果,见表1。
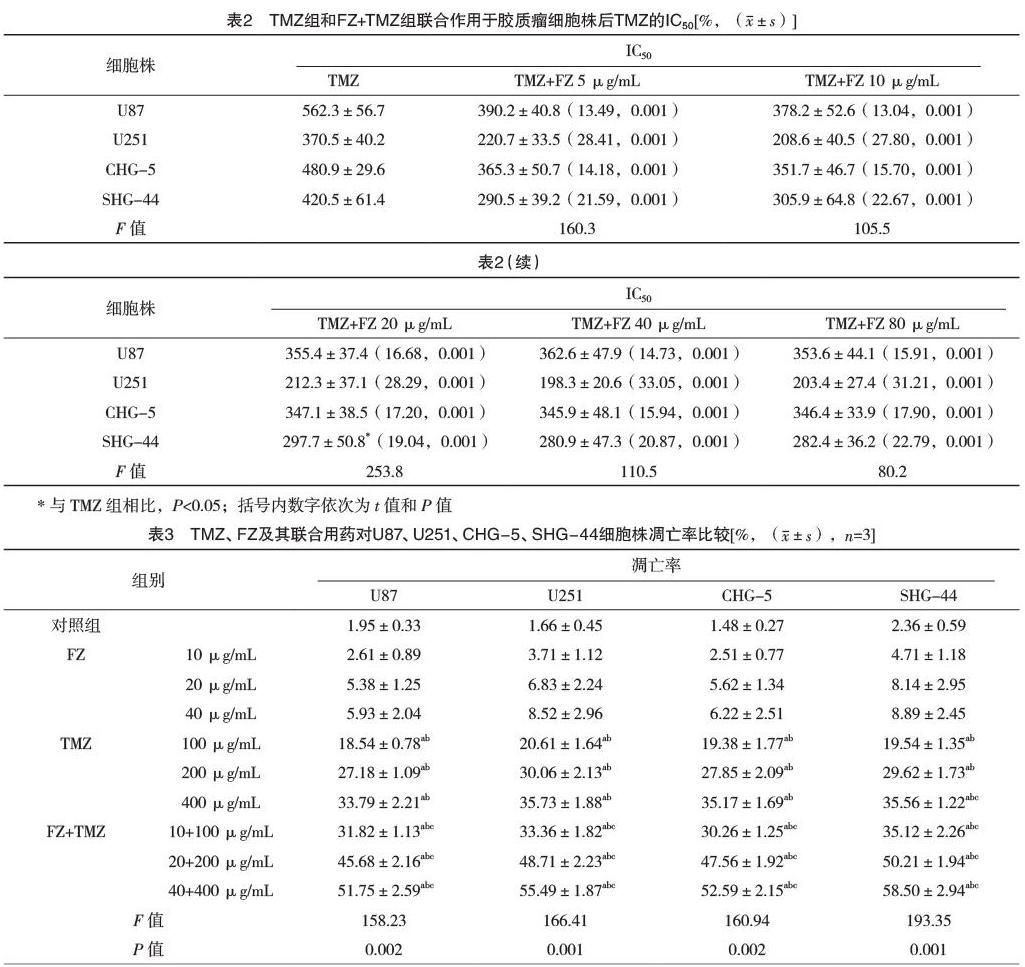
2.2 FZ与TMZ联合用药对胶质瘤细胞株的增殖抑制作用 联合处理后TMZ的IC50均有不同程度的下降,差异有统计学意义(P<0.05),见表2。
2.3 TMZ、FZ及其联合用药对U87、U251、CHG-5、SHG-44细胞株凋亡率比较 对照组与各浓度药物FZ、TMZ、FZ+TMZ培养至24 h后,对U87、U251、CHG-5、SHG-44细胞的凋亡率比较,差异有统计学意义(P<0.05),见表3。
3 讨论
原发性膠质瘤难以根治的原因主要是其具有丰富的血供、高度的浸润性及肿瘤边界不清等特点[7-8],手术切除是目前治疗胶质瘤的第一选择方案,但由于肿瘤切除不完全,胶质瘤患者复发率极高,预后效果欠佳,严重危害患者生活质量及生命健康[9]。改进治疗方案及策略,提高胶质瘤患者生存期和生活质量是临床工作者亟待解决的问题。临床大样本数据证实,恶性胶质瘤患者行手术+放疗+化疗,目前已达成共识[10]。而Fisher等[11]在肿瘤放射治疗试验(RTOG)0424组证实,手术后行放疗+TMZ化疗较单纯行术后放疗,中位生存时间(MST)从40.5个月提高到57.9个月,提高率为43%,三年总体生存率(OS)从54%提高到65%。TMZ早在1980年被合成,且易于通过血脑屏障,目前成熟应用于临床一线的化疗药[12],不少学者报道,原发性或复发性胶质瘤术后患者初次口服TMZ获得良好效果,但不少患者逐步产生耐药性[13-14],因此研究胶质瘤细胞对TMZ的治疗增敏,有望提高胶质瘤术后患者的治疗效果。FZ是一种非选择性的能阻断T型和L型Ca离子通道阻断剂,普遍应用于胶质瘤伴随癫痫发作患者[15]。Lee等[16]曾应用10余种抗癫痫药作用于胶质瘤U87、T98G细胞株,发现所研究的抗癫痫药对胶质瘤细胞均有一定的抑制作用(没有一种能达到杀灭肿瘤细胞的作用),其中以奥卡西平和丙戊酸钠抑制作用显著,但两者的抑制作用浓度远远超过临床以预防、控制癫痫发作所需要的药物浓度,因此该剂量药物并不能作为抗肿瘤药物来推广使用。Schmeel等[17]在研究多发性骨髓瘤时发现,无翼相关整合位点(WNT)通路在淋巴瘤和骨髓瘤组织细胞中异常活跃,而FZ的化学特性与已知的WNT通路抑制剂相似,在白血病细胞中具有促凋亡作用。Koller等[18]使用三种WNT抑制剂作用于肾癌细胞,结果发现肾癌细胞长时间处于生长停滞状态,该抑制剂能抑制癌细胞内谷胱甘肽-s-转移酶(GST),导致癌细胞内谷胱甘肽水平升高,氧化应激进一步增强导致细胞死亡,文献[19-21]认为WNT通路抑制剂能增敏抗肿瘤药物的细胞毒作用。Perin等[22]研究表明,FZ与常用化疗药物联用时,FZ对肿瘤细胞膜的分裂融合有明显的抑制作用,同时能增强化疗药物的药物敏感性,不受动物组不同肿瘤的影响,化疗效果显著增强。
本研究发现,FZ与TMZ联合用药作用于U87、U251、CHG-5、SHG-44细胞株可以显著降低TMZ的IC50,即FZ能起到增敏TMZ的作用,FZ单药作用于该细胞,只能起到一定的增殖抑制作用,但达不到杀灭肿瘤细胞的效果,这可能是由于FZ作为WTN通路的一种抑制剂,能抑制胶质瘤细胞内谷胱甘肽-s-转移酶活性,致使谷胱甘肽的蛋白水平高升高,从而增敏TMZ的抗肿瘤作用,这与Koller等[18]研究结果类似。
综上所述,FZ作为一种临床常用的抗癫痫药,对胶质瘤细胞有一定生长抑制作用,但达不到细胞毒效应,在胶质瘤细胞中能增敏TMZ的抗肿瘤作用,因此,临床上推荐胶质瘤术后患者应用TMZ化疗的同时应用FZ是一个不错的治疗方案,既起到预防/治疗癫痫的作用,又能提高TMZ的治疗效果。但其复杂的联合应用机制,有待进一步研究。
參考文献
[1] Hu J,Shi B,Liu X,et al.The activation of Toll-like receptor 4 reverses tumor differentiation in human glioma U251 cells via Notch pathway[J].Int Immunopharmacol,2018,64:33-41.
[2] Torres-Bayona S,Aldaz P,Auzmendi-Iriarte J,et al.PR-LncRNA signature regulates glioma cell activity through expression of SOX factors[J].Sci Rep,2018,8(1):12746.
[3] Sendrowski K,Rusak M,Sobaniec P,et al.Study of the protective effect of calcium channel blockers against neuronal damage induced by glutamate in cultured hippocampal neurons[J].Pharmacol Rep,2013,65(3):730-736.
[4] Di M A,Sedlarik V,et al.Amphiphilic chitosan-grafted-functionalized polylactic acid based nanoparticles as a delivery system for doxorubicin and temozolomide co-therapy[J].Int J Pharm,2014,474(1-2):134-145.
[5] Chio C C,Chen K Y,Chang C K,et al.Improved effects of honokiol on temozolomide-induced autophagy and apoptosis of drug-sensitive and -tolerant glioma cells[J].BMC Cancer,2018,18(1):379.
[6] Reyes-Botero G,Cartalat-Carel S,Chinot O L,et al.Temozolomide Plus Bevacizumab in Elderly Patients with Newly Diagnosed Glioblastoma and Poor Performance Status:An ANOCEF Phase Ⅱ Trial(ATAG)[J].Oncologist,2018,23(5):524-e44.
[7] Bai Y H,Zhan Y B,Yu B,et al.A Novel Tumor-Suppressor,CDH18,Inhibits Glioma Cell Invasiveness Via UQCRC2 and Correlates with the Prognosis of Glioma Patients[J].Cell Physiol Biochem,2018,48(4):1755-1770.
[8] Alfonso J C L,Talkenberger K,Seifert M,et al.The biology and mathematical modelling of glioma invasion:a review[J].J R Soc Interface,2017,14(136):pii20170490.
[9] Guan X,Zhang C,Zhao J,et al.CMTM6 overexpression is associated with molecular and clinical characteristics of malignancy and predicts poor prognosis in gliomas[J].EBioMedicine,2018,35:233-243.
[10] Gupta M,Bansal S,Pruthi D S,et al.Prognostic Factors in Elderly Patients with High-grade Gliomas:A Retrospective Analysis of 24 Cases[J].J Neurosci Rural Pract,2018,9(3):312-316.
[11] Fisher B J,Hu C,Macdonald D R,et al.Phase 2 study of temozolomide-based chemoradiation therapy for high-risk low-grade gliomas:preliminary results of Radiation Therapy Oncology Group 0424[J].Int J Radiat Oncol Biol Phys,2015,91(3):497-504.
[12] Cousin D,Hummersone M G,Bradshaw T D,et al.Synthesis and growth-inhibitory activities of imidazo[5,1-d]-1,2,3,5-tetrazine-8-carboxamides related to the anti-tumour drug temozolomide,with appended silicon,benzyl and heteromethyl groups at the 3-position[J].Medchemcomm,2018,9(3):545-553.
[13] St-Coeur P D,Touaibia M,Cuperlovic-Culf M,et al.Leveraging metabolomics to assess the next generation of temozolomide-based therapeutic approaches for glioblastomas[J].Genomics Proteomics Bioinformatics,2013,11(4):199-206.
[14] Cheng L,Bao S,Rich J N,et al.Potential therapeutic implications of cancer stem cells in glioblastoma[J].Biochem Pharmacol,2010,80(5):654-665.
[15] Gulati P,Muthuraman A,Kaur P,et al.Investigation of the role of non-selective calcium channel blocker(flunarizine)on cerebral ischemic-reperfusion associated cognitive dysfunction in aged mice[J].Pharmacol Biochem Behav,2015,131:26-32.
[16] Lee C Y,Lai H Y,Chiu A,et al.The effects of antiepileptic drugs on the growth of glioblastoma cell lines[J].J Neurooncol,2016,127(3):445-453.
[17] Schmeel L C,Schmeel F C,Kim Y,et al.Flunarizine exhibits in vitro efficacy against lymphoma and multiple myeloma cells[J].Anticancer Res,2015,35(3):1369-1376.
[18] Koller C M,Kim Y,Schmidt-Wolf I G,et al.Targeting renal cancer with a combination of WNT inhibitors and a bi-functional peptide[J].Anticancer Res,2013,33(6):2435-2440.
[19] Mohhammed M K,Shao C,Wang J,et al.Wnt/β-catenin signaling plays an ever-expanding role in stem cell self-renewal,tumorigenesis and cancer chemoresistance[J].Genes & Diseases,2016,3(1):11-40.
[20] Katoh M,Katoh M.Molecular genetics and targeted therapy of WNT-related human diseases(Review)[J].International Journal of Molecular Medicine,2017,40(3):587-606.
[21] Yang K,Wang X,Zhang H,et al.The evolving roles of canonical WNT signaling in stem cells and tumorigenesis:Implications in targeted cancer therapies[J].Lab Invest,2016,96(2):116-136.
[22] Perin P M,Haid S,Brown R J,et al.Flunarizine Prevents Hepatitis C Virus Membrane Fusion in a Genotype-dependent Manner by Targeting the Potential Fusion Peptide within E1[J].Hepatology,2016,63(1):49-62.
(收稿日期:2018-11-02) (本文編辑:程旭然)

