两种方法制备猪小肠黏膜下层重建SD大鼠前交叉韧带力学对比研究
陈飚
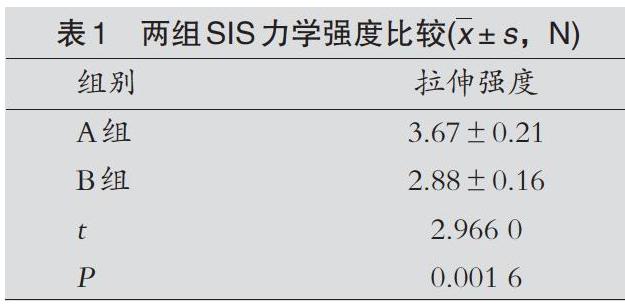
摘要目的:比较两种方法制作的猪小肠黏膜下层的力学性能。方法:用物理及化学方法处理猪小肠黏膜下层,并分别用编织(A组)和轴卷(B组)两种方法制備。移植重建SD大鼠前交叉韧带,3个月后应用试验机对两组不同方法制作的猪小肠黏膜下层进行力学性能检测。结果:A组最大拉伸强度明显强于B组,差异有统计学意义(1=2.9660,P<0.05)。结论:编织猪小肠黏膜下层的抗拉强度大于轴卷组。
关键词 小肠黏膜下层;重建;前交叉韧带;力学;对比研究
小肠黏膜下层(SIS)是天然不含细胞的细胞外基质类材料,在组织工程的支架材料领域有较多成功应用经验1-1。它是从猪小肠中提取出来的一种生物活性膜,具有多功能、多分化而且容易分离等特点,厚度仅0.1mm,主要成分为细胞外基质,主要由胶原和水构成1-。其作为生物工程材料已广泛应用,但其力学强度仍存在一定差异。本实验通过两种不同方法制作猪SIS(编织和轴卷),并测试两者力学性能,以寻找一种增加其强度的制作方法。
资料与方法
材料与分组:取新鲜猪小肠若干,通过以下方法制取SIS,并对其进行分组,A组为编织组,B组为轴卷组。每组选取20个标本进行力学性能检测。
方法:①SIS制备:取新鲜猪小肠,自十二指肠远端10cm起取100cm长,按每段10cm进行横行切断,纵向剖开小肠,使浆膜层置于0.9%氯化钠溶液浸湿的纱布上,黏膜层朝上。用纱布包裹手术刀柄,刮除小肠表面黏膜层,边刮除边用0.9%氯化钠溶液进行冲洗,见该面为乳白色半透明基膜样组织时将小肠翻转;同样方法刮除小肠肌层和浆膜层,同样边刮除边冲洗,全部刮除干净后将SIS放置于0.9%氯化钠溶液中清洗后以化学方法处理其残留的其他细胞组织。将以上已用物理方法处理后的SIS用Abraham法进行化学处理",将SIS置于含EDTA100mmol/L和NaOH10mmol/L的混合溶液,pH=11,浸泡16h。取出后用去离子水冲洗干净,置于含HCl和NaCl的混合溶液(pH=0.5)中,浓度均为1mmol/L,浸泡6~8h。取出后同样采用去离子水冲洗干净,置于含NaCl1mmol/L的PBS中浸泡16h。取出后以去离子水冲洗干净,在PBS(pH=7.4)中浸泡2h。取出后用去离子水冲洗。杀菌:SIS在含1%过氧乙酸的体积分数20%乙醇溶液中浸泡8h,用含0.05%叠氮化钠的PBS清洗2h。程序性降温到一80C,冻干后真空包装。以"Coγ射线25~35kGy照射消毒。残留细胞计数:分别对上述经物理和化学处理后的SIS取多个样本,在光学显微镜下进行残留细胞计数。将每块SIS膜沿小肠纵轴方向对半剪开,一半沿小肠横轴轴卷,卷成圆柱状,直径约2mm,其终末外缘用11-0缝线间断缝合固定,防止其松散,即B组(轴卷组)SIS制作完成;A组(编织组)制作方法:将剩余一半小肠SIS膜进行对折2~3次,将4个角稍固定,由小肠尾侧向头侧均等做3等份剪开,头侧保留约5mm,将剪后形成的3束SIS膜进行编织,末端用11-0缝线缝合固定。②重建韧带及力学检测:选取20只SD大鼠双侧后肢膝关节,左侧采用编织组(A组)进行重建;右腿采用轴卷组(B组)重建前交叉韧带,使用氯胺酮按20~25mg/kg剂量进行腹腔注射麻醉,麻醉满意后双后肢膝关节备皮、消毒,固定四肢及门齿,手术于膝关节正中行直切口,显露关节腔,采用直径2.0mm克氏针于胫骨与股骨前交叉韧带起、止点处做骨隧道,将带线导针穿入骨隧道,带线将各SIS牵引人骨隧道内,重建韧带,调节其张力,两头分别用缝线缝合于骨质上固定,清洗伤口,缝合、包扎。术后以小夹板固定后肢于伸直位。术后以每3d拆除小夹板,观察伤口愈合情况、有无感染,2周后拆线,3周后拆除小夹板,允许自由活动。3个月后注射空气处死大鼠,将双后肢离断,分离显露股骨和胫骨,祛除周围软组织,仅保留前交叉韧带使股骨和胫骨相连,采用岛津AG20KNA材料试验机对其进行力学测试,记录相应结果。
统计学方法:各组数据应用SPSS15.0软件处理,计量资料用(±)表示,采用1检验,P<0.05为差异有统计学意义。结果
动物大体情况:20只SD大鼠均成活,其中曾出现伤口红肿,但无化脓3只,经严密制动观察后红肿消退。伤口缝线大多2周时自行脱落,未脱落者予拆线处理。术后6~8周基本均可正常爬行,术后3个月爬行、奔跑与正常大鼠无明显异常。检查双后肢膝关节稳定性良好,无明显脱位或半脱位现象。处死大鼠,解剖大鼠见关节植人SIS于术后3个月时均与大鼠骨质愈合,其连续性良好,表面可见一层新生滑膜样组织。观察SIS,其内部为较致密纤维样组织。
SIS拉伸力学测试:SIS力学检测结果发现,A组最大拉伸强度明显强于B组,差异有统计学意义(1=2.9660,P<0.05),见表1。
讨论
SIS由猪SIS经去细胞、化学交联等处理制备而成,属天然细胞外基质类材料,其主要成分是胶原(含量>90%),有一定的机械强度,还含有一定的硫酸软骨素、透明质酸、纤维黏蛋白和多种细胞因子,因此无免疫原性,生物相容性好,具有一定的抗微生物活性和部位特异的组织再生能力回,是目前最有可能实现组织体内再生性修复的材料之一。作为异基因支架材料,在>1000种的跨种交叉移植实验中均表现无免疫原性”。本实验中动物术后情况未见明显排斥反应,仅3只大鼠曾出现伤口红肿,经制动观察后红肿渐渐消退。考虑为手术创伤后炎性反应,经制动休息后红肿症状消退。
研究发现,在羊动物模型上用SIS修复前交叉韧带图,SIS组无异基因临床表现,术后早期SIS组有混合炎性反应,SIS支架有巨细胞和淋巴细胞,后期消失,说明SIS可作为修复肌腱、前交叉韧带的良好的生物材料。其实验结果在术后3个月时与本实验结果基本相当,而A组结果其强度明显强于B组,说明通过编织方法可加强其拉伸强度,但对肢体膝关节整体稳定性与A组并无显著差异。本实验通过SIS对SD大鼠前交叉韧带重建,重建后SIS存在于骨与骨之间的距离仅仅约1cm长,若将其游离切断则无法进行下一步的力学测试,从而选择切取整个膝关节,将股骨与胫骨之间的连接组织切断,仅剩重建后的前交叉韧带,通过股骨与胫骨之间的拉伸来检测重建后SIS的力学强度,该方法科学、合理,所得结果可信,误差小。
近年来随着组织工程技术的不断发展,利用组织工程方法对前交叉韧带进行重建也逐渐成为新的研究热点,为前交叉韧带损伤的治疗提供了新途径!。目前研究的种子细胞有成纤维细胞、韧带细胞和骨髓间充质干细胞,成纤维细胞和韧带细胞因体外培养植入后排斥反应或多次传代后增殖能力下降而不能获得良好效果,骨髓间充质干细胞虽不存在上述缺陷,但因在目前体外培养条件下难以做到让其定向诱导向韧带细胞分化",本实验并未在组织材料里添加细胞,同样获得较好机械强度,实验结果与用猪SIS修复犬肩袖韧带损伤的实验结果相似!",其术后6个月行组织学检测显示无异物或免疫学反应的组织学表现,与周围组织无粘连,再生肌腱与天然肌腱的力学强度相比差异无统计学意义。分析其原因为胶原可通过调节化学物质的流动、细胞受到的机械刺激来对细胞的分化和形态进行调节,是正常组织中细胞黏附和迁移的支架。本实验中,膝关节内前交叉韧带和后交叉韧带是紧密相依的,当在屈伸活动的过程中受到机械刺激,正常组织中细胞在其上进行黏附、迁移、增殖,经长时间修复后同样可以达到稳定关节的作用。
SIS可以单纯用于组织缺损的修复,已得到肯定”,本实验再次证明可以单纯使用SIS修复重建前交叉韧带,并且在使用编织方法制作SIS重建韧带后其拉伸强度更强。但对大型动物是否适用需进一步实验研究。
参考文献
[1] Leung TH,Snyder ER,Liu Y,et al.A cellular, molecular,and pHarmacological basis for appendage regeneration in mice[J].Genes Dev,2015,29(10):2097-2107.
[2] Yang MY,WV ang J,Zhu Y,et al.Bio-templated growth of bone minerals from modified Sim-ulated body fluid on nanofibrous decellular-ized natural tissues[J]J Biomed Nanotechnol,2016,12(4):753- 761.
[3] Sun T,Liu M,Yao S,et al.Biomimetic Composite Scaffold Containing Small IntestinalSubmucosa and Mesoporous Bioactive Glass Exhibits High Osteogenie and Angiogenic Capaciy[J]Tissue Engineering Part A,2018,24(13- 14):1044- 1056.
[4] Cook JL, Hung CT , Kuroki K,etal. Animal models of cartilage repair[J].Bone JointRes,2014,3(4):89- 94.
[5] Elsawy MM,De MA.Biofabrication and biomaterials for urinary tract reconstruction[J].Res Rep Urol,2017,9(10):79-92.
[6]罗静聪,,杨志明.小肠豁膜下层的制备及其特性的研究进展[J].中国修复重建外科杂志,2003,17(5):425.
[7] Dziki JL,Huleihel L,Scarritt ME,et al.Extra-cellular Matrix Bioscaffolds as Immunomod-ulatory Biomaterials[J].Tissue Eng Part A,2017,23(19-20):1152-1159.
[8] Giedraitis A,Arnoczky SP,Bedi A.Allografts in soft tissue reconstructive procedures:im-portant considerations[J].Sports Health,2014,6(3):256- -264.
[9] Polak DJ.Regenerative medicine.Opportunities and challenges:a brief overview[J].R SocInterface,2010,7(Suppl 6):777-781.
[10] Meesuk L,Tantrawatpan C,Kheolamai P.et al. The immunosuppressive capacity of human mesenchy-mal stromal cells derived from amnion and bone marrow[J].Biochem Bio-pHys Rep,2016,8(3):34- -40.
[11] Liang R,Knight K,Easley D et al.Towards re-building vaginal support utilizing an extra-cellular matrix bioscaffold[J].Acta Biomater,2017,57(15):324- 333.
[12]曹德君,翟華玲,刘伟,等.体外构建组织工程化肌腱的初步研究[J].中华外科杂志,2004,42(2):110-113.

