DMN诱发大鼠肝纤维化库普弗细胞与肝星状细胞的分布
李学文 苏万玲 刘旭 肖玉佳 郑美龙 曹志伟 张静
【摘要】 目的:探讨二甲基亚硝胺(DMN)诱发大鼠肝纤维化库普弗细胞与肝星状细胞的分布及其意义。方法:选取40只Wistar雄性大鼠连续4周腹腔注射10 g/L DMN制备肝纤维化模型。采用随机数字表法分为模型组(n=20)与正常组(n=20),两组均应用DMN进行肝纤维化造模。采用Reiman法测定大鼠第4周和第7周ALT、AST水平,免疫组化法测定两组大鼠库普弗细胞与肝星状细胞标志物ED1与α-SMA分布情况,收集并分析两组肝/体质量比、肝组织病理变化、胶原纤维面密度。结果:模型组第4周和第7周ALT、AST、面密度水平均高于正常组,差异均有统计学意义(P<0.05);模型组第4周和第7周总蛋白(TP)、肝/体质量比水平均低于正常组,差异均有统计学意义(P<0.05);两组第4周与第7周肝/体质量组内比较,差异均无统计学意义(P=0.11);模型组第4周和第7周光镜下可见ED1、α-SMA阳性细胞数量较多,主要分布于增生的纤维组织及纤维间隔弥漫部位。结论:DMN可导致大鼠肝功能障碍及弥漫肝硬化。大鼠肝纤维化模型的库普弗细胞可激活、活化肝星状细胞。
【关键词】 二甲基亚硝胺; 库普弗细胞; 肝星状细胞; 肝纤维化; 大鼠
【Abstract】 Objective:To investigate the distribution and significance of Kupffer cells and hepatic stellate cells in rat hepatic fibrosis induced by dimethylnitrosamine(DMN).Method:40 Wistar male rats were intraperitoneally injected with 10 g/L DMN for 4 weeks to prepare the hepatic fibrosis model.All rats were divided into model group(n=20)and normal group(n=20)according to the random number table method.DMN was used to establish liver fibrosis model in both groups.The levels of ALT and AST in two groups were measured by Reiman method at the 4th and 7th week.The distribution of ED1 and alpha-SMA markers in Kupffer cells and hepatic stellate cells of rats were determined by immunohistochemistry.The liver/body mass ratio,pathological changes of liver tissue and surface density of collagen fibers in two groups were collected and analyzed.Result:The levels of ALT,AST and area density in the model group were higher than those in the normal group at the 4th and 7th week(P<0.05).The levels of total protein(TP)and liver/body mass ratio in the model group were lower than those in the normal group at the 4th and 7th week(P<0.05).There was no significant difference in liver/body mass time between the two groups at the 4th and 7th week(P=0.11).The number of ED1 and α-SMA positive cells in the model group were higher at the 4th and 7th week under light microscope.These were mainly distributed in the proliferative fibrous tissue and the diffuse part of the fibrous septum.Conclusion:DMN can cause liver dysfunction and diffuse cirrhosis in rats.Kupffer cells in rat hepatic fibrosis model can activate and activate hepatic stellate cells.
【Key words】 DMN; Kupffer cells; Hepatic stellate cells; Hepatic fibrosis; Rats
First-authors address:Mudanjiang Medical University,Mudanjiang 157011,China
doi:10.3969/j.issn.1674-4985.2019.13.008
肝纖维化是临床常见的肝脏疾病[1]。相关研究表明,库普弗细胞可通过内毒素等介导下通过多种机制调控肝纤维化进程[2]。该过程的核心是激活肝星状细胞[3]。目前,国内外对DMN诱发大鼠肝纤维化模型的相关研究报道较多,但对于该模型库普弗细胞与肝星状细胞分布情况报道甚少。本研究以40只Wistar雄性大鼠制备肝纤维化模型,探讨DMN对该模型库普弗细胞与肝星状细胞的影响,为临床研究提供实验研究基础。现报道如下。
1 材料与方法
1.1 材料 选取本院2018年1-4月实验动物中心提供的40只清洁级Wistar雄性大鼠,体质量160~180 g,平均(169.26±0.37)g。所有大鼠均常规饲养1周后进行肝纤维化造模实验。DMN购自USA Sigma公司;鼠抗兔ED1试剂购自US Serotec公司;直接红购自Aldrich Chem公司;单克隆鼠抗人α-SMA购自Denmark Dako公司;ALT、AST及TP试剂盒均购自北京中山生物技术公司。本研究经本院伦理委员会审核批准。
1.2 方法
1.2.1 大鼠模型制备 参照Matsuda方法[4],将40只大鼠按照随机数字表法分为模型组(n=20)与正常组(n=20)。模型组制备方法:将10 g/L DMN用适量0.9%氯化钠溶液稀释,按照1 mL/kg的剂量连续3 d/周腹腔注射,共注射4周。正常组按照同样的注射方法注射等量的0.9%氯化钠溶液。两组在第4周和第7周分别选取10只大鼠,测定体质量。采用乙醚麻醉,心脏采血,3 000 r/min离心15 min,留血清,冷冻、备用。采血后立即处死大鼠并常规摘取大鼠肝脏,称量,计算肝/体质量比。
1.2.2 相关指标检测方法 采用Reiman法测定大鼠血清ALT、AST活性;采用Biuret法测定总蛋白(TP)含量,所有操作均严格按照相关试剂盒说明书进行。采用分光光度计在490 nm测定ALT、AST及TP吸光度(D),参照标准曲线计算ALT、AST及TP活性及含量。
1.2.3 病理学检查 用40 g/L中性甲醛常规固定大鼠肝左叶组织,石蜡包埋、切片。采用1 g/L直接红染色肝组织,光镜下观察组织纤维化程度。采用CMIAS系统(北京航空航天大学)检测肝脏组织胶原纤维面密度情况。物镜放大倍数为4倍;每张切片均随机选取4个视野。免疫组化染色:切片(厚度:4~5 μm)常规脱蜡,采用SP法染色,ED1与α-SMA工作浓度为1︰500、1︰50。
1.3 统计学处理 采用SPSS 22.0软件对所得数据进行统计分析,计量资料用(x±s)表示,比较采用t检验,采用SNKq检验进行两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 两组相关指标变化情况 实验过程中,两组均无大鼠死亡。随着时间的推移,两组ALT、AST及TP水平均下降,差异均有统计学意义(F=5.52、6.26、4.65,P<0.05);两组第4周与第7周肝/体质量组内比较,差异均无统计学意义(F=3.26,P=0.11);模型组第4周和第7周ALT、AST、面密度水平均高于正常组,差异均有统计学意义(F=4.17、5.35、4.93,P<0.05);模型组第4周和第7周TP、肝/体质量比水平均低于正常组,差异均有统计学意义(F=5.74、4.71,P<0.05),见表1。
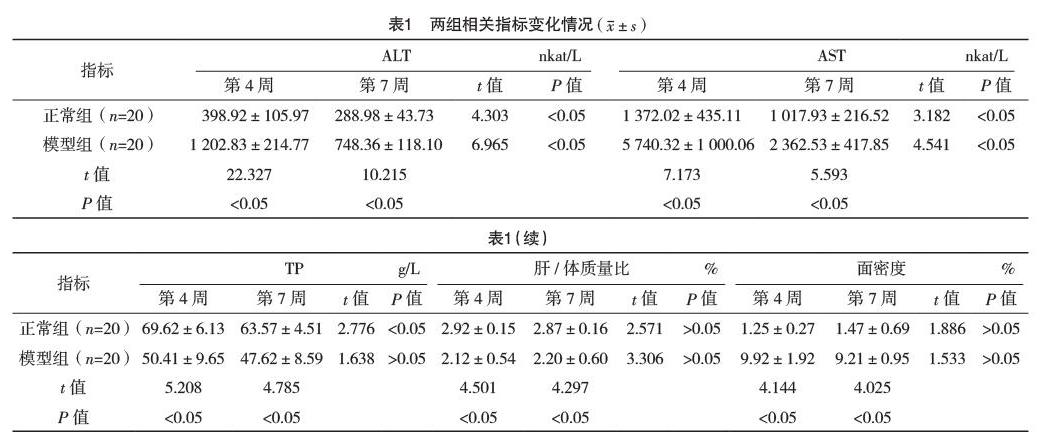
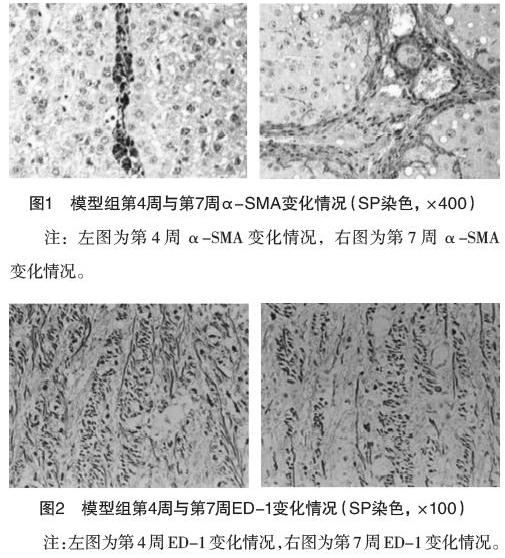
2.2 两组第4周与第7周病理组织变化情况 正常组在第4周和第7周肝左叶切片光镜随机4个视野下均显示正常肝组织结构,无变性、坏死,可在汇管区见些许纤维组织。模型组第4周肝左叶组织切片光镜下可见结构紊乱,有变性、坏死,可在汇管区见大量纤维组织增生,存在假小叶。模型组第7周肝左叶组织切片光镜下可见结构紊乱,有肝细胞变性、坏死,但程度较第4周减轻。免疫组化染色结果:正常组第4周与第7周光镜下均可见肝实质、汇管区等分布少量、散在的ED1阳性细胞,少量α-SMA阳性细胞分布于中央静脉壁,肝细胞间无阳性细胞分布。模型组第4周与第7周光镜下均可见ED1、α-SMA阳性细胞数量较多,主要分布于增生的纤维组织及纤维间隔弥漫部位,肝实质中有少量散在分布,见图1、2。
3 讨论
肝纤维化是临床亟须解决的世界性健康问题。目前,临床运用肝脏移植方法治疗晚期肝硬化[5]。在过去几十年间,肝纤维化与肝硬化是否可以逆转一直存在争议。近年来,随着国内外对肝纤维化的研究不断深入,逐渐意识到肝纤维化是可能逆转的[6-7]。DMN是诱导大鼠肝纤维化模型常用的试剂,具有良好特性。DMN长期小剂量腹腔注射给药大鼠可诱发肝肿瘤,而大剂量可诱发肝纤维化[8-9]。相关研究表明,大鼠连续4周(3次/周)腹腔注射DMN可诱发与人酒精性肝硬化相似的肝硬化模型[10]。另有研究表明,四氯化碳(CCl4)与DMN均可诱发大鼠肝纤维化模型,但DMN停药后大鼠仍可维持几个月的肝硬化特点[11-12]。
本研究中,模型组第4周ALT、AST水平均高于正常组,而TP含量低于正常组(P<0.05),表明DMN可导致大鼠肝功能明显损伤。另外,本研究模型组第7周ALT、AST均仍处于较高水平,表明DMN导致大鼠肝功能损伤依旧明显。本研究中,模型组第4周肝/体质量比水平低于正常组(P<0.05);病理学结果显示,大鼠第4周肝左叶组织切片光镜下可见结构紊乱,有变性、坏死,可在汇管区见大量纤维组织增生,存在假小叶。模型组第7周肝/体质量比水平高于第4周,但差异无统计学意义(P>0.05);病理学结果显示,大鼠第7周肝左叶组织切片光镜下可见结构紊乱,有肝细胞变性、坏死,但程度较第4周减轻,肝硬化特点仍继续维持。
肝纤维化的中心通路是激活库普弗细胞,其参与调控肝纤维化过程,释放肿瘤坏死因子-α、转化生长因子-β等作用于肝星状细胞,进而促使肝星状细胞转化为成纤维样细胞,并表达α-SMA[13-15]。正常肝組织中有两种库普弗细胞,一种是ED1阳性、ED2阴性的细胞主要分布于中央静脉及门脉血管周围;另一种是ED1与ED2均为阳性的肝组织巨噬细胞,其主要分布于血窦周围[16-18]。单克隆抗体ED1可识别库普弗细胞。相关研究运用CCl4制备大鼠肝纤维化模型,发现模型第9周有较多的ED1阳性细胞,分布于纤维间隔[19]。Lan等[20]研究发现,ED1阳性细胞主要聚集在纤维间隔和变性被膜纤维部位。本研究中,模型组第4周、第7周库普弗细胞与肝星状细胞均主要分布于增生的纤维组织及纤维间隔弥漫部位。表明,DMN诱发大鼠纤维化模型库普弗细胞与肝星状细胞存在相关性,深入研究两者之间的作用机制,可能对肝纤维化治疗方面提供新的思路。
综上所述,DMN可导致大鼠肝功能障碍及弥漫肝硬化。大鼠肝纤维化模型的库普弗细胞可激活、活化肝星状细胞。
参考文献
[1]陈宵瑜,杨长青.肝纤维化发生机制研究新进展[J].实用肝脏病杂志,2016,19(1):121-124.
[2]刘明颖,杨加彩,王英杰.体内抑制库普弗细胞对D-氨基半乳糖所致大鼠肝损伤的影响[J].胃肠病学和肝病学杂志,2016,25(9):1002-1004.
[3]张伟,贾继东.肝纤维化的发病机制及治疗新靶点[J].临床肝胆病杂志,2017,33(3):409-412.
[4] Matsuda Y,Matsumoto K,Yamada A,et al.Preventive and therapeutic effects in rats of hepatocyte growth factor infusion on liver fibrosis/cirrhosis[J].Hepatology,1997,26(1):81-89.
[5]李慧,汪根树.肝硬化肝移植术后脾功能亢进的研究进展[J].器官移植,2016,7(3):238-240.
[6] Zoubek M E,Trautwein C,Strnad P.Reversal of liver fibrosis:From fiction to reality[J].Best Pract Res Clin Gastroenterol,2017,31(2):129-141.
[7]严栋梁,陈杰,葛创,等.川芎嗪对刀豆蛋白A诱导的小鼠肝纤维化TNF-α、IL-6、IL-10表达的影响[J].中国医学创新,2017,14(19):19-22.
[8]滕杨,罗时旋,郭英雪,等.代谢组学法考察金银花醇提物对DMN诱导大鼠肝损伤的保护作用[J].食品研究与开发,2016,37(4):29-34.
[9]王永宏,赵晨曦,陈本美,等.茵陈蒿汤对二甲基亚硝胺诱导大鼠肝纤维化的逆转作用[J].中国中药杂志,2014,39(8):1473-1478.
[10]尹燕,李校天,郭永泽,等.1,25-二羟维生素D3对肝纤维化大鼠肝组织HIF-1α和TREM-1表达的影响[J].实用肝脏病杂志,2017,20(2):148-152.
[11] Park H J,Kim H G,Wang J H,et al.Comparison of TGF-β,PDGF,and CTGF in hepatic fibrosis models using DMN,CCl4,and TAA.[J].Drug and Chemical Toxicology,2016,39(1):111-118.
[12] Walton J C.Functionalised Oximes:Emergent Precursors for Carbon-,Nitrogen-and Oxygen-Centred Radicals[J].Molecules,2016,21(1):63.
[13] Hong I H,Park S J,Goo M J,et al.JNK1 and JNK2 regulate α-SMA in hepatic stellate cells during CCl4-induced fibrosis in the rat liver[J].Pathology International,2014,63(10):483-491.
[14]邓文升,顾磊,周鸿,等.1,25(OH)-2D-3抑制肝纤维化大鼠肝组织TGF-β1和α-SMA表达的研究[J].肝胆胰外科杂志,2015,27(3):214-218.
[15]吴芙蓉,姜玲,何晓丽,等.橙皮苷对化学性肝纤维化大鼠α-SM A表达的影响[J].安徽医药,2015,19(12):2267-2271.
[16] Li X,Peng J,Sun Z,et al.Chinese medicine CGA formula ameliorates DMN-induced liver fibrosis in rats via inhibiting MMP2/9,TIMP1/2 and the TGF-β/Smad signaling pathways[J].Acta Pharmacologica Sinica,2016,37(6):783-793.
[17]王咪咪,王艳红.胚胎来源巨噬细胞的起源及其在肝脏中功能的研究进展[J].中国临床医学,2018,25(1):123-128.
[18] Bekki Y,Yoshizumi T,Shimoda S,et al.Hepatic stellate cells secrete WFA+-M2BP:Its role in biological interactions with Kupffer cells[J].Journal of Gastroenterology and Hepatology,2017,32(7):1387-1393.
[19] Hasan I H,El-Desouky M A,Hozayen W G,et al.Protective Effect of Zingiber Officinale against CCl4-Induced Liver Fibrosis Is Mediated through Downregulating the TGF-β1/Smad3 and NF-κB/IκB Pathways[J].Pharmacology,2016,97(1-2):1-9.
[20] Lan L,Liu R,Qin L Y,et al.Transplantation of bone marrow-derived endothelial progenitor cells and hepatocyte stem cells from liver fibrosis rats ameliorates liver fibrosis[J].World Journal of Gastroenterology,2018,24(2):237-247.
(收稿日期:2019-01-07) (本文編辑:周亚杰)

