前体和真菌诱导子对大豆悬浮培养细胞中异黄酮积累的影响
刘 瑞,胡焕焕,石晓卫,丰慧根
(1.新乡医学院三全学院生命科学技术学院,河南新乡 453003;2.新乡医学院研究生处,河南新乡 453003)
大豆异黄酮是大豆生长过程中产生的次生代谢物,可以预防和治疗骨质疏松、心血管疾病、妇女绝经综合症、与激素相关的各种癌症,具有抗氧化、清除自由基及诱发癌细胞凋亡等作用,广泛应用于医疗、保健领域[1]。作为多功能性健康食品,大豆异黄酮具有较好的开发前景[2]。大豆异黄酮主要分布于大豆种子的子叶和胚轴中,胚轴中异黄酮含量较高,为1%~2%,但由于胚只占种子重量的2%,限制了大豆异黄酮的生产[3]。植物细胞悬浮培养生产次生代谢产物的技术已经比较成熟,是高效生产大豆异黄酮的重要途径。
组织培养材料的遗传特性是影响植物组织培养和细胞培养积累次生代谢物质的重要因素[4]。选择异黄酮含量高的品种及外植体诱导愈伤组织,对获得高产异黄酮细胞悬浮体系甚为关键。在植物细胞悬浮培养过程中,常用添加前体或诱导子的方法提高次生代谢产物的含量。异黄酮是由苯丙烷类代谢途径的分支所形成的次生代谢产物,苯丙氨酸和乙酸是黄酮类生物合成的重要前体[5]。杨英、高丽华等[6-7]分别在胀果甘草和水母雪莲悬浮细胞中添加苯丙氨酸(Phe)或乙酸钠(NaAc),均促进了黄酮类化合物的积累。真菌能产生诱导植物合成次生代谢物的活性物质,如寡聚糖、β-葡聚糖、几丁质寡糖、糖蛋白、蛋白质和多肽等,因此在植物细胞培养中常被用作诱导子来提高次生代谢产物的含量[8]。青霉(Penicillium)和黑曲霉(Aspergillusniger)是自然界普遍存在的两种真菌,两种诱导子也被广泛应用于不同植物细胞中萜类、生物碱、皂苷等物质的合成,并取得一定成果[9-10]。但青霉和黑曲霉作为诱导子对大豆悬浮细胞生产异黄酮的影响少有报道。
因此,本研究以高异黄酮含量的品种龙野01-491为材料,以其下胚轴为外植体,进行愈伤组织诱导,建立细胞悬浮培养体系。在此基础上,添加不同的前体(L-phe、NaAc)、生物诱导子(青霉诱导子、黑曲霉诱导子),分析其对异黄酮产量的影响,以期为细胞工程技术生产大豆异黄酮药物或功能性食品提供技术参考。
1 材料与方法
1.1 材料与仪器
大豆:龙野01-491 黑龙江省农业科学院作物育种研究所提供的高异黄酮含量大豆品系;黑曲霉 编号GIM 3.613,广东省微生物菌种保藏中心;青霉 编号GIM 3.106,中国普通微生物菌种保藏管理中心;大豆黄素、染料木黄酮、大豆苷、染料木苷 Sigma;冰乙酸、甲醇 天津彪仕奇科技发展有限公司;二乙酸荧光素(FDA)、乙酸钠(NaAc)、L-苯丙氨酸(L-phe)、6-苄氨基嘌呤(6-BA)、2,4-二氯苯氧乙酸(2,4-D)、1-萘乙酸(NAA)、NaClO、浓H2SO4、蔗糖、琼脂粉、水解乳蛋白(LH) 国药集团化学试剂有限公司;MS培养基 青岛高科园海博生物技术有限公司。
MGC-450HP人工智能光照培养箱 上海一恒科技有限公司;ZWYR-2102C双层恒温培养振荡器 上海智城分析仪器制造有限公司;Nikon E600荧光显微镜 日本Nikon公司;GWA-UP型超纯水器 北京普析通用仪器有限责任公司;VARIAN Prostar240高效液相色谱仪 美国VARIAN公司;DS-1型电动高速组织匀浆机 江苏江阴科研器械厂。
1.2 实验方法
1.2.1 愈伤组织的诱导 龙野01-491为野生大豆,种皮呈褐色且稍厚,参考张秀玲、朱学艺等[11-12]的方法并略作改动,进行种子脱毒、发芽和下胚轴愈伤组织的诱导。先用刀片将种子破皮,浓H2SO4处理5 min,用75%酒精处理30 s,无菌水冲洗1次,1% NaClO处理5 min,无菌水清洗4~5次。将脱毒后的种子接入含3%蔗糖的1/2 MS固体培养基中,待种子发芽3 cm左右时,取下胚轴。以下胚轴为外植体,接入到含0.5 mg/L 2,4-D、1.0 mg/L NAA、0.1 mg/L 6-BA、30 g/L蔗糖、100 mg/L LH的MS固体培养基上诱导愈伤组织[13];培养条件:25 ℃,暗培养,培养2周。
1.2.2 细胞悬浮培养体系的建立 参考梁晓芳等[13]方法。取质地疏松、生长旺盛的愈伤组织15 g,接种到100 mL含0.8 mg/L 2,4-D、30 g/L蔗糖的MS液体培养基的250 mL三角瓶中,110~120 r/min,25 ℃,暗培养,振荡培养3 d,依次用60、200目尼龙网过滤,除去愈伤组织碎片和细胞团,获得悬浮细胞体系。
1.2.3 大豆悬浮细胞生长特性的检测 按4 g/L(细胞干重计)细胞密度接种,并使接种后的体积为30 mL,于0、3、6、9、12、15 d取摇瓶细胞悬液,测细胞生物量,绘制悬浮细胞生长曲线。取1滴细胞悬液于载玻片上,加一滴0.04 mg/mL FDA溶液,常温作用5 min,加盖玻片,荧光显微镜下观察细胞形态和活性。
1.2.4 细胞生物量的测定 取大豆悬浮细胞培养物,抽滤,50 ℃烘干至恒重,称重,每次三个重复。细胞生物量为每瓶(每30 mL培养物)收获的细胞干重(g/flask(瓶))。
1.2.5 异黄酮的提取及测定
1.2.5.1 标准溶液的配制及标准曲线的绘制 精密称取大豆苷、染料木苷、大豆黄素、染料木黄酮各5.0 mg,均用80%甲醇溶解并定容至10 mL,配制成0.5 mg/mL的四种标准品标准贮备液。分别取四种标准贮备液各1.0、0.5、0.25、0.125 mL,用80%甲醇稀释并定容至10 mL,配制50、25、12.5、6.25 μg/mL标准系列溶液。0.45 μm滤膜过滤,供高效液相色谱检测,以大豆异黄酮各单体浓度X(μg/mL)为横坐标,以峰面积为纵坐标绘制四种标准品的标准曲线,其回归方程分别为:Y=1.6304×105X+9.6333×105(R2=0.9993);Y=1.8483×105X+8.9980×105(R2=0.9989);Y=3.5701×105X+2.5849×106(R2=0.9969);Y=1.7681×105X+3.8145×105(R2=0.9997)。
1.2.5.2 异黄酮的提取 参考程真真等[14]方法。将细胞样品粉碎,过60目,以1∶1000 (m∶V)向样品中加入80%甲醇,超声提取30 min,5000 r/min离心15 min,取上清,0.45 μm滤膜过滤,得待测样品液。
1.2.5.3 高效液相色谱条件 依据张晓波、贾芸等[15-16]HPLC检测方法进行改良。HPLC检测条件:色谱柱:ODS-BP C18柱(4.6 mm×200 mm,5 μm);流动相:甲醇∶2.2%冰乙酸=50∶50 (V∶V);柱温:50 ℃;检测波长:254 nm;流速:1 mL/min;进样量:10 μL;进样时间:20 min。四种标准品混合进样,出峰顺序为:大豆苷、染料木苷、大豆黄素、染料木黄酮。
1.2.5.4 异黄酮含量与异黄酮产量的测定 异黄酮含量为细胞内四种异黄酮含量之和,代表细胞合成异黄酮的能力,本文以1 g干细胞中的4 种异黄酮的总质量表示,单位为mg/g。
异黄酮含量(mg/g)=X·V/m
式中:X为根据标准曲线计算的各异黄酮浓度;V为抽提定容体积;m为样品质量。
异黄酮产量是确定培养条件下培养瓶中细胞的异黄酮总产量,本文以每瓶(30 mL培养物)中的总异黄酮质量表示,单位为mg/flask。
异黄酮产量(mg/flask)=细胞干重(g/flask)×异黄酮含量(mg/g)。
1.2.6 添加前体对大豆悬浮细胞生物量、异黄酮含量及异黄酮产量的影响 分别在细胞培养的0、9 d,向大豆细胞悬浮体系中分别添加不同浓度的经过滤除菌的NaAc(10、50、80、100 μmol/L)和L-Phe(50、80、100、150 μmol/L溶液),每组三个重复,以不加前体的培养液作为对照,12 d时收获细胞,考察其对细胞生物量、异黄酮含量、细胞总异黄酮产量的影响。
1.2.7 添加诱导子对大豆悬浮细胞生物量、异黄酮含量及异黄酮产量的影响 参考文涛等的诱导子制备方法[17]。将青霉和黑曲霉的冻干菌种,分别接种在马铃薯固体培养基上,28 ℃活化培养4 d,接种到马铃薯液体培养基中,28 ℃,120 r/min摇床震荡培养5 d,4层纱布过滤收获菌丝体。菌丝体经0.05 mol/L(pH7.0)的磷酸缓冲液洗涤3次,1 g菌丝沉淀重悬浮于10 mL水中,2000 r/min匀浆5 min,4000 r/min离心10 min,弃沉淀,上清液于121 ℃下灭菌20 min,即为真菌诱导子。向装有30 mL细胞培养液的摇瓶中分别添加不同量的黑曲霉和青霉诱导子,每组三个重复,以不加真菌诱导子的培养液作为对照。
1.3 统计分析
采用SPSS软件,用LSD法进行单因素方差分析。
2 结果与分析
2.1 大豆下胚轴的愈伤组织
大豆下胚轴在愈伤组织诱导培养基上,诱导6 d即出愈,脱分化程度良好、质地疏松、黄白色、生长良好(图1)。

图1 下胚轴愈伤组织
2.2 悬浮培养大豆细胞的生长和异黄酮的合成与积累
愈伤组织建立的细胞悬浮体系,细胞悬液呈乳白色。经FDA染色,荧光显微镜下观察发现,大豆悬浮细胞较大,形状主要为类圆形、杆状和长条状,细胞活性较强,发出明亮的绿色荧光(图2)。
悬浮培养的大豆细胞的生长曲线和细胞的异黄酮合成曲线如图3所示。大豆细胞生长曲线呈S形,0~3 d为滞后期,3~9 d为对数期,9~15 d为稳定期。在0~6 d,异黄酮的含量增加缓慢;6~12 d,异黄酮含量迅速增加;12~15 d,异黄酮含量稍有下降,且无显著性差异(p>0.05)。细胞异黄酮积累如图3所示,异黄酮产量在0~3 d增长缓慢;第3 d起,虽然细胞合成异黄酮缓慢,但是细胞已进入对数生长期,异黄酮产量也迅速增加,并在12 d达到最大值(3.86±0.20) mg/flask。选择在细胞培养12 d时收获细胞并获取异黄酮。
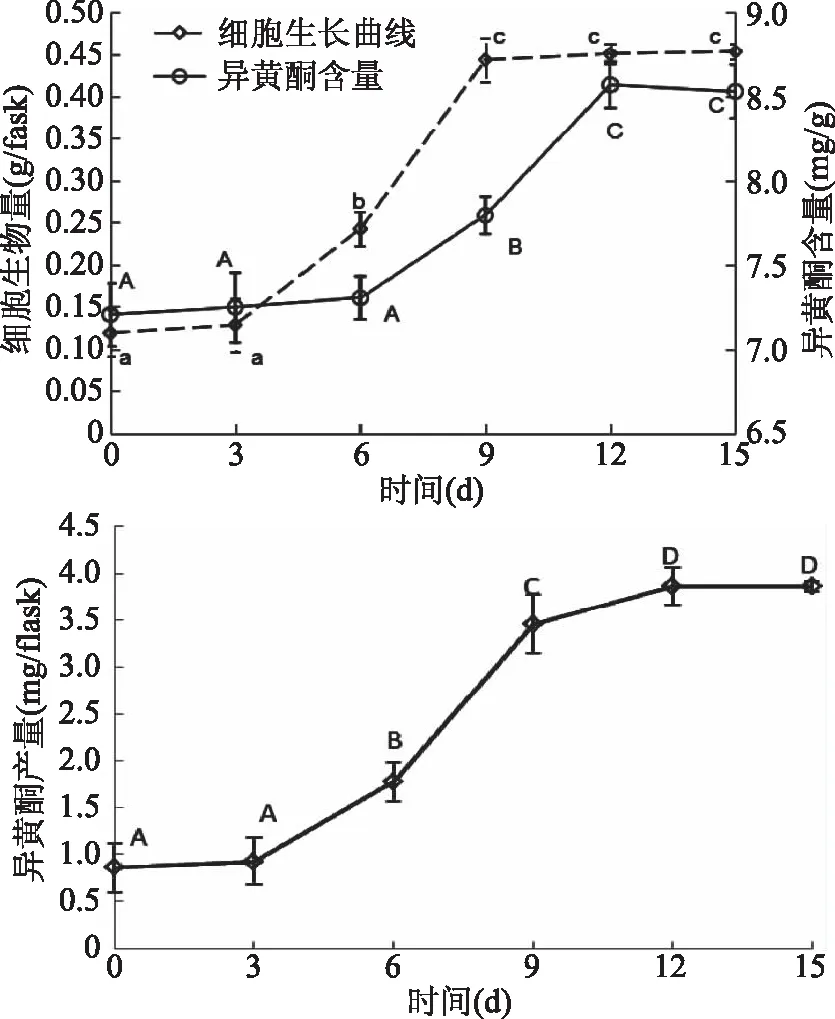
图3 大豆悬浮细胞生长曲线、异黄酮合成及异黄酮积累曲线
在细胞悬浮培养过程中添加前体和诱导子,可能提高细胞中次级代谢产物的含量,但也有可能抑制细胞的生长[6]。在不少的研究报道中,前体和诱导子的添加策略一般是在细胞已长至较高密度的对数生长期末期加入有助于次生物代谢物合成的物质[7]。但是,Chen等在细胞悬浮培养初期时,向其中加入苯丙氨酸,紫杉醇产量提高了10倍[18]。因此,选择在大豆细胞悬浮培养初期0 d和对数生长末期9 d加入前体和诱导子,考察不同前体和真菌诱导子对大豆细胞生长和异黄酮积累的影响。
2.3 前体对悬浮细胞异黄酮积累的影响
2.3.1 L-phe 分别在细胞培养的0、9 d添加50、80、100、150 μmol/L L-phe,12 d时收获细胞,称细胞干重,测细胞异黄酮含量,结果如图4。图4结果表明,在细胞培养0 d添加L-phe,50~80 μmol/L L-phe对细胞生长无明显抑制作用,而100~150 μmol/L的L-phe对细胞生长有抑制作用;而9 d时加入L-phe对细胞生长明显起促进作用,在50~150 μmol/L范围内,随着L-phe浓度的增大作用减小。结果提示,9 d时加入L-phe更有利于大豆细胞生长。检测不同处理组细胞中异黄酮含量,结果发现,9 d加入L-phe时,不同浓度处理组的异黄酮含量均高于对照(8.57±0.25) mg/g,具有显著性差异(p<0.05);在50~100 μmol/L范围内,异黄酮含量随着L-phe浓度的增大而增大,浓度为100 μmol/L时达到最大,异黄酮含量为(21.41±0.18) mg/g,是对照的2.50倍;当L-phe浓度为150 μmol/L时,异黄酮含量有所降低。
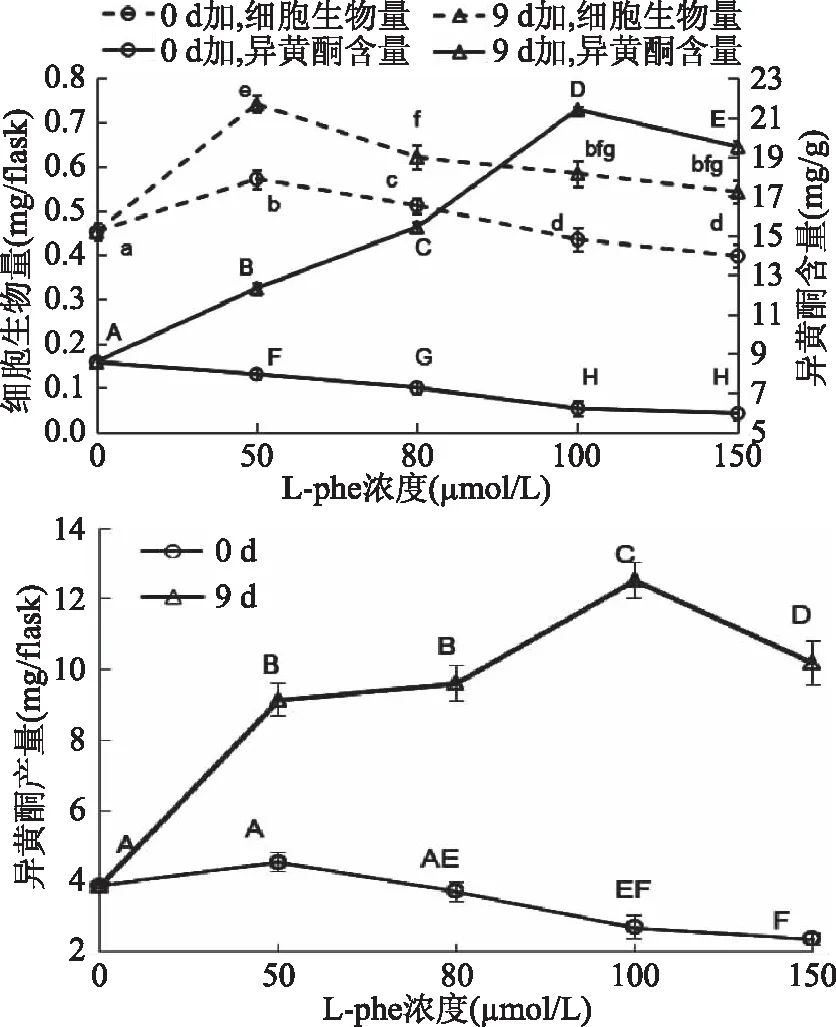
图4 L-Phe对大豆悬浮培养细胞异黄酮积累的影响
由细胞生物量和异黄酮含量计算所有细胞的异黄酮总产量,结果如图4所示。从图4可以看出,以L-phe作为前体饲喂大豆悬浮细胞生产异黄酮时,第9 d添加L-phe优于0 d时添加,且当L-phe浓度为100 μmol/L时,异黄酮的产量达到最高(12.52±0.51) mg/flask,是对照组产量(3.88±0.08) mg/flask的3.23倍。结果提示,以L-phe作为前体饲喂大豆悬浮细胞生产异黄酮时,应在细胞培养9 d加入,最佳添加浓度为100 μmol/L。
2.3.2 NaAc 以NaAc作为异黄酮的前体物质添加在大豆悬浮细胞培养体系中,并使其最终浓度为10、50、80、100 μmol/L。结果如图5所示,0 d加入低浓度(10~50 μmol/L)NaAc对细胞生长影响不显著,高浓度(100 μmol/L)NaAc抑制细胞生长;而9 d加入10~100 μmol/L NaAc,与对照组相比细胞干重均增加,对细胞生长明显起促进作用,但随着浓度的增大,促进细胞生长的作用减弱。提示高浓度(100 μmol/L)NaAc不利于细胞生长。虽然,在9 d 时添加NaAc有利于大豆细胞的生长,但是9 d时加入不同浓度的NaAc,与对照相比,异黄酮含量均降低;而在实验浓度范围内,0 d添加NaAc促进异黄酮合成的作用优于9 d,NaAc浓度为50 μmol/L时细胞内异黄酮含量达到最高为(10.03±0.13) mg/g,与对照相比具有显著性差异(p<0.05),是对照的1.17倍,当NaAc浓度升高时,细胞内异黄酮含量下降。
由细胞生物量和异黄酮含量计算异黄酮产量。图5可以看出,在悬浮培养0 d时加入80 μmol/L NaAc,异黄酮产量达到最大(5.55±0.36) mg/flask,是对照组的1.43倍。
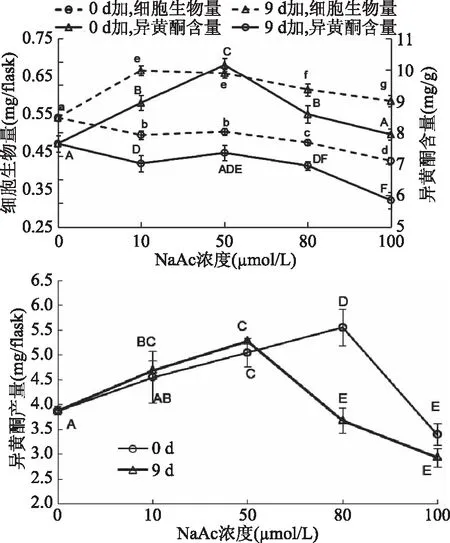
图5 NaAc对大豆异黄酮积累的影响
2.4 真菌诱导子对悬浮细胞异黄酮积累的影响
2.4.1 黑曲霉诱导子 向大豆悬浮培养体系中添加0.1、0.5、1.0、1.5 mL的黑曲霉诱导子,结果如图6所示。在摇瓶培养0 d加入0.1~1.5 mL黑曲霉诱导液,均不同程度地抑制了细胞的生长,实验中发现诱导子添加3 d后,细胞出现明显褐化现象;在9 d时加入黑曲霉诱导子促进了细胞的生长,但随着添加浓度的增大,促进细胞生长的作用减弱。第9 d添加(0.1~1.0 mL)黑曲霉诱导子均有利于细胞合成异黄酮,不同处理组的异黄酮含量与对照组均具有显著性差异(p<0.05)。在第9 d加入黑曲霉诱导子添加量为0.5 mL时,异黄酮含量达到最大,为(11.15±0.21) mg/g,是对照组的1.29倍。
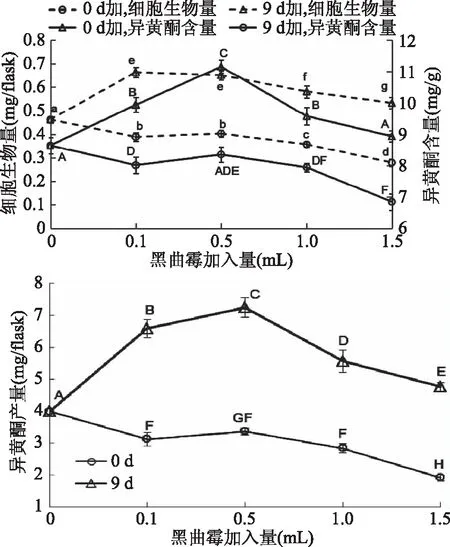
图6 黑曲霉诱导子对大豆异黄酮积累的影响
在第9 d加入黑曲霉诱导子,既有利于细胞生长,也促进了异黄酮的合成。因此,在此时加入黑曲霉诱导子优于0 d时诱导的效果。当黑曲霉诱导子添加量为0.5 mL时,异黄酮产量均达到最大,为(7.25±0.30) mg/flask,是对照的1.82倍。
2.4.2 青霉诱导子 向大豆悬浮培养体系中添加0.1、0.5、1.0、1.5 mL的青霉诱导子,结果如图7示。与黑曲霉诱导子结果相似,9 d向大豆细胞悬浮液中加入0.1~1.5 mL青霉诱导子,均能明显促进细胞的生长,但随着青霉诱导子量的增加,促进细胞生长的作用减小;且不同添加量的处理组,异黄酮含量均增加,与对照组均具有显著性差异(p<0.05),其中,1.0 mL青霉诱导子可使异黄酮含量达到最高为(17.15±0.10) mg/g。综合细胞生物量和异黄酮含量,青霉诱导子为0.5 mL时,异黄酮产量达到最大(10.20±0.17) mg/flask,是对照组异黄酮产量(3.99±0.08) mg/flask的2.56倍;在0.5~1.5 mL范围内,随着青霉诱导液加入量的增加,异黄酮产量降低。青霉和黑曲霉诱导子均在9 d添加时异黄酮产量达到最高,说明在大豆细胞培养对数生长期末期,大豆细胞对青霉和黑曲霉诱导子的诱导作用具有较强的反应能力。
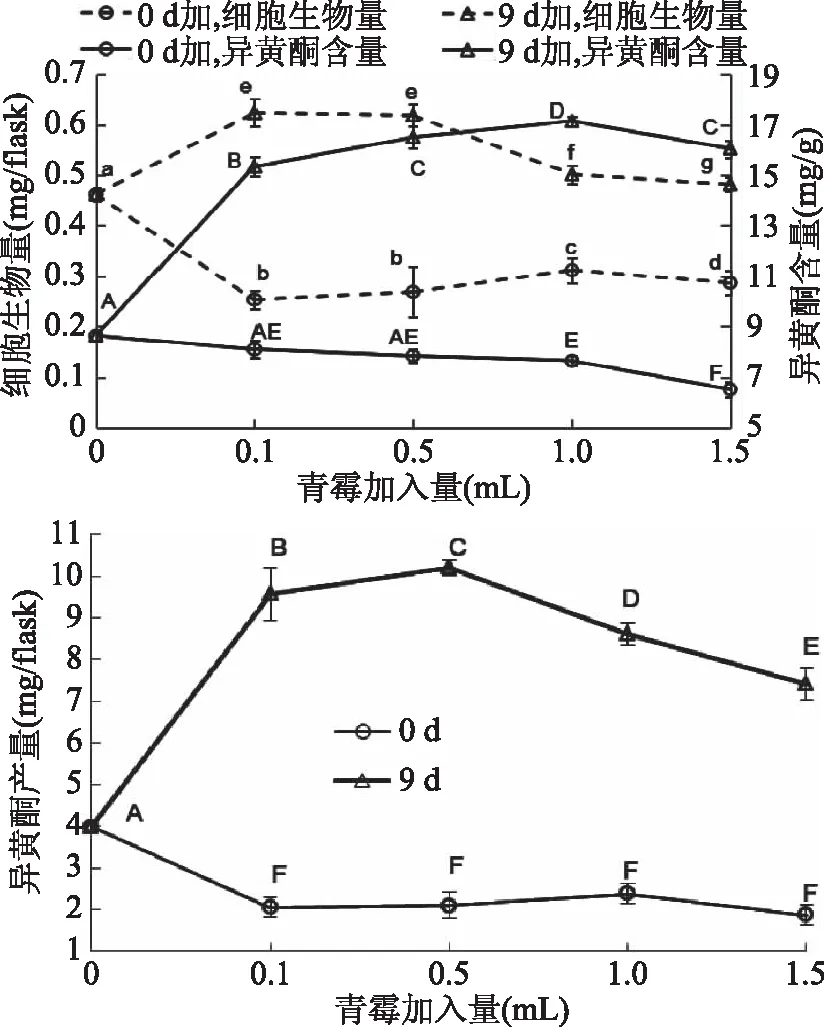
图7 青霉诱导子对大豆异黄酮积累的影响
3 讨论与结论
前体物质是终端次生代谢产物在生物体代谢途径中的中间体,前体饲喂可有效提高目标代谢产物产量。异黄酮类物质合成途径是类黄酮代谢途径的一个分支,由苯丙氨酸和丙二酰辅酶A经苯丙氨酸裂解酶(PAL)、香豆酸辅酶A连接酶(4CL)等酶催化,经过羟基化、甲氧基化和烷基化过程形成的[19]。从代谢途径上看,Phe是异黄酮代谢途径中重要的的合成前体物,乙酸也是黄酮类生物合成的重要前体之一。
杨英等[6]认为前体饲喂可能有利于提高细胞内次级代谢产物的含量,但同时也可能会抑制细胞的生长。前体的最佳添加浓度非常重要。本研究发现,添加合适浓度的L-phe和NaAc均能促进大豆异黄酮的产量,与杨英、高丽华等的结果一致[6-7]。在大豆悬浮体系中添加100 μmol/L L-phe和80 μmol/L NaAc,一方面,对细胞的生长没有明显的抑制作用,且作为代谢过程中的中间产物,促进了异黄酮的合成;另一方面,合适浓度的L-phe和NaAc能增加苯丙烷类合成途径的起始酶——苯丙氨酸裂解酶(PAL)的活性,可为后面的合成步骤提供更多前体,从而提高了异黄酮的产量,使其达到最大[6]。在体系中添加高于最佳添加浓度的前体时,例如:在摇瓶培养的第9 d添加高浓度150 μmol/L L-phe,发现产生细胞毒性,细胞生长速率下降,细胞生物量降低;异黄酮含量虽然高于对照,但是仍低于100 μmol/L L-phe处理组,异黄酮合成减少,最终导致异黄酮产量达到不到最高。在加入较低浓度(50 μmol/L)L-phe时,细胞生长最快,但细胞内异黄酮含量较低,最终的异黄酮产量也达不到最高。本研究结果发现,NaAc促进异黄酮积累的作用比L-phe弱,这与吴桂容等[20]L-phe和NaAc对鸡血藤细胞产异黄酮的影响研究结果一致。推测由于乙酸是聚乙炔类、大环抗菌素类、多酚类、类异戊二烯的前体,代谢途径分支较多,NaAc提供的乙酸根离子可能较多地参与脂肪酸类、萜类以及其它黄酮类化合物的合成而造成的[21]。
本研究实验了接种初期和对数生长期末期添加L-phe和NaAc对大豆悬浮细胞异黄酮积累的影响,发现不同时间添加前体物质具有不同的效果。L-phe在第9 d添加优于在0 d添加,而NaAc在0 d添加较好,说明不同前体适宜的添加时间不同。细胞悬浮培养过程中,要寻找合适的时间添加外源前体来提高目的产物的产量。L-phe在9 d时添加时,一方面,9 d时细胞积累了足够的初级代谢产物,加入合适浓度的L-phe促进了异黄酮的合成,异黄酮含量增加,从而达到促进异黄酮积累的目的;另一方面,9 d时,细胞活性仍较好,但是细胞培养液中营养成分已经消耗殆尽,实验浓度范围内的L-phe对大豆细胞无毒性,是细胞生长的营养成分,参与细胞蛋白质合成和作为碳源和氮源促进细胞的生长,细胞生物量增加[8]。在9 d时添加50 μmol/L NaAc时,虽然获得细胞生物量较高,但是异黄酮合成量均低于0 d添加不同浓度NaAc的所有处理组;在0 d时添加80 μmol/L NaAc时,虽然没有对细胞生长起明显促进作用,但是异黄酮合成增加,异黄酮含量在此时高于9 d时添加不同浓度NaAc的所有处理组,最终结果显示,0 d时添加80 μmol/L NaAc的异黄酮产量最大。因此,在添加前体时需要找到悬浮细胞生物量与次生产物含量之间的平衡点,才能获得最高的产量[22]。
真菌诱导子是来源于真菌的一种确定的化学信号。它能快速、高度专一和选择性地诱导植物特定基因的表达,进而活化特定次生代谢途径,积累特定的目的次生产物[9]。真菌诱导子能有效促进植物次生代谢产物的积累,其诱导效果与真菌诱导子的种类、浓度和作用时间等因素密切相关[23]。真菌诱导子诱导次生代谢产物的积累有最适浓度,当真菌诱导子的浓度过高时会抑制次生代谢产物的合成和积累。本研究中,在9 d添加真菌诱导子时,0.5 mL的青霉诱导子和黑曲霉诱导子对异黄酮的积累作用最显著,但随着加入量的增加,效果减弱,与熊琼琼、吕建军等研究结果基本一致[9,24]。推测诱导子浓度过大(1~1.5 mL)时,一方面,高浓度诱导子的细胞毒性增强,降低了大豆细胞生长速率,导致异黄酮减少;另一方面,可能抑制了PAL的活性,导致异黄酮合成减少,最终异黄酮的产量下降[25]。
真菌诱导子的作用效果还依赖于培养细胞的生理状态,只有处于一定生长时期的细胞才能有效地接受诱导信号[24]。在本研究中,在0 d时加入青霉和黑曲霉诱导液均抑制了细胞的生长,细胞生物量显著降低;9 d加入青霉或黑曲霉诱导子,在合适的浓度范围内,没有对细胞生长产生抑制作用,且促进了目的代谢产物的合成,有利于产物的积累,与熊琼琼、吕建军等结果一致。究其原因:0 d时,细胞还没有适应新的培养环境,且活性较低,真菌诱导子加入后快速地引起Ca2+、H+内流,培养液pH升高,不利于细胞吸收营养物质,严重的细胞毒性抑制了细胞的生长,同时对其代谢损伤较大,从而抑制了次生代谢产物的积累[8,25];对数生长末期的细胞密度较大,且细胞活力仍较高,生长和代谢相对旺盛,此时加入一定浓度的外源黑曲霉诱导子或青霉诱导子,能充分接受诱导信号,激活苯丙烷类途径中的PAL等异黄酮合成限速酶,加速了异黄酮的合成,使细胞内的异黄酮含量和异黄酮产量增加[26]。
本研究利用高异黄酮含量的龙野01-491大豆品系的下胚轴诱导愈伤组织,并建立大豆细胞悬浮培养体系,就前体和真菌诱导子在提高大豆悬浮细胞异黄酮积累的方法进行了探讨。结果表明,前体(L-phe和NaAc)、真菌诱导子(黑曲霉诱导子和青霉诱导子)均可以在一定程度上提高大豆悬浮培养细胞异黄酮的产量。虽然前体和真菌诱导子的分别添加能在一定程度上提高大豆悬浮细胞异黄酮的产量,但诱导子和前体的作用机制并不重叠,两者具有协同添加的基础[21]。目前,使用前体和真菌诱导子的协同作用提高异黄酮产量的报道较少。因此,在本研究的基础上,进一步研究前体和真菌诱导子的协同作用,是提高大豆悬浮细胞产异黄酮的又一重要课题。

