甘薯根腐病病原分子鉴定及防治药剂筛选
张成玲,孙厚俊,赵永强,杨冬静,徐 振,马居奎,谢逸萍
(江苏徐淮地区徐州农业科学研究所/农业部 甘薯生物学与遗传育种重点实验室,江苏 徐州 221131)
甘薯[Ipomoeabatatas(L.) Lam]是世界上重要的粮食作物,也是动物饲料、能源及工业原料的重要原料作物[1-2]。甘薯具有耐旱、耐盐、耐贫瘠、适应性强等特点,在世界上100多个国家或地区种植。中国是世界上最大的甘薯生产国,年产量占世界甘薯总产量的 75%以上,近几年随着甘薯产业的发展,种薯、种苗等的频繁调运,加重了甘薯病虫害尤其是病毒病及真菌性病害的发生和扩展,阻碍了甘薯产业的发展。
甘薯根腐病是制约我国甘薯生产的三大重要病害之一,是我国北方甘薯生产区重要的真菌病害,在甘薯苗床和大田期均有发生[4]。甘薯根腐病菌侵染苗期甘薯后造成死苗、弱苗,侵染大田甘薯后造成植株生长缓慢、叶片黄化脱落、甘薯开花、不结薯块或薯块小而少等。一般田块发病后减产10%~20%,危害严重的达50%,甚至绝收,对甘薯的高产、稳产威胁极大[5-7]。常见甘薯根腐病病原为茄病镰孢菌甘薯专化型[Fusariumsolani(Mart) sacc. f. sp.batatasMeClure,简称FSB],也是报道最早、最为常见的一种病原。除茄病镰孢菌甘薯专化型外,尖孢镰孢菌(F.oxysporum)、爪哇镰孢(F.javanicumKoord)及其根生变种(F.javanicumvar.radicicola)、串珠镰孢菌(F.moniliforme)、腐霉菌(Pythiumultimum)等均能侵染甘薯引起甘薯根腐病[8-11]。
不同地区甘薯根腐病病菌的优势菌群不同,因此为了明确江苏省徐州市甘薯根腐病病原菌的优势菌株,本研究采集徐州市发病薯苗薯块,利用组织分离法获得病原菌,在室内测定了8种杀菌剂对其菌丝生长的抑制活性,旨在了解这些药剂对镰刀菌属真菌的抑制活性及作用特点,同时,结合大田药效试验筛选高效防治该类病害的药剂。
1 材料与方法
1.1 病原菌采集及分子鉴定
1.1.1 病原菌的分离和纯化 2013年和2017年于江苏徐州甘薯研究中心试验基地采集甘薯茎部为褐色、凹陷、纵裂、皮下组织疏松等典型甘薯根腐病病斑的样品(图1a),按常规组织分离法[12],采用马铃薯葡萄糖琼脂培养基(PDA)平板在25 ℃条件下进行病原分离培养,利用柯赫氏法则(Koch’s rule)验证病原菌。
1.1.2 病原菌的鉴定 将纯化的病原菌接种到PDA培养基平板上,在25 ℃、每天12 h黑暗(或光照)的条件下培养,观察菌落及孢子形态。
将病原菌接种于马铃薯葡萄糖液体培养基中,在25 ℃、125 r/min条件下振荡培养5~7 d,过滤收集菌丝体用于DNA提取。采用植物基因组DNA提取试剂盒(天根生化科技有限公司,北京)获得菌体的总DNA。利用真菌核糖体基因转录间隔区(ITS)通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对病原菌的rDNA-ITS区进行PCR扩增[13]。PCR产物送交生工生物工程(上海)有限公司进行测序,利用DNAstar等软件进行分析,通过GenBank数据库(www. ncbi.nlm. nih. gov)进行BLAST比对,利用MEGA6软件[14]中的邻接法(Neighbour-joining, NJ)构建系统进化树。
1.2 防治药剂的筛选
1.2.1 供试药剂 本研究所用药剂如下:50%咪鲜胺锰盐可湿性粉剂(WP,江苏省苏州富美实植物保护有限公司);1000亿个/g枯草芽孢杆菌可湿性粉剂(WP,中国农科院植保所廊坊农药中试厂);50%二氯异氰尿酸钠可溶性粉剂(SG,山东省曲阜市尔福农药厂);80%代森锰锌可湿性粉剂(WP,利民化工股份有限公司);40%腈菌唑可湿性粉剂(WP,美国陶氏益农公司);40%菌核净可湿性粉剂(WP,山东恒利达生物科技有限公司);50%苯菌灵可湿性粉剂(WP,江苏蓝丰生物化工股份有限公司);97%噁菌灵原药(TG,潍坊华诺生物科技有限公司)。对这8种药剂进行室内药剂筛选研究,对前3种药剂同时进行田间防治效果试验。
1.2.2 测定方法及数据分析 利用菌丝生长速率法测定8种药剂的室内毒力。将PDA培养基完全融化后,冷却到45 ℃左右,分别配成含药量为1、10、100、1000 μg/mL的含药培养基,摇匀后倒入直径9 cm的灭菌培养皿中,每皿15 mL,每个浓度处理重复3次,并设清水对照。用直径为5 mm的打孔器将活化好的供试菌种打取菌饼接入含药培养基平板中央,置于26 ℃恒温培养箱中培养。培养6 d后,对照培养皿内菌丝长满前,用十字交叉法测量菌落直径。
田间试验于2016~2017年6~10月在江苏省徐州市邳州市港上镇甘薯田进行,试验品种为冲绳100。试验田土壤质地为沙壤土,试验地每年仅种植一茬甘薯,连续种植多年。试验每处理设置3个重复,每个重复20株,共60株,在田间采用“Z”字形间隔排列。在栽种封穴前浇灌施药,栽种时第一次施药,此后每间隔10 d喷施1次,连续施药3次。其他管理措施统一按常规栽培要求。在施药后40 d和收获时分别调查甘薯根腐病的发病情况[15-16]。
1.2.3 数据分析 用下式计算菌丝相对抑制率:相对抑制率(%)=(对照菌落平均直径-处理菌落平均直径)/对照菌落平均直径×100。利用Excel及DPS软件进行统计分析,计算毒力回归方程、菌丝生长抑制中浓度(EC50)、EC90、置信区间及相关系数(R) 。田间实验计算病情指数,公式如下:病情指数(%)=∑(病级值×病级对应株数)/(最高病级值×处理总株数)×100。用DPS 软件进行统计分析。
2 结果与分析
2.1 病原菌的鉴定
2013年和2017年从发病甘薯样品中分离病原菌,经单孢纯化后接种到甘薯薯苗上,用柯赫氏法则(Koch’s rule)验证 (图1b)后,得到30个致病菌株。在PDA培养基上培养初期正面产生白色至淡黄色绒毛状菌丝,后期菌丝变为粉红色,少数为白色;培养6 d后菌落直径为58~68 mm。在显微镜下观察,30个分离物均产生两种不同的分生孢子,一类大型分生孢子镰刀形,稍弯曲,顶端略尖,分隔数多为3个,小型分生孢子椭圆形、肾形到矩圆形等,多为单细胞,占总分离物的56.7%;另一类大型孢子镰刀形,3~5个分隔,稍弯曲,两端钝,小型分生孢子椭圆形,0~1个分隔,占总分离物的40%。依据Leslie等文献[13]将其鉴定为镰孢菌(Fusariumspp.)。
将培养性状及孢子一致且分离频率最高的13-GF、17-GF1、17-GF2和17-GF3这4个菌株进行分子鉴定。利用ITS1和ITS4引物对扩增,经琼脂糖凝胶电泳后得到550 bp左右的条带,经测序后分别获得了544、535、568和568 bp的序列,核苷酸一致率为88%~100%。经NCBI比对,13-GF和17-GF1与Genbank中登录号为MG356946的尖孢镰孢菌(F.oxysporum)的核苷酸一致率最高,分别达到100%和97.98%;而17-GF2和17-GF3分别与MK418649的茄病镰孢菌(F.solani)的核苷酸一致率最高,均为100%。以甘薯长喙壳菌(Ceratocystisfimbriata)为外围,对与4个菌株核苷酸一致率较高的菌株rDNA-ITS序列构建系统进化树,分为两个组,13-GF和17-GF1位于尖孢镰孢菌组,结合形态学鉴定为尖孢镰孢菌(F.oxysporum);17-GF2和17-GF3位于茄病镰孢菌组,结合形态学鉴定为茄病镰孢菌(F.solani)(图2)。

图1 甘薯根腐病的田间症状(a)及回接40 d后的症状(b)
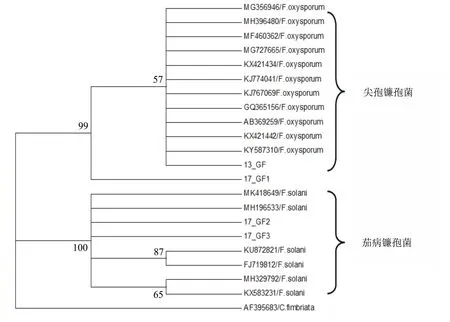
图2 基于ITS基因的甘薯根腐病病原菌系统发育树
2.2 防治药剂的筛选
以分离频率最高的尖孢镰孢菌17-GF1为参试菌株进行室内药剂筛选,结果表明,供试的8种药剂均对甘薯根腐病病菌菌丝的生长表现出一定的抑制作用,但不同杀菌剂或同一杀菌剂的不同浓度具有不同的杀菌效果(图3)。具体来说,在低浓度下,50%咪鲜胺锰盐可湿性粉剂和1000亿个/g枯草芽孢杆菌可湿性粉剂对甘薯根腐病菌17-GF1的室内抑制效果居前2位,1 μg/mL的防效均达到50%以上,分别为74.70%和72.26%,其EC50分别为0.0095 μg/mL和0.0001 μg/mL;此外,50%咪鲜胺锰盐可湿性粉剂的EC90较低,为275.31 μg/mL(图3、表1),而1000亿个/g枯草芽孢杆菌可湿性粉剂的EC90较高,为1.77×106μg/mL(表 1)。50%二氯异氰尿酸钠可溶性粉剂、40%菌核净可湿性粉剂和50%苯菌灵可湿性粉剂低浓度的抑制效果较差,但浓度达到1000 μg/mL时抑制率均为92.70%,且EC50值较高。80%代森锰锌可湿性粉剂整体抑制效果较差,抑制率为16.79%~36.74%。
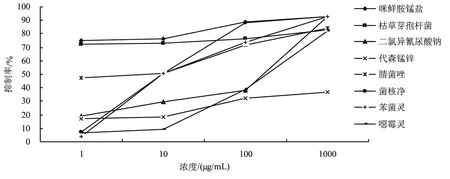
图3 不同杀菌剂在4个浓度下对甘薯根腐病病菌的菌丝生长抑制率
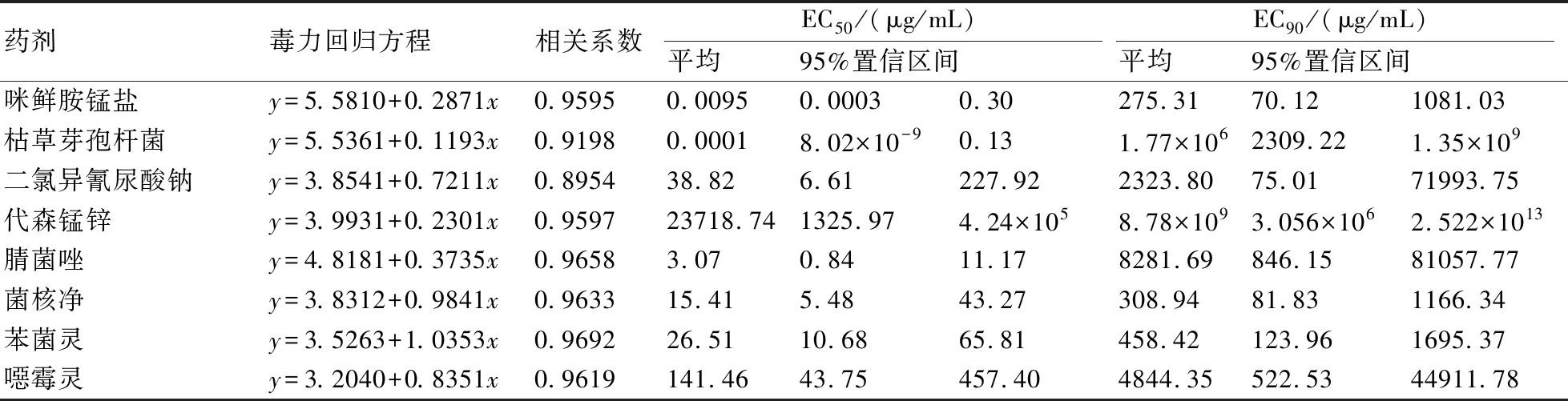
药剂毒力回归方程相关系数EC50/(μg/mL)平均95%置信区间EC90/(μg/mL)平均95%置信区间咪鲜胺锰盐y=5.5810+0.2871x0.95950.00950.00030.30275.3170.121081.03枯草芽孢杆菌y=5.5361+0.1193x0.91980.00018.02×10-90.131.77×1062309.221.35×109二氯异氰尿酸钠y=3.8541+0.7211x0.895438.826.61227.922323.8075.0171993.75代森锰锌y=3.9931+0.2301x0.959723718.741325.974.24×1058.78×1093.056×1062.522×1013腈菌唑y=4.8181+0.3735x0.96583.070.8411.178281.69846.1581057.77菌核净y=3.8312+0.9841x0.963315.415.4843.27308.9481.831166.34苯菌灵y=3.5263+1.0353x0.969226.5110.6865.81458.42123.961695.37噁霉灵y=3.2040+0.8351x0.9619141.4643.75457.404844.35522.5344911.78
栽种后40 d调查甘薯苗期根腐病的发生情况,结果表明:各个药剂处理甘薯苗期根腐病的病情指数均低于清水对照的,其中施用50%咪鲜胺锰盐可湿性粉剂的效果最好,病情指数最低,为27.92%,与对照差异显著。收获时的调查结果表明:1000亿个/g枯草芽孢杆菌的防效最好,与对照差异显著;其余两个处理之间防效无显著性差异(表2)。收获时调查发现,所有处理的发病植株占100%,仅发病程度不同。

表2 栽种40 d和收获时甘薯根腐病的病情指数
3 讨论
甘薯根腐病是由多种病原菌引起的,且不同病原菌之间存在致病差异性[9],因此在不同地区甘薯根腐病菌有不同的优势种群。银铃等[11]从内蒙古根腐病样中分离获得了45个腐霉菌株,其中43个菌株被鉴定为终极腐霉(P.ultimumvar.ultimum)。1924年Harter报道了美国新泽西、马里兰等地区甘薯苗期根腐病是由腐霉菌引起的[17]。Scruggs等发现美国北卡罗来纳州贮藏期甘薯根腐病是由6种镰刀菌引起的,其中茄病镰孢菌是主要的一种病原菌[18]。李凌燕等[10]发现北京大兴甘薯根腐病是由尖孢镰孢菌引起的。准确鉴定病原菌种类,明确病菌的优势种群对了解当地病害流行规律及有效防控该病害、培育当地抗性品种具有重要意义[18-19]。本研究通过2013年和2017年甘薯根腐病鉴定,发现徐州市甘薯根腐病病原主要为尖孢镰孢菌,其次为茄病镰孢菌,并且两年两种病原菌种类所占比例几乎没有发生变化。
尖孢镰孢菌普遍存在于自然界中,是重要的土传病害,也是多种作物的重要致病菌[19-21]。对镰刀菌的防治研究主要集中在生物控制[22-23],在实际病害防治应用中,一般使用化学药剂。赵永强等[24]采用生长速率法测定了6种生物源杀菌剂对甘薯根腐病菌的室内抑菌毒力,认为四霉素和中生菌素在甘薯根腐病防治中具有较高的潜力。马志民等[25]的研究表明,施用钾肥可以降低甘薯根腐病的病情指数,明显提高防治效果,但当硫酸钾浓度超过2 mg/L时会抑制甘薯根系的发育。本研究通过室内筛选8种药剂防治甘薯根腐病,发现咪鲜胺锰盐和枯草芽孢杆菌对甘薯根腐病菌的室内抑制效果居前2位,1 μg/mL的防效即可达到50%以上,且其EC50值低,分别为0.0095 μg/mL和0.0001 μg/mL。栽种后40 d田间调查结果表明,咪鲜胺锰盐的施用效果最好,病情指数最低;在收获时,枯草芽孢杆菌的防效最好,但与对照差异不显著;但是这几种药剂对甘薯根腐病的持久防治效果不明显,收获时发病植株均达到100%。因此,在实际生产中可考虑增施有机肥料来提高甘薯的抗性,同时采用两种及以上药剂的复配,与生物防治菌剂搭配使用,从而达到持续有效防治的目的。

