Hepcidin对人非小细胞肺癌H520细胞生长的影响研究①
李 捷 李艳颖 焦江琴 李付广
(河南科技大学第二附属医院医学免疫实验室,洛阳 471000)
肺癌是常见的恶性肿瘤之一,近些年的发病率呈现上升趋势[1]。铁是所有生命细胞基本活动所必需,多种肿瘤发生发展可增加铁的需求量,因此铁被认为是维持肿瘤细胞生长和发展的基本物质[2]。已有研究表明,调节肿瘤铁代谢可影响其生长,降低胞内铁利用可作为治疗肿瘤的一个途径[3]。正常情况下,细胞内铁维持在一个稳定的生理水平,即铁稳定。目前已发现,铁调素(Hepcidin)、膜铁转(Ferroportin)等多个蛋白参与铁转运[4,5]。Hepcidin是一类小分子多肽,主要由肝脏合成分泌,在机体铁代谢平衡中起重要作用,有研究表明,Hepcidin可通过调节其细胞膜上受体Ferroportin,转运细胞内游离铁至胞外,Ferroportin的低表达可使肿瘤细胞产生额外的胞内游离铁,使得肿瘤细胞更具侵袭性,异常表达的Hepcidin引起的铁代谢失衡是肿瘤侵袭转移的基础[6]。最近研究表明,Ferroportin在乳腺癌中表达下调,其表达与预后相关,恢复Ferroportin在乳腺癌细胞表达可明显抑制细胞生长[7]。Hepcidin在非小细胞肺癌组织表达升高,抑制Hepcidin表达可降低肺癌细胞增殖能力[8]。本文旨在研究Hepcidin表达对肺癌H520细胞增殖和凋亡的影响。
1 材料与方法
1.1试剂和仪器 人非小细胞肺癌H520细胞购自中国科学院上海生科院细胞资源中心。RPMI1640培养基、青霉素、链霉素及FBS均购自美国Gibco;CCK8试剂购自日本DOJINDO;凋亡试剂盒购自江苏凯基;Hepcidin试剂及Ferroportin抗体均购自美国Sigma;Hepcidin及GAPDH抗体均购自美国CST;流式细胞仪购自美国Beckman-Coulter;酶标仪购自美国ThermoFisher。
1.2方法
1.2.1细胞培养 H520细胞在含有10%FBS及100 U/ml的青霉素和链霉素的RPMI1640培养基中,于5%体积分数CO2、37℃恒温培养箱中常规传代培养。
1.2.2siRNA设计合成及转染 特异性干扰Hepcidin表达的siRNA及阴性对照siRNA均由上海吉玛公司设计并合成,分别命名为si-Hepcidin及si-Scrabble,序列如下:si-Hepcidin:sense 5′-ACAACAGACGGGACAACUUTT-3′,anti-sense 5′-AAGUUGUCCCGUCUGUUGUTT-3′;si-Scrabble:sense 5′-UUCUCCGAACGUGUCACGUTT-3′,anti-sense 5′-ACGUGACACGUUCGGAGAATT-3′。实验分组:对照组、si-Scrabble组和si-Hepcidin组。转染前1 d接种H520细胞于6孔板,细胞达70%~80%生长融合时,参照LipofectamineTM2000说明制备siRNA-Lip2000复合物,将复合物加入6孔板,对照组加入脂质体,于培养箱内温育4~6 h,吸弃转染液,加含血清的培养基继续培养。按照实验设计的孵育时间收获细胞,进行后续研究。
1.2.3Western blot 提取转染siRNA 的H520细胞总蛋白,BCA法测定蛋白浓度。50 μg/孔蛋白上样,经10%SDS-PAGE,电泳后电转移至PVDF膜,转好的膜用5%脱脂奶粉室温封闭1 h,洗膜,加适量稀释的一抗(1∶500稀释Hepcidin和Ferroportin抗体),4℃孵育过夜,洗膜,加HRP标记的二抗,37℃孵育1 h,洗膜,ECL显影。GAPDH作为内参基因,Image-J软件分析条带灰度值。以Hepcidin与GAPDH蛋白条带灰度值比值作为Hepcidin的蛋白相对表达量。实验重复3次。
1.2.4转染si-Hepcidin后的细胞活力变化 取生长至对数期的H520细胞,将细胞悬液浓度调整为3×104个/ml,每孔100 μl(约3 000个细胞)接种于96孔板,每组设置5个复孔,培养箱内常规孵育24 h,按照上述分组转染siRNA,于转染的24 h、48 h、72 h和96 h,每孔加CCK8试剂10 μl,培养箱常规孵育 2 h,酶标仪在450 nm波长测定各孔吸光度值(A值)。实验重复3次。
1.2.5转染si-Hepcidin后的细胞凋亡率变化 si-Hepcidin干扰H520细胞72 h,收集96孔板中的细胞,离心,倒掉上清液,PBS洗涤沉淀细胞,离心,弃掉上清,500 μl的Binding Buffer悬浮细胞,分别加入Annexin V-FITC及PI各5 μl,混匀,室温、避光反应15 min,1 h内通过流式细胞仪检测。实验重复3次。
1.2.6H520细胞及转染si-Hepcidin的H520细胞胞内铁含量检测 胰酶消化转染si-Hepcidin的H520细胞,将细胞浓度调整为1×106ml-1,取1 ml细胞悬液,每毫升细胞悬液加CA-AM 0.25 nmol/L,于37℃条件下孵育5 min,缓冲液洗涤细胞(含20 mmol/L Hepes及1 mg/ml BSA),除去多余CA-AM,HBSS缓冲液重悬细胞,取1 ml使用酶标仪测定荧光值(A),细胞悬液中加100 mmol/L铁螯合剂BIP,37℃孵育30 min,HBSS缓冲液洗涤及重悬细胞后,酶标仪测定荧光值(B)。实验重复3次。
1.2.7加入Hepcidin对转染si-Hepcidin的H520细胞活力的影响 取生长至对数期的si-Hepcidin H520细胞,胰酶消化,离心,制备成单细胞悬液,并调整终浓度为1.25×105ml-1,分为两组:Hepcidin+组(加500 mol/L的外源性Hepcidin)和Hepcidin-组(不加Hepcidin),接种单细胞悬液于6孔板,常规孵育24 h,胰酶消化细胞,接种单细胞悬液(1×105ml-1)于96孔板,每孔100 μl,每组5个复孔,常规孵育24 h、48 h、72 h和96 h,按照1.2.4方法检测吸光度值(A值)。实验重复3次。
1.2.8加入Hepcidin对转染si-Hepcidin的H520细胞凋亡的影响 分组同1.2.7,细胞凋亡率检测参照1.2.5。
2 结果
2.1转染si-Hepcidin的H520细胞Hepcidin蛋白表达 如图1和表1所示,转染si-Hepcidin的H520细胞Hepcidin蛋白表达明显低于对照组(P<0.05),而转染si-Scrabble的H520细胞Hepcidin蛋白表达与对照组差异无统计学意义(P>0.05)。
2.2转染si-Hepcidin抑制H520细胞活力 CCK8检测si-Hepcidin转染后的H520细胞活力,结果如表2所示,si-Hepcidin转染H520细胞72 h和96 h的细胞活力均明显低于对照组(P<0.05)。
2.3转染si-Hepcidin促进H520细胞凋亡 采用Annexin V-FITC/PI双染法,通过流式细胞仪检测各组细胞凋亡率,结果如图2和表3所示,si-Hepcidin组细胞凋亡率显著高于对照组(P<0.05)。
表1 转染si-Hepcidin的H520细胞Hepcidin蛋白表达
Tab.1 Expression of Hepcidin protein in H520 cells transfected with si-Hepcidin

GroupsRelative expression of Hepcidin proteinControl group0.306±0.032si-Scrabble group0.321±0.036si-Hepcidin group0.085±0.0101)F64.935P0.000
Note:1)P<0.05 vs Control group
表2 转染si-Hepcidin对H520细胞活力的影响
Tab.2 Effect of si-Hepcidin transfection on activity of H520 cells

Groups24 h48 h72 h96 hControl group0.082±0.0100.257±0.0310.692±0.0580.987±0.071si-Scrabble group0.079±0.0110.242±0.0290.681±0.0560.963±0.067si-Hepcidin group0.071±0.0080.212±0.0250.391±0.0421)0.642±0.0621)F1.0211.94731.73224.971P0.4150.2230.0010.001
Note:1)P<0.05 vs Control group

图2 转染si-Hepcidin对H520细胞凋亡的影响Fig.2 Effect of si-Hepcidin transfection on apoptosis of H520 cells
2.4转染si-Hepcidin上调H520细胞Ferroportin表达 如图3和表4所示,Ferroportin在si-Hepcidin组的蛋白表达明显高于对照组(P<0.05)。
2.5转染si-Hepcidin降低H520细胞胞内铁含量 采用免疫荧光法测定各组细胞胞内铁含量,结果如表5所示,si-Hepcidin组胞内铁含量明显低于对照组(P<0.05)。
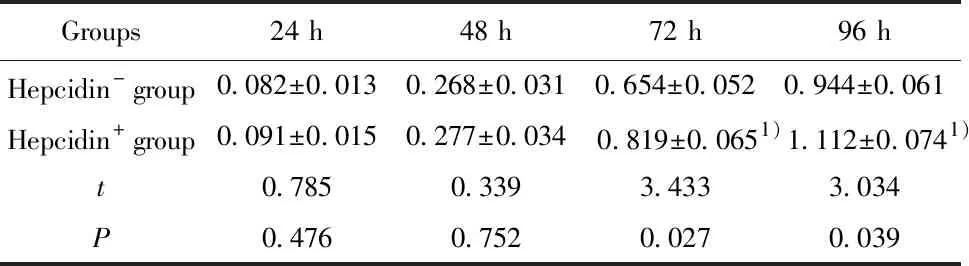
2.6加入Hepcidin可减弱si-Hepcidin对H520细胞活力抑制 如表6所示,加入外源性Hepcidin,si-Hepcidin细胞在72 h和96 h的细胞活力均明显升高,与未加Hepcidin比较差异具有统计学意义(P<0.05)。
表3 转染si-Hepcidin对H520细胞凋亡的影响
Tab.3 Effect of si-Hepcidin transfection on apoptosis of H520 cells

GroupsApoptosis rate (%)Control group2.64±0.28si-Scrabble group2.53±0.25si-Hepcidin group15.43±1.521)F201.938P0.000
Note:1)P<0.05 vs Control group.

图3 转染si-Hepcidin的H520细胞中Ferroportin蛋白表达Fig.3 Ferroportin protein epxression in H520 cells transfected with si-Hepcidin
表4 转染si-Hepcidin对H520细胞Ferroportin表达的影响
Tab.4 Effect of si-Hepcidin transfection on Ferroportin expression in H520 cells

GroupsExpression of Ferroportin proteinControl group0.089±0.010si-Scrabble group0.096±0.011si-Hepcidin group0.461±0.0481)F161.381P0.000
Note:1)P<0.05 vs Control group.
表5 转染si-Hepcidin对H520细胞胞内铁含量的影响
Tab.5 Effect of si-Hepcidin transfection on intracellular iron content in H520 cells

GroupsIntracellular iron contentControl group0.41±0.10si-Scrabble group0.38±0.08si-Hepcidin group0.12±0.041)F12.717P0.007
Note:1)P<0.05 vs Control group.
表6 Hepcidin可减弱si-Hepcidin对H520细胞活力的影响
Tab.6 Hepcidin attenuate effect of si-Hepcidin on H520 cell viability
Groups24 h48 h72 h96 hHepcidin- group0.082±0.0130.268±0.0310.654±0.0520.944±0.061Hepcidin+ group0.091±0.0150.277±0.0340.819±0.0651)1.112±0.0741)t0.7850.3393.4333.034P0.4760.7520.0270.039
Note:1)P<0.05 vs-Hepcidin group.

图4 Hepcidin可减弱si-Hepcidin对H520细胞凋亡的影响Fig.4 Hepcidin attenuate the effect of si-Hepcidin on apoptosis of H520 cells
2.7加入Hepcidin可减弱si-Hepcidin对H520细胞凋亡诱导 如图4所示,加入外源性Hepcidin,si-Hepcidin细胞的凋亡率(7.54±0.51)%明显降低,与未加Hepcidin比较(19.41±0.75)%差异具有统计学意义(P<0.05 )。
3 讨论
铁作为细胞色素、血红蛋白、氧化还原的必要组分,广泛参与能量代谢、DNA合成和表达、氧气输送及细胞周期调控[9,10]。Hepcidin又称为肝脏特异表达抗菌肽,可通过与Ferroportin 1结合,使Ferroportin 1发生磷酸化,进而影响细胞内铁转运,胞内铁富集可影响细胞生长。有研究表明,对铁代谢相关的蛋白调节可影响肿瘤生长,降低胞内铁利用,进而达到抗肿瘤目的[11]。已有研究显示沉默Hepcidin表达可抑制非小细胞肺癌H520细胞增殖[8],本研究旨在研究沉默Hepcidin表达对H520细胞增殖凋亡的影响及机制。
RNA干扰(RNAi)是一种在生物体内广泛存在的自然现象,是由双链RNA介导的在转录后沉默基因表达的一项新技术,目前在肿瘤治疗、基因功能研究等方面有广泛应用[12-14]。本研究通过RNAi技术抑制H520细胞Hepcidin表达,可发现Hepcidin表达明显降低,表明H520细胞中Hepcidin表达受到抑制,这与前人研究结果一致。凋亡是细胞对病理性刺激、环境条件变化等产生的应答有序的死亡过程,是细胞的一种基本特征,在机体组织功能恢复、胚胎生长、内环境稳定等方面发挥重要作用[15]。为了明确Hepcidin对肺癌细胞凋亡的影响,通过Annexin V-FITC/PI双染法检测沉默Hepcidin表达后的H520细胞凋亡率变化,结果显示,Hepcidin表达受到抑制后的细胞凋亡率明显升高。有研究显示,RNAi下调乳腺癌细胞Hepcidin表达,能显著降低细胞生长,诱导细胞凋亡[16]。本研究也证实了同样的结论,提示Hepcidin对肺癌细胞同样有促凋亡作用。
人Ferroportin基因定位于2q32染色体,是Hepcidin发挥铁代谢调节的受体分子,在肝脏、肾脏、脾脏等组织中有广泛的分布,有研究报道,Ferroportin在乳腺癌中表达降低,可作为肿瘤诊断、预后及治疗的新靶向分子[17,18]。本研究结果发现沉默Hepcidin表达后Ferroportin表达增加,胞内铁含量降低。说明在肺癌细胞中Hepcidin通过与Ferroportin结合形成复合物,诱导Ferroportin内化,并在肿瘤细胞胞浆内降低,从而降低Ferroportin在细胞膜上表达量,阻断铁输出,通过代谢途径影响细胞内铁含量,进而影响肺癌细胞功能[19]。此外,本研究对转染si-Hepcidin的H520细胞加外源性Hepcidin,观察细胞活力及凋亡率变化,发现加入外源性Hepcidin可减弱si-Hepcidin对H520细胞活力抑制及凋亡诱导作用。提示高表达Hepcidin可促进肺癌细胞增殖和抑制凋亡,而抑制Hepcidin表达可通过铁代谢抑制细胞增殖和诱导凋亡。
综上所述,高表达Hepcidin可促进肺癌细胞生长,抑制Hepcidin表达可通过调控肺癌细胞铁代谢降低细胞活力和诱导细胞凋亡。本研究提示Hepcidin可能是肿瘤治疗的一个新靶点,为肿瘤治疗提供了新的研究思路及理论基础。

