优良抗氧化能力发酵乳杆菌P13的筛选及其耐逆特性
王 英 董月 夏秀东 李 莹 周剑忠
(江苏省农业科学研究院农产品加工研究所 南京210014)
乳酸菌与人类生活密切,在传统发酵食品中广泛存在,是公认安全的食品级微生物。对乳酸菌的功能特性的研究结果显示,其对人体具有多方面的保健功能,如提高免疫力,缓解乳糖不耐症,调节肠道菌群,增强抗过敏,降低胆固醇,抗炎,延缓衰老等[1-4]。乳酸菌已成为食品与药物等相关产品的主要配料,用于生产功能性发酵食品、保健品或抗衰老药品。
氧化应激(Oxidative Stress)是机体细胞内活性氧中间体的促氧化成分与机体内的抗氧化成分之间的平衡被打破,为一种失调状态[5]。研究表明,氧化应激形成过程中伴随产生自由基、活性氧、活性氮等活性分子,会以不同的机制作用于体内的酶、蛋白质和核酸等生理活性及遗传物质,导致机体产生病变[6-10]。
大量关于乳酸菌体内与体外的抗氧化功能试验研究结果显示,乳酸菌细胞和无细胞提取物在体外具有清除自由基,抑制脂质过氧化,螯合金属离子等活性[11-13]。体内摄入乳酸菌对机体或细胞的氧化应激具有显著的调节作用,能提高体内抗氧化相关功能基因的表达及降低体内过氧化产物的水平[14-16]。
随着生活水平的提高和保健意识的增强,具有抗氧化、提高免疫等相关功能的产品得到广泛关注。本研究顺应目前对功能保健产品和功能乳酸菌的需求,从传统发酵食品中筛选与挖掘具有强抗氧化功能的乳酸菌,旨在为开发针对氧化-还原失衡和氧化应激损伤的功能性产品提供可靠的、具有自主知识产权的乳酸菌菌株资源,具有重要的理论研究和实践应用价值。
1 材料与方法
1.1 材料、试剂与设备
样品:沈阳地区农户家传统酸菜和潮州泡菜。参考菌株:发酵乳杆菌(Lactobacillus rhamnosus)GG ATCC53103,购美国菌种保藏中心。
试剂:1,1-二苯基-2-三硝基苯肼自由基(DPPH·)(Sigma-Aldrich),南京天为生物科技有限公司;吡咯烷二硫代氨基甲酸铵、邻菲罗啉,购自中国医药集团上海化学试剂公司;PCR 用酶、核酸分离试剂、电泳相关试剂与材料,大连宝生物有限公司;QIAamp Stool Mini Kit 核酸提取试剂盒、核酸纯化试剂盒,Qiagen 公司;过氧化氢,华东化学试剂(无锡)公司;L-半胱氨酸盐酸盐、抗坏血酸、N-(乙酰氨基)亚氨基二乙酸二钠盐及其它化学试剂均为分析纯级,南京卓越生物工程有限公司。
仪器与设备:BioRad MyCycler 梯度PCR 仪,南京润亚生物科技发展有限公司;GIS3500 凝胶成像仪,上海培清科技有限公司;UV-1600PC 紫外分光光度计,上海美普达科技有限公司;YS100尼康生物显微镜,南京新兴光学仪器有限公司;124S-CW 分析天平,赛多利斯科学仪器(北京)有限公司;YQX-11 厌氧培养箱,上海跃进医疗器械有限公司;SW-CJ-1C 型双人单面净化工作台,苏州净化设备有限公司;SIGMA3K-15 台式冷冻离心机,北京五洲东方科技发展有限公司;TOMY SX500 自动灭菌锅,日本Tomy Digital Biology 公司。
1.2 方法
1.2.1 乳酸菌分离 利用MRS 和LEE 两种培养基分离发酵蔬菜中的乳酸杆菌 (Lactobacillus)菌株和乳酸球菌(Lactococcus)菌株。
取1 mL 发酵蔬菜汁加入9 mL 无菌生理盐水中,充分混匀后,依次用无菌生理盐水梯度稀释,分别为10-2,10-3,10-4,10-5,10-65 个梯度,各取后3 个稀释梯度的稀释菌液100 μL 涂布于MRS和Lee 培养基平板上,分别将平板倒置于厌氧培养箱和生化培养箱中,37 ℃条件下培养72 h。厌氧条件为N2(85%)、CO2(5%)、H2(10%)。
培养结束后根据菌落形态、大小、颜色等特征尽可能多地挑取单菌落,对获得的纯菌株进行革兰氏染色、接触酶试验,初步筛选出乳酸菌。将分离获得的乳酸菌连续传代5 次以上,筛选出生长状态稳定且生长速度较快的菌株,37 ℃条件下培养至稳定期,保存20%的甘油液体中,在-80 ℃的超低温冰箱中保存,待用。
1.2.2 乳酸菌无菌生理盐水菌悬液制备 将分离的乳酸菌单菌落接种于3 mL 的MRS 液体培养基中,37 ℃条件下培养18~20 h。以此培养液为接种液,按照2%的接种量接种于50 mL 的MRS 液体培养基中,静置培养18 h,获得菌株的培养液。4 ℃,10 000 r/min 离心6 min,收集菌体,无菌生理盐水洗涤2 次后重悬菌体,调整菌体密度为(1.01±0.05)×109CFU/mL,待用。
1.3 体外抗氧化特性测定
1.3.1 乳酸菌分离物清除1,1-二苯基-2-三硝基苯肼自由基 (DPPH·)能力的测定 乳酸菌活细胞对DPPH·清除能力的测定参照文献[17]方法并略有修改,具体操作如下:取2 mL 待测乳酸菌的生理盐水悬浮液,加入2 mL DPPH·溶液 (用无水乙醇溶解配制DPPH,终浓度为0.4 mmol/L),混合均匀,然后置室温遮光反应30 min,8 000 r/min离心10 min,取上清,在波长517 nm 处测定样品的吸光度A对照,测3 次平行值。对照组样品以等体积蒸馏水代替样品溶液,并以等体积蒸馏水和无水乙醇混合液空白调零。清除率按公式(1)计算。
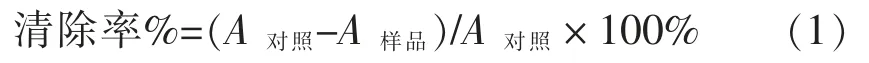
式中:A对照——对照组吸光度;A样品——样品组吸光度。
1.3.2 乳酸菌分离物还原活性的测定 还原活性分析参照文献[18]方法并略有修改,具体操作步骤如下:取0.5 mL 乳酸菌的细胞生理盐水悬浮液,加到1.5 mL PBS 溶液(0.2 mol/L,pH 6.6)中,并加入1.5 mL 1%铁氰化钾溶液,此混合液于50 ℃水浴保温20min,冰水中迅速冷却至室温,再向此混合液中加入1.5 mL 10%三氯乙酸(TCA)溶液,充分混匀后,8 000 r/min 离心10 min 去除蛋白等沉淀物质,取2 mL 上清液,向其中加入2 mL 生理盐水,同时加入1 mL 0.1% FeCL3溶液,充分震荡使其混合均匀,静置孵育10 min 后在波长700 nm处测定反应体系的吸光值。其结果采用L-半胱氨酸作标准物来表述乳酸菌的还原力。
分别配制不同浓度(0~400 μmol/L)的L-半胱氨酸标准溶液,按照上述步骤进行测定,绘制标准曲线。根据测定结果,L-半胱氨酸盐酸盐的标准工作曲线,Y=0.0008x-0.0088,R2=9952。
1.3.3 乳酸菌抗油脂过氧化能力的测定 利用硫代巴比妥酸(TBA)法方法测量脂质过氧化作用。亚油酸乳状液的制备:将0.1 mL 亚油酸,0.2 mL吐温20 加入19.7 mL 去离子水中,0.5 mL 磷酸盐缓冲溶液 (0.02 mol/L,pH 7.4),1 mL 亚麻油酸乳状液,0.2 mL FeSO4(0.01%),0.02 mL 抗坏血酸盐(0.01%)和0.4 mL 乳酸菌生理盐水悬浮液充分混合,37 ℃孵育12 h。将2 mL 上述反应液,0.2 mL 三氯乙酸(TCA,4%),2 mL 硫代巴比妥酸(TBA,0.8%),0.2 mL 二叔丁基对甲酚(BHT,0.4%)充分混合,于100 ℃条件下反应30 min,然后冰上降温,加入2 mL 丁醇进行提取。在532 nm 处测定提取液的吸光值。按照公式(2)计算各菌株的抑制亚油酸过氧化率。
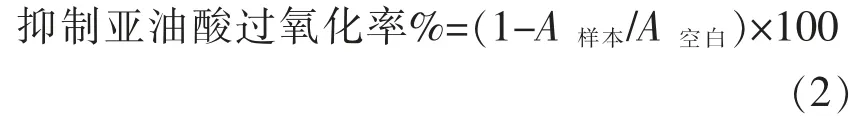
1.3.4 乳酸菌清除羟自由基(OH·)能力的测定利用Fenton 反应体系测定菌液的OH·清除能力,具体方法参照文献[19]并稍作修改,具体操作如下:将1 mL 亮绿(0.435 mmol/L),2 mL 硫酸亚铁(0.5 mmol/L)1.5 mL H2O2(3.0%),1 mL 乳酸菌生理盐水菌悬液混匀后于37 ℃水浴30 min,8 000 r/min 离心10 min,取上清,于波长525 nm 处测吸光度,空白以蒸馏水代替试样。OH·清除率计算公式:
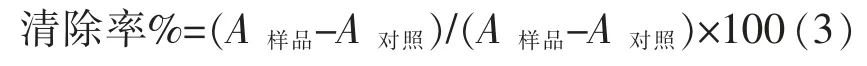
1.4 具有高抗氧化能力菌株P13 的耐逆特性测定
1.4.1 菌株耐酸能力测定 菌株耐酸能力测定方法参照[6]进行,并稍作修改。具体方法如下:分别挑取P13 和ATCC53103 的单菌落,在无菌条件下接种于3 mL MRS 液体培养基中,37 ℃条件下培养16~18 h,按照2%的接种量接种于10 mL MRS液体培养基中,37 ℃条件下培养18 h,离心收集菌体(4 ℃,10 000×g,5 min),用PBS(pH 7.2)缓冲液洗涤两次,然后用PBS 重悬细胞,调整菌体密度为1.01×108CFU/mL,用HCl 调pH 值至2.5,37 ℃静置,分别于0,0.5,1,2,3 h 时取样,样品梯度稀释后,涂布于MRS 平板上,37 ℃条件下培养48~72 h,计算菌株的存活数量。以lg(CFU/mL)表示菌体的数量。
1.4.2 菌株耐胆盐能力测定 菌株的耐胆盐能力测定方法参照[6]进行并稍作修改稍作修改,具体方法如下:分别挑取P13 和ATCC53103 的单菌落在无菌条件下接种于3 mL MRS 液体培养基中,37 ℃条件下培养16~18 h,按照2%的接种量接种于50 mL MRS 液体培养基中,30 ℃条件下培养18 h,离心收集菌体 (4 ℃,10 000×g,5 min),用PBS(pH 7.2)缓冲液洗涤2 次,然后用含有1 mg/mL 的胰酶和0.5%胆盐的PBS(pH 8.0)缓冲液重悬细胞,调整菌体密度为1.01×108CFU/mL,37 ℃静置,分别于0,0.5,1,2,3 h 时取样,样品梯度稀释后,涂布于MRS 平板上,37 ℃条件下培养48~72 h,计算菌株的存活数量。以lg(CFU/mL)表示菌体的数量。
1.4.3 菌株耐过氧化氢能力测定 菌株的耐H2O2能力的方法参照文献[7]、[8]进行并稍作修改,具体方法如下:分别挑取P13 和ATCC53103 的单菌落,无菌条件下接种于3 mL MRS 液体培养基中,37 ℃条件下培养16~18 h,按照2%的接种量接种于50 mL MRS 液体培养基中,37 ℃条件下培养18 h,离心收集菌体(4 ℃,10 000×g,5 min),菌体重悬于含有0.8 mmol/L H2O2的生理盐水中,使菌体密度保持在1.01×108CFU/mL。37 ℃,每隔1 h取样,样品梯度稀释后,涂布于MRS 平板上,37 ℃条件下培养48~72 h,计算菌株的存活数量。以lg(CFU/mL)表示菌体的数量。
1.4.4 菌株耐盐性能测定 在配制的MRS 液体培养基中加入不同质量的NaCl 固体,使其质量浓度分别为2,4,6,8,10 g/100 mL 和12 g/100 mL,于121 ℃高压蒸汽灭菌20 min 后,冷却至37 ℃以下备用。分别挑取P13 和ATCC53103 的单菌落,无菌条件下接种于3 mL MRS 液体培养基中,37℃条件下培养16~18 h,将活化后的菌液接种到上述MRS 培养基中,保持相同的初始密度 (1.01±0.01)×107CFU/mL,37 ℃培养24 h,样品梯度稀释后,涂布于MRS 平板上,37 ℃条件下培养48~72 h,计算菌株的存活数量。以lg(CFU/mL)表示菌体的数量。
1.4.5 菌株溶血特性测定 菌株的溶血特性试验方法参照文献[6]进行,稍作修改。具体方法如下:分别挑取新鲜培养的P13 和ATCC53103 的单菌落,在无菌条件下划线接种于含有7%羊血的血平板上,以金黄色葡萄球菌和表皮葡萄球菌为对照,其中金黄色葡萄球菌为β-型,表皮葡萄球菌为γ-型。37 ℃培养72 h,观察溶血圈,菌落周围没有明显变化,其溶血型为γ-型,参照表皮葡萄球菌的溶血现象。在菌落周围有明显的溶血圈的为β-型,参照金黄色葡萄球菌的溶血现象;菌落周围呈现墨绿色为α-型。
1.5 乳酸菌的系统发育分析
16S rDNA 遗传学鉴定的方法参照文献[20]进行。
1.6 数据分析
重复试验3 次,试验结果采用SPSS 13.0 和One-Way(ANOVA)进行统计和显著性分析。
2 结果与讨论
2.1 菌株的分离
利用MRS 和LEE 2 种培养基,从东北酸菜和潮州泡菜中分离出59 种单菌落,经连续转接5次培养,生长稳定且长势良好的菌株有33 株。根据革兰氏染色和接触酶试验结果,初步分离出29株乳酸菌,其中从东北酸菜中分离出16 株,编号分别为S1-1 至S1-16;从潮州泡菜中分离出13株菌,编号分别为P1 至P13。用尼康显微镜观察细胞形态,分离获得的29 株乳酸菌中,仅有4 株球菌,其余都是杆状菌株,且短杆菌占主要优势。
2.2 分离菌株的DPPH 清除能力
Li 等[14]利用体外测定清除·OH.和DPPH·能力的方法对传统发酵食品中的植物乳杆菌(Lactobacillus plantarum) 的抗氧化能力的研究显示,植物乳杆菌C88 具有最高的·OH 和DPPH·的清除能力,清除率分别为44.31%和53.05%。Das 等[15]利用体外测定清除·OH 和DPPH·能力的方法对植物乳杆菌 DM5 的体外抗氧能力的研究显示,在菌体密度为1010CFU/mL 时,DPPH·清除率达到55%,羟自由基的清除率为49%。本研究中初步分离获得29 株乳酸菌,在相同条件下培养相同时间,获得细胞的无菌生理盐水的悬浮液,菌体密度控制为(1.01±0.05)×109CFU/mL。各菌株的清除DPPH·能力见表1。初步分离的乳酸菌菌株都有清除DPPH·的能力,且不同菌株之间清除DPPH自由基的能力存在显著差异,29 株菌的DPPH 自由基清除率在10.81%~73.02%之间。有5 株菌的DPPH 自由基的清除率高于参照菌株,编号分别为S1-13、P1、P4、P10、P13,其中P13 的DPPH·的清除率大于70%。
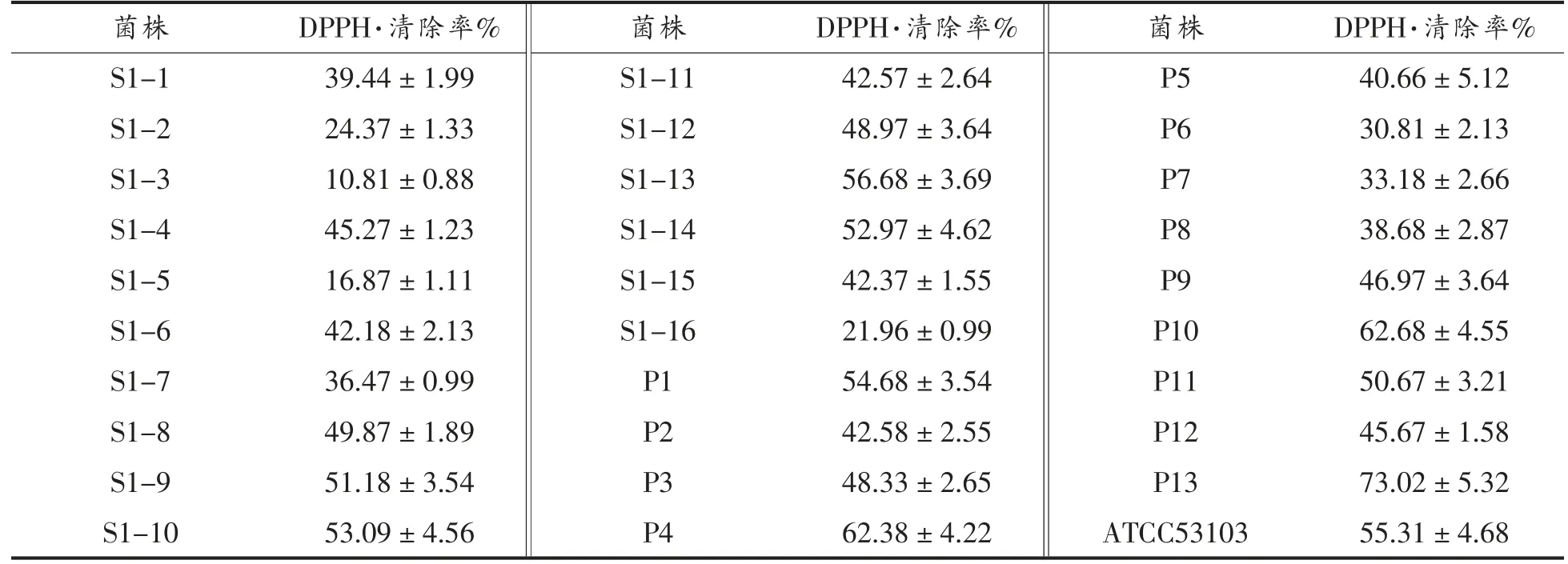
表1 分离菌株的DPPH·清除能力Table 1 Scavenging rates of DPPH of isolated strains
2.3 分离菌株的·OH 清除能力
各分离菌株的·OH 清除能力见表2,可以看出,初步分离的乳酸菌菌株都有·OH 清除能力,而不同菌株之间的·OH 清除能力有显著差异,29 株菌的·OH 清除率在8.13%~59.02%之间,P4 和P13 的·OH 清除率高于参照菌株。
2.4 分离菌株的还原活性
Amanatidou 等[21]用该方法对几株米酒乳杆菌(Lactobacillus sake)的还原活性进行测定,该研究结果显示各菌株间的还原活性存在很大差异,8株菌的还原活性范围在2.7~77.9 μmol/L L-半胱氨酸之间。本研究中的各分离菌株的还原活性见表3,可以看出,初步分离的菌株都具有还原活性,而不同菌株之间的还原活性差异显著,还原活性在34.84~284.02 μmol/L L-半胱氨酸之间。有2株菌的还原活性高于参照菌株,编号分别为S1-13 和P13。采用相同的方法,不同乳酸菌的还原活性差异很大,这可能是由于菌体的生长时期不同其还原活性也不同。另外,菌体的处理方法也会导致菌株之间还原活性的差异。在益生菌株的筛选过程中,应选择公认的具有益生功能的标准参考菌株。
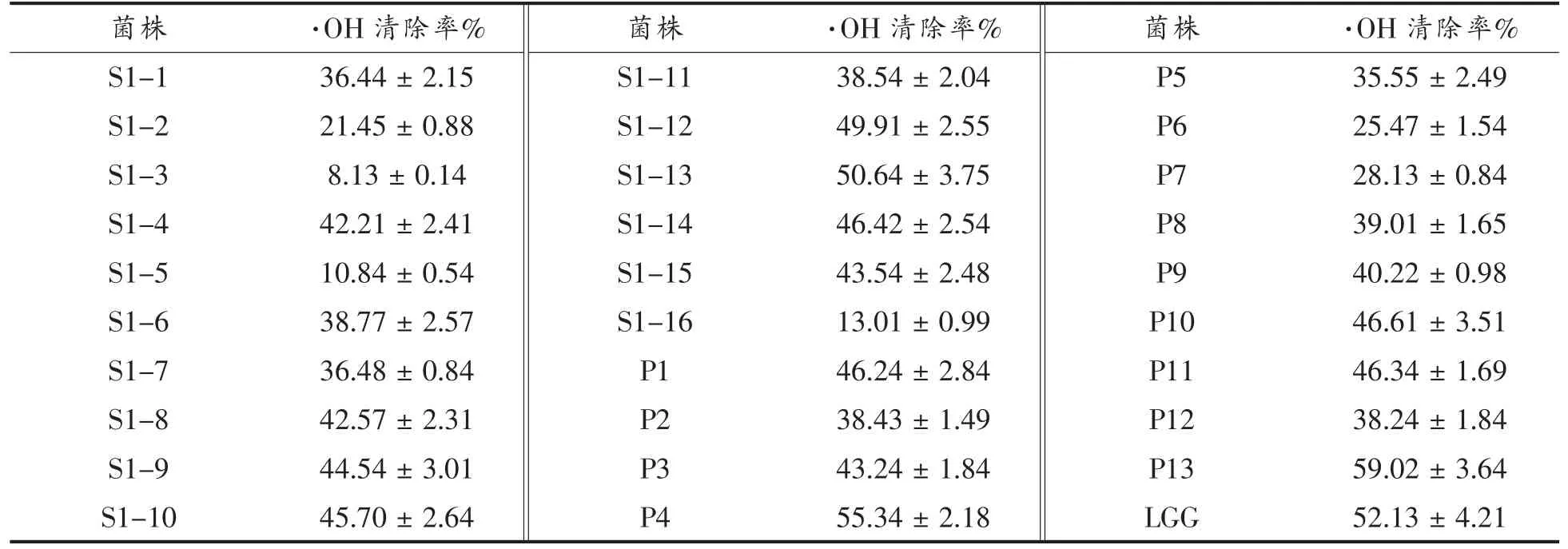
表2 分离菌株的·OH 清除率Table 2 Scavenging rates of ·OH of isolated strains
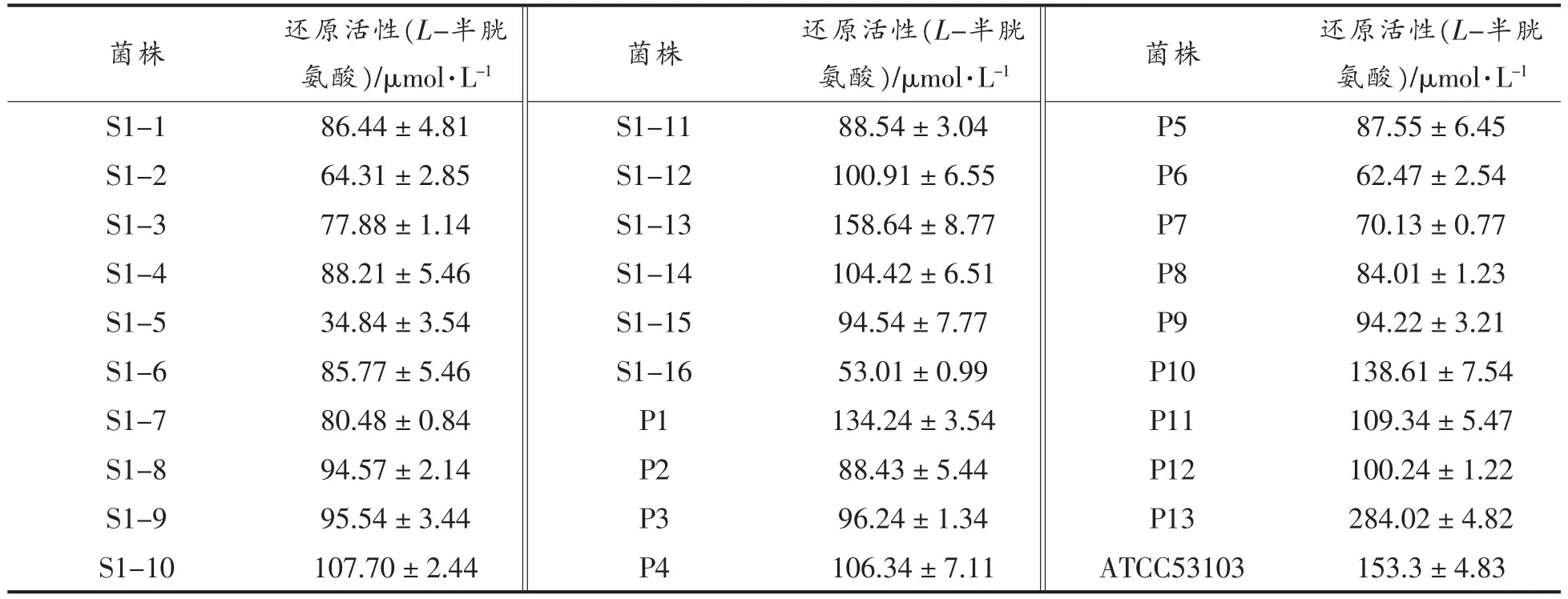
表3 分离菌株的还原活性Table 3 Reducing activities of isolated strains
2.5 分离菌株的抗脂质过氧化活性
各菌株的抗脂质过氧化活性见表4,可以看出,不同菌株的抗脂质过氧化活性差异显著,具有最高活性的菌株P13,其脂质过氧化抑制率达68.88%,抗脂质过氧化活性最低的菌株是S1-3,其脂质过氧化抑制率仅为3.13%。与参照菌株ATCC53103 的抗脂质过氧化活性相比,只有P13的抗脂质过氧化活性高于ATCC53103。综合体外4 项抗氧化指标的测定结果,选择P13 菌株为后续试验的研究对象。
2.6 菌株P13 和ATCC53103 的耐酸性能
正常情况下人的胃酸pH 值3.5~0.9。刚吃完饭后胃酸被稀释到3.5;饭后3 h,胃酸的pH 值降到2.0 以下。作为益生菌,必须能够耐受人体胃中的酸性环境。对菌株P13 的耐酸性能进行测定(图1)。随着在酸性条件下保存时间的延长,菌体密度都呈下降趋势,而P13 对酸的耐受能力高于对照菌株,在pH2 的条件下保存3 h,菌体密度仍能达到7.85×107CFU/mL。本研究结果与许多前人[14-15]研究结果一致。一般来说,来源于传统发酵食品、人体或动物的乳酸杆菌具有较强的耐酸能力(2.5~4.0)。
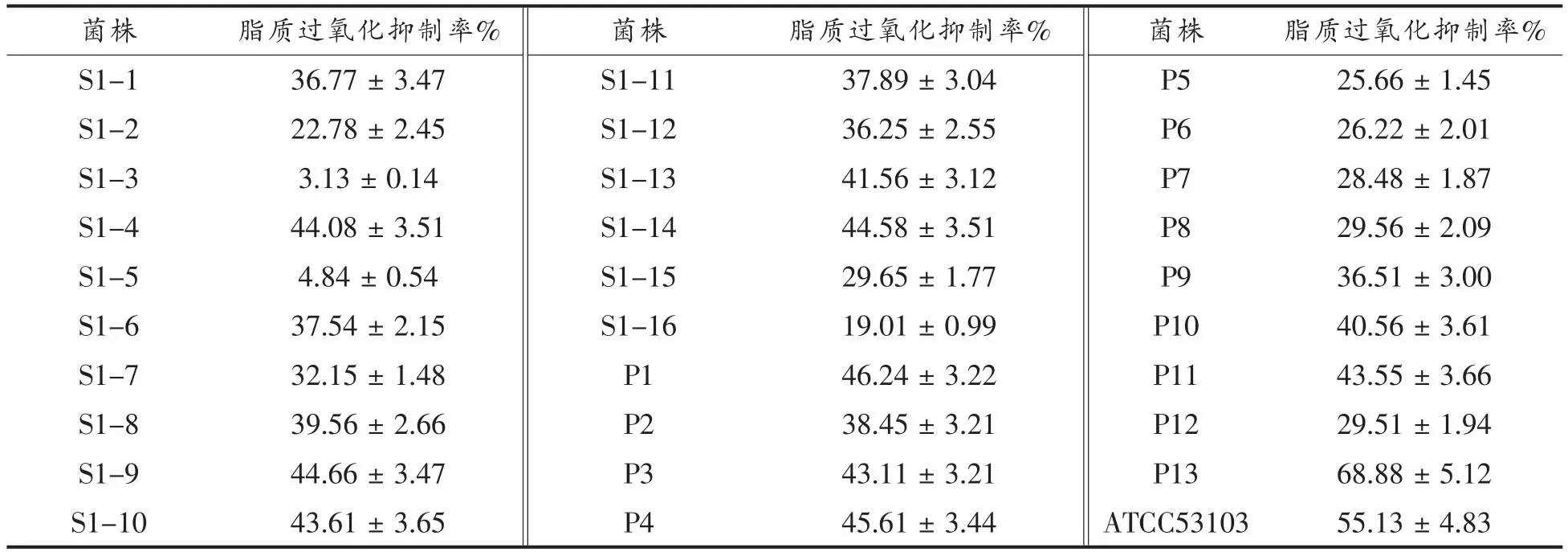
表4 分离菌株的抗脂质过氧化活性Table 4 Inhibition of lipid peroxidation of isolated strains
2.7 菌株P13 和ATCC53103 的耐胆盐性能
对胆盐(Bile salt)的耐受能力也是筛选优良乳酸菌的重要指标之一。人体小肠中胆盐的质量浓度在0.03~0.30 g/100 mL 范围内波动,益生菌要在小肠中发挥益生调节功能,必须耐受一定浓度的胆盐作用[16]。本研究对菌株P13 和ATCC53103在模拟肠液中不同时间的菌体的存活率进行统计(图2),结果显示:随着时间的延长,菌株的存活率呈现下降趋势。菌株不同,对胆盐的耐受能力呈现差异,P13 对胆盐的耐受能力显著高于对照菌株(P<0.05),在肠液中保存6 h 后,活菌数为2.84×106CFU/mL。
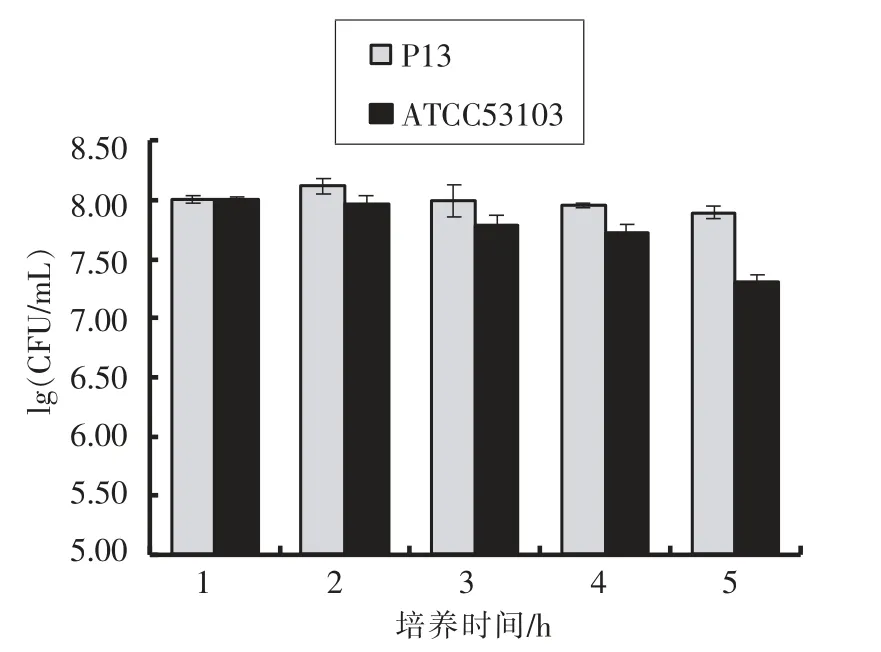
图1 P13 和ATCC53103 的耐酸性能Fig.1 The acid resistance of P13 and ATCC53103
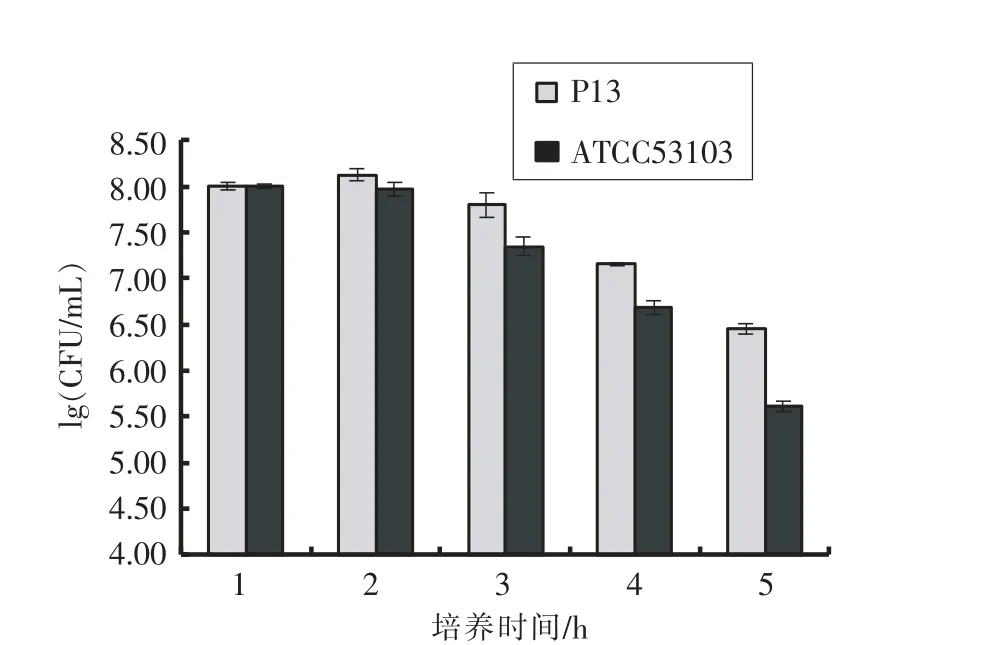
图2 P13 和ATCC53103 的耐胆盐性能Fig.2 The bile salts resistance of P13 and ATCC53103
2.8 菌株P13 和ATCC53103 的耐H2O2 能力
H2O2虽然是一种相对较弱的氧化剂,但是H2O2具有普遍存在性和长效性,对细胞具有直接的氧化损伤,或者作为羟自由基的前体;羟自由基相对于H2O2的活性弱,然而具有更高的氧化损伤能力[18-19]。本研究测定P13 和ATCC53103 在0.8 mmol/L H2O2的生理盐水中不同时间菌体的存活量,试验结果见图3。在相同的H2O2浓度下处理6 h,ATCC53103 的活菌数量为4.41×107CFU/mL,P13 的活菌数量只有3.69×104CFU/mL,下降4 个数量级。
2.9 菌株P13 和ATCC53103 的耐渗透压能力
Machado 等[22]研究表明乳酸菌在高渗的条件下,菌株的疏水性和胆盐敏感性升高。根据Forsyth等[23]的研究,渗透压力和热压力是导致细胞损伤和活力丧失的两个重要因素。Fong 等[24]认为渗透压是细胞生长和发酵的重要限制因子。Desmond等[25]对Lactococcus lactis NZ9800 和L.paracasei NFBC 338 的耐渗透压能力的研究结果显示,在NaCl 含量29%溶液中放置1 h,菌体密度下降了一个数量级。Ferrando 等[26]的研究发现3 株L.plantarum 在NaCl 含量为8%的条件下不能生长,且不同的菌株具有不同的耐渗透压机制。本研究考察了不同NaCl 含量对 P13 和ATCC53103生长的影响,进而判定菌株对NaCl 不同水平的耐受情况,结果见图4。NaCl 含量在0~6%的范围,P13 和ATCC53103 菌体的密度没有明显差异(P>0.05),当NaCl 水平超过6%时,呈现一定的抑制作用。总体来说,P13 的耐NaCl 能力高于ATCC53103菌株,在NaCl 含量为10%时,菌体仍然能够保持生长,菌体密度为2.24×107CFU/mL(接种初始密度为1.01×107CFU/mL),生长受到严重抑制。从耐盐性试验结果来看,P13 具有良好的耐盐特性,在盐量高的食品发酵加工产业中具有较好的应用前景。
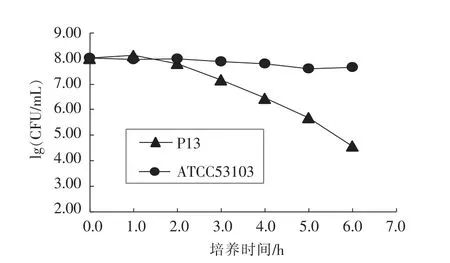
图3 P13 和ATCC53103 的耐过氧化氢性能Fig.3 The H2O2 resistance of P13 and ATCC53103
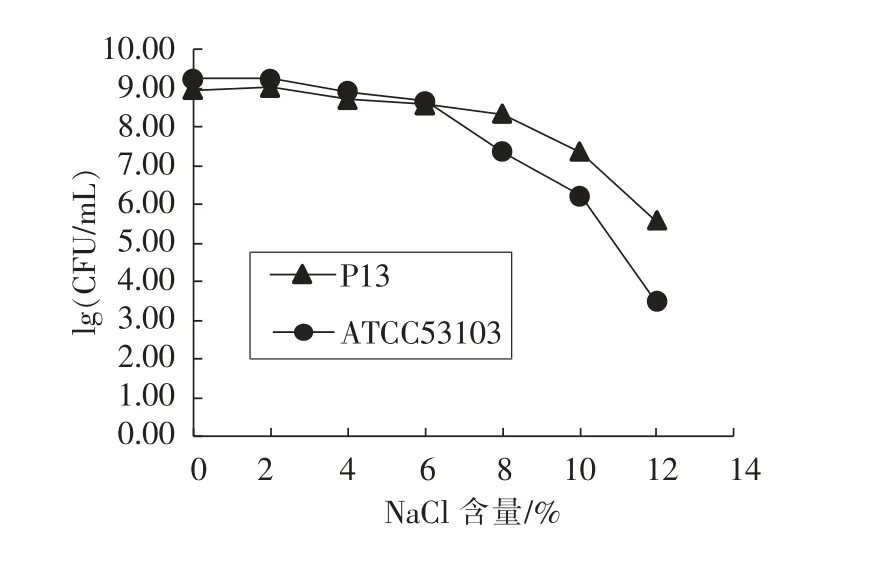
图4 P13 和ATCC53103 的耐NaCl 能力Fig.4 The NaCl resistance of P13 和ATCC53103
2.10 菌株P13 和ATCC53103 的溶血特性
没有溶血活性和抗生素抗性的乳酸菌被认为是安全的[27]。本研究对P13 和ATCC53103 的溶血活性进行了研究,结果显示,P13 和ATCC53103都是γ-型,不具有溶血活性,P13 可作为益生菌在食品加工中安全使用。
2.11 菌株P13 的鉴定
2.11.1 菌株的形态特性 菌株P13 在MRS 平板上培养48 h,菌落成乳白色,表面凸起,湿润,菌落形态比较规则,呈圆形,直径约1.2~1.5 mm,菌体呈典型杆状,且常链状排列,菌体(0.5~0.8)×(2.1~3.5)μm。
2.11.2 菌株的系统发育分析 以P13 的总DNA为模板,以16S 通用引物扩增出目的条带,PCR 产物纯化后送上海生物工程有限公司测序。将获得序列提交NCBI 数据库进行比对,发现其与发酵乳杆菌的相似度最高,达99%。系统分析结果见图5。P13 与发酵乳杆菌(Lactobacillus fermentum)自然聚集一枝,相似性高达99%。根据国际系统细菌委员会规定,16S rDNA 序列差异低于1%~1.5%的细菌属于同一种。根据系统发育分析结果,把P13 鉴定为发酵乳杆菌 (Lactobacillus fermentum)。
3 结论
采用体外抗氧化能力筛选的方法对分离自传统发酵食品中的乳酸菌的抗氧化活性进行测定,以鼠李糖乳杆菌(Lactobacillus rhamnosus)GG ATCC53103 为对照菌株,对分离出的目标菌株进行抗逆性测定,结论如下:
1) 综合4 种体外抗氧化能力测定结果,确定P13 菌株为具有高效抗氧化能力的菌株,经菌落形态和系统发育分析,P13 被鉴定为发酵乳杆菌(Lactobacillus fermentum)。

图5 菌株P13 的系统发育分析Fig.5 Phylogenetic tree based on 16S rDNA sequences of P13
2)与对照菌株鼠李糖乳杆菌GG ATCC53103相比,P13 具有较强的耐逆特性,其耐酸、耐胆盐和耐渗透压能力高于对照菌株,而P13 对H2O2的耐性低于对照菌株。
3) 菌株P13 和对照菌株鼠李糖乳杆菌GG ATCC53103 的溶血型都是γ-型,不具有溶血活性。

