西瓜噬酸菌血红素氧化酶基因hemO功能研究
闫建培 张晓晓 季苇芹 杨玉文 关巍 赵廷昌


摘 要:在生物体中,血红素氧化酶(Heme oxygenase, HemO)在血红素代谢、铁循环和氧化应激等过程中发挥重要作用。在一些病原菌中,血红素氧化酶可参与调控其致病能力。在西瓜噬酸菌(Acidovorax citrulli)中,存在一个编码血红素氧化酶的基因hemO,然而其功能尚未可知。以西瓜噬酸菌Aac5菌株为研究对象,通过基因敲除构建hemO缺失突变体菌株,分析致病力及生物学表型,并检测致病相关基因表达量,初步探究HemO在西瓜噬酸菌中的功能。结果表明,hemO基因缺失会促进菌株生物膜的形成,并导致菌株运动性、生长能力、致病力降低,显著影响致病相关基因的表达,但不影响病原菌诱导烟草过敏性反应的能力。这表明hemO基因参与西瓜噬酸菌的致病力调控过程。
关键词:西瓜噬酸菌; hemO; 致病力
Abstract: Heme oxygenase (HemO) plays an important role in the process of heme metabolism, iron cycle and oxidative stress in living organisms. Heme oxygenase can be involved in the regulation of pathogenicity in some pathogenic bacteria. The hemO gene was identified in Acidovorax citrulli genome. However, the biological function of the gene remains unclear. In this study, the hemO mutant strain was constructed by gene knockout, the pathogenicity and biological phenotype were analyzed, and the expression levels of related pathogenetic genes was detected to explore the function of HemO based on the wild type strain Aac5. The results showed that the deletion of hemO gene promoted biofilm formation, caused the decline in motility, growth ability and pathogenicity, and significantly influenced the expression of related pathogenic genes, but did not affect the ability to induce hypersensitive reaction in non-host Nicotiana tabacum. These results indicated hemO is involved in the pathogenic regulation process of A. citrulli.
Key words: Acidovorax citrulli; hemO; pathogenicity
瓜类细菌性果斑病(Bacterial fruit blotch,BFB)是发生在西、甜瓜等葫芦科作物上的种传细菌性病害,该病害因发生范围广、流行速度快、危害严重等特点,给我国的西、甜瓜产业带来巨大威胁,其病原菌为革兰氏阴性细菌西瓜噬酸菌(Acidovorax citrulli)[1-3]。该病害在致病机制方面的研究较少,而以药剂防治为主的防控手段在防治果斑病方面也较为有限[4-5],因此对该病害致病机制的解析有助于为果斑病的防控提供新的策略。
血红素氧化酶(Heme oxygenase,HemO)首先在真核生物中发现,随后在原核生物中也有该蛋白的报道[6]。它是广泛存在于生物体内的一种微粒体酶,参与细胞内血红素的氧化裂解反应,并产生铁离子、胆绿素(Biliverdin,BV)和一氧化碳[7-8]。该反应是几乎所有生物生理过程中必不可少的,如哺乳动物中铁的再利用和细胞的信号传导,蓝细菌和高等植物中捕光色素的合成,以及细菌对铁的获取等[9]。
在金黄葡萄球菌、铜绿假单胞等动物病原细菌中,血红素加氧酶可影响其致病性[6, 10],但在植物病原细菌中尚未见报道。通过生物信息学分析,在西瓜噬酸菌中存在一个编码血红素氧化酶的基因hemO,但该基因是否会影响西瓜噬酸菌的致病力还需要进一步明确。笔者通过对西瓜噬酸菌基因hemO敲除来探究其对西瓜噬酸菌生物膜、运动性、致病力等多种表型的影响,从而初步解析该基因的作用。
1 材料与方法
1.1 材料
1.1.1 试验菌株、质粒和植物材料 试验所用的菌株及质粒详见表1。西瓜噬酸菌Aac5菌株分离自中国台湾,并由中国农业科学院植物保护研究所蔬菜病害课题组保存。西瓜噬酸菌野生型菌株及其他相关菌株在28 °C条件下培养48 h ,大肠杆菌感受态菌株及相关菌株在37 °C下培养12~18 h。氨苄霉素终质量浓度为100 μg·mL-1;卡那霉素质量浓度为50 μg·mL-1;氯霉素终质量浓度为50 μg·mL-1。西瓜品种为‘中蔬瑞宏,由中国农业科学院蔬菜花卉研究所提供;烟草品种为‘枯斑三生烟(Nicotiana tabacum var. Samsun NN),由植物病虫害生物学国家重点实验室保存。
1.1.2 培养基及试剂 KingB (KB)培养基(胰蛋白胨 20 g,硫酸镁 1.5 g,磷酸氢二钾 1.5 g,丙三醇 15 mL,pH 7.0);LB培养基(胰蛋白胨 10 g,酵母粉 5 g,氯化钠 10 g,pH 7.0);半固体琼脂培养基(细菌蛋白胨 0.3 g,酵母粉 0.3 g,氯化钠 3 g,pH 7.0);M9培养基(十二水和磷酸氫二钠 15.12 g,磷酸二氢钾 3 g,硫酸铵 1 g,柠檬酸钠 2 g,硫酸镁 0.246 g,pH 7.0),将上述培养基加入蒸馏水定容至1 000 mL,然后121 ℃进行高温灭菌20 min(M9培养基用于蔗糖筛选时应加入10%的蔗糖,并于110 ℃灭菌15 min),相应的培养基可加入1.5%的琼脂,即为固体培养基。
试剂:细菌提取试剂盒(百泰克生物公司);质粒小提试剂盒、DNA凝胶回收纯化试剂盒、PCR清洁回收试剂盒(Axygen)、2×Taq PCR Master Mix、SuperReal PreMix Plus (SYBR Green)、FastQuant RT Kit (with gDNase)、DNA Green试剂盒(天根);KOD高保真酶(TOYOBO);Infusion无缝连接酶(诺维赞);相关抗生素(Sigma-Aldrich);试验涉及引物合成和序列测序由北京六合华大基因合成。
1.2 方法
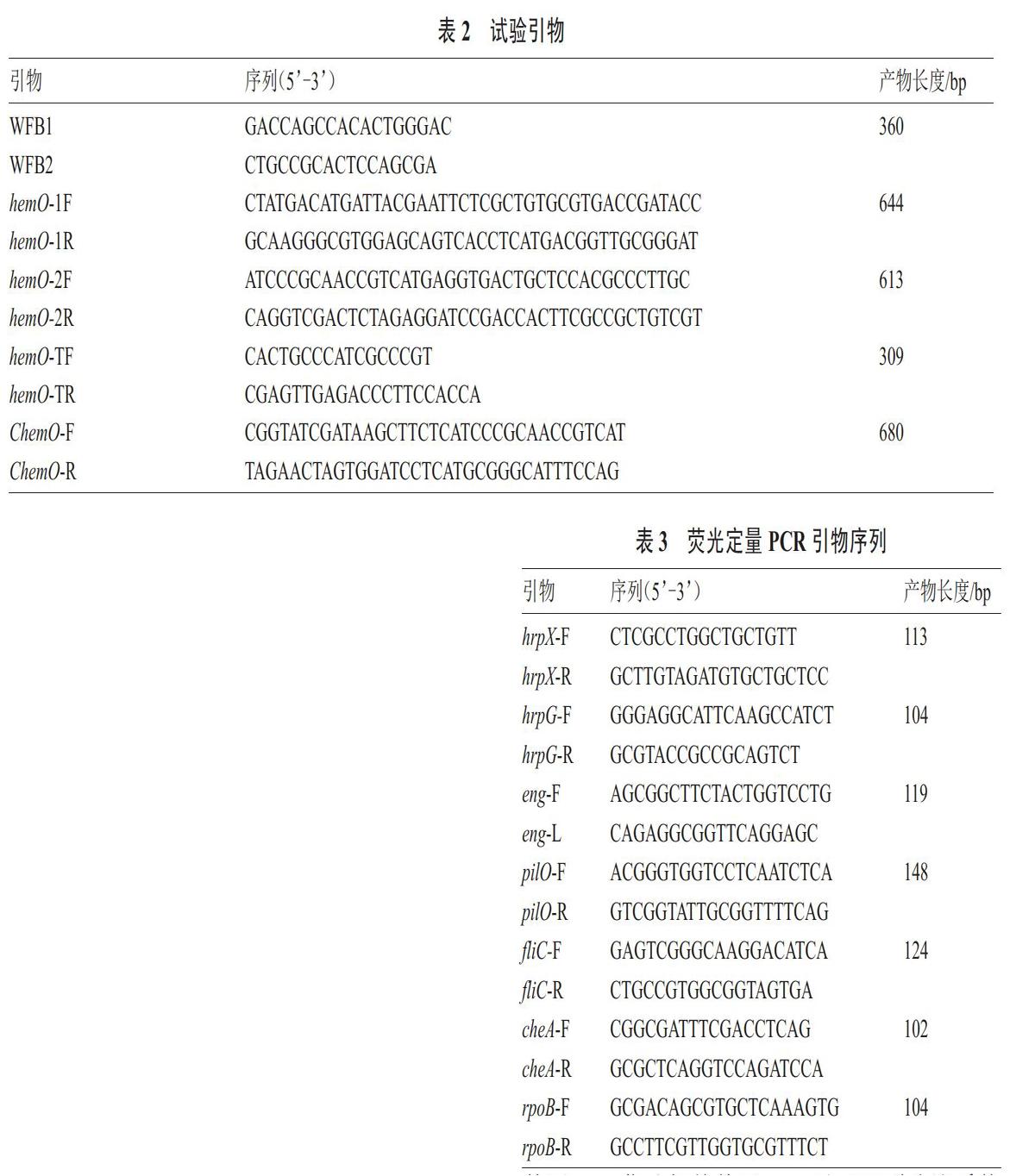
1.2.1 突变体及其互补菌株的构建和验证 通过KEGG数据库获取西瓜噬酸菌基因hemO上下游序列,通过Primer 软件设计引物hemO -1F/R、hemO-2F/R,并用KOD plus NEO克隆hemO左右臂片段,使用overlap PCR[15]连接左右臂片段,将连接产物与自杀性质粒pK18mobsacB连接,构成重组质粒pK18-hemO。利用三亲接合的方法,将重组载体通过助手菌pRK600导入到野生型菌株Aac5菌株中,通过抗生素筛选获得携带有重组载体的野生型菌株Aac5菌株。由于重组载体携带的sacB位点具有蔗糖致死的特性,将经过抗性筛选后的菌株进一步在含10%蔗糖的M9固体培养基上进行筛选,在选择压力的作用下,菌株基因组与质粒的左右臂连接片段发生同源交换,导致hemO基因缺失[16]。使用西瓜噬酸菌特异性引物 WFB1/WFB2[17]及hemO特异性引物 hemO-TF/R进行PCR验证,获得正确的hemO基因缺失突变菌株。
设计引物ChemO-F/R克隆目的基因,并将其连接至载体pBBR1MCS-2,构成互补载体pBBR-hemO。测序验证正确后,将互补载体通过三亲接合的方法导入突变体菌株中,经过氨苄青霉素和卡那霉素抗性筛选,并使用西瓜噬酸菌特异性引物 WFB1/WFB2及hemO特异性引物 hemO-TF/R进行 PCR 验证,获得正确的hemO基因互补菌株(表2)。
1.2.2 致病力测定 将供试菌株(野生型Aac5、hemO缺失突变株及互补菌株)培养至对数期,离心去除培养基成分,用无菌水重悬菌体后,调整菌悬液浓度至104 CFU·mL-1,用1 mL无菌注射器将菌液从叶背注满完全展叶的2周龄西瓜子叶;接种后将西瓜苗置于光照气候培养箱(设定16 h光照、28 ℃,8 h黑暗、16 ℃,相对湿度85%)中培养72 h,每个处理取6片子叶打孔,叶盘面积约为0.5 cm2,用MP研磨仪研磨,将样品悬液逐步稀释,涂布于KB琼脂培养基中,28 ℃ 培养48 h,统计菌落数量[18]。以清水作为阴性对照,试验设置3次重复。
1.2.3 烟草过敏性反应测定 将野生型、突变株及互补菌株培养至对数期,调整菌悬液浓度至108 CFU·mL-1。用注射器注射接种至幼嫩烟草叶片背面,24 h后观察叶片过敏性反应的产生情况[19]。以清水作为阴性对照,每个菌株3个生物学重复,试验设置3次重复。
1.2.4 生物膜形成能力测定 在聚苯乙烯24孔培养板中加入1 mL M9培养基,将野生型、突变体和互补菌株的菌悬液浓度调整至108 CFU·mL-1,取10 μL加入到培养板的培养基中,28℃ 静置培养48 h后倒尽培养液,用无菌水洗去游离的细胞,将培养板置于80 ℃ 固定20 min;然后每孔中加入1 mL 0.1%结晶紫溶液染色45 min;用无菌水清洗 3次后,37 ℃ 烘干;加入1.5 mL的95%乙醇,静置2 h,以溶解生物膜。其后用分光光度计测定各处理溶液于OD575的值[20-21]。每个菌株8个生物学重复,试验设置3次重复。
1.2.5 运动性测定 将野生型、突变株及互补菌株培养至对数期,离心去上清,用无菌水重悬菌体,调整菌悬液浓度至108 CFU·mL-1,各取2 μL轻轻点接于含0.3%琼脂的半固体培养基上,28 ℃正置培养,48 h后统计菌落晕圈直径[22]。每个菌株6个生物学重复,试验设置3次重复。
1.2.6 生长能力测定 将供试菌株在KB液体培养基中28 ℃振荡培养至对数期,将菌悬液浓度调至108 CFU·mL-1,稀释100倍后置于细胞培养板上28 ℃培养,每2 h测1次OD600的吸光度值。每个菌株4个生物学重复,试验设置3次重复。
1.2.7 致病相关基因表达量测定 使用TRizol法提取西瓜噬酸菌Aac5菌株和突变体菌株?hemO的总RNA,將总RNA浓度调为一致后,反转录获得cDNA[23]。以rpoB为内参基因[12],测定菌株内趋化性相关基因cheA、鞭毛相关基因fliC、胞外水解酶基因eng、菌毛相关基因pilQ以及Ⅲ型分泌系统(Type Ⅲ secretion system,T3SS)关键基因hrpG和hrpX的表达量,引物设计见表3。基因表达水平通过2-??Ct法进行计算[24]。
1.3 试验时间及地点
试验在中国农业科学院植物保护研究所蔬菜病害课题组进行,起止时间为2018年3—12月。
2 结果与分析
2.1 突变体及互补菌株获得及验证
通过构建自杀性重组质粒,根据同源重组双交换的原理构建了hemO基因的突变体菌株?hemO。通过西瓜噬酸菌引物WFB1/WFB2验证,突变体菌株可扩增出360 bp的目的条带(图1-A),证明?hemO为西瓜噬酸菌。通过hemO基因特异性引物hemO-TF/R验证,?hemO菌株无法扩增出相应的目的条带(图1-B)。以同样的方法对获得的互补菌株进行验证,互补菌株仍为西瓜噬酸菌,且能扩增出hemO基因的特异性条带。说明hemO基因的突变株和互补菌株已获得。
2.2 hemO缺失减弱西瓜噬酸菌的致病力
在西瓜子叶背面注射野生型菌株、突变体菌株和互补菌株的菌悬液,结果显示,72 h后注射了3个菌株的子叶均出现水浸状病斑(图2-A)。与野生型相比,接种突变体菌株?hemO的西瓜子叶病斑面积较小,通过统计单位面积的菌落数发现,菌落数量要显著少于野生型菌株;互补菌株与突变菌株无显著不同,表明基因的回补未恢复野生型的致病水平(图2-B)。
2.3 hemO缺失不影响菌株烟草过敏性反应
在同一烟叶片上对野生型菌株、突变体菌株和互补菌株的烟草过敏性反应进行检测。结果如图3示,3个菌株均能引起非寄主烟草的过敏性反应。表明基因hemO缺失不影响西瓜噬酸菌引起烟草过敏性反应的能力。
2.4 hemO缺失促进菌株生物膜形成
對野生型菌株、突变体菌株和互补菌株所形成的生物膜进行染色并用乙醇洗脱,通过测定OD575的值来定量生物膜形成能力的强弱。由图4可知,与野生型相比,突变体菌株?hemO的生物膜形成能力显著增强;而互补菌株?hemO-comp部分恢复生物膜的形成能力。
2.5 hemO正调控菌株运动性
在含0.3%琼脂的半固体培养基上对野生型、突变株和互补菌株的游动能力进行测定,以菌落所形成的晕圈直径反映菌株游动能力的强弱。由图5可知,与野生型相比,突变体菌株?hemO所形成的晕圈直径显著缩小,表明hemO基因的缺失减弱了西瓜噬酸菌的运动能力;而互补菌株?hemO-comp所形成的晕圈直径与野生型无显著差异,表明hemO基因的回补恢复了西瓜噬酸菌的运动能力。
2.6 hemO缺失影响菌株生长能力
由图6可知,与野生型相比,突变体菌株?hemO在由对数生长期向平稳期过渡时,生长能力出现下降趋势;而互补菌株与野生型显著性差异不大。表明基因hemO的缺失影响西瓜噬酸菌的生长能力。
2.7 hemO缺失影响致病相关基因表达
通过对基因缺失后的致病相关基因表达量进行测定,结果发现,与野生型菌株相比,在突变体菌株?hemO中,趋化性相关基因cheA、鞭毛相关基因fliC、胞外水解酶基因eng、菌毛相关基因pilQ以及T3SS关键基因hrpG和hrpX,这些与致病力相关的基因均出现显著下调趋势(图7),表明hemO的缺失影响了这些基因的表达。
3 讨 论
血红素氧化酶在生物体内具有抗氧化、铁转运、信号传导等功能,其产物BV也有氧化应激的作用,而一氧化碳可能在胞内信号传导过程中发挥作用。在一些非光和细菌中,血红素氧化酶也可以参与光敏色素发色团的合成。在植物病原细菌中,如丁香假单胞(Pseudomonas syringae)和野油菜黄单胞菌(Xanthomonas campestris)等,血红素氧化酶参与光敏色素BphP的组装过程,有证据显示BphP可以在P. syringae和X. campestris的运动性、生物膜、胞外水解酶以及对寄主植物致病力的调节过程发挥作用[25-27]。
革兰氏阴性细菌内铁离子和血红素具有潜在的毒性,血红素氧化酶对于维持胞内正常的铁离子和血红素动态平衡具有重要意义[28]。动物病原细菌中血红素氧化酶在铁离子和血红素代谢中发挥作用,如在参与铁吸收调控的过程中,铜绿假单胞血红素氧化酶PigA被鉴定与铁吸收调控蛋白(ferric uptake regulator,Fur)同属于一个多顺反子[29];而在革兰氏阳性菌中,金黄色葡萄球菌血红素氧化酶IsdG的转录也同样受到Fur的调控[30]。Fur是全局性的调控因子,也是植物病原细菌重要的致病因子[31-32],正向或负向调控P. syringae和X. campestris多种生理功能[33-34],因此不排除血红素氧化酶可以在植物病原菌致病力调控中发挥重要作用。
为了探究血红素氧化酶对西瓜噬酸菌功能的影响,笔者构建了西瓜噬酸菌血红素氧化酶基因hemO的突变体菌株。研究发现,血红素氧化酶基因hemO缺失后,与野生型相比,西瓜噬酸菌在对数期生长没有显著变化,而在过渡到平稳期时菌量减少,这表明血红素氧化酶在外界环境因素饱和的情况下,可能通过氧化应激调节来参与西瓜噬酸菌的生长增殖过程。与野生型相比,突变体菌株?hemO的游动能力减弱,由于趋化性和鞭毛影响西瓜噬酸菌的游动能力,通过检测发现,相应的趋化性基因cheA和鞭毛素基因fliC的表达量也出现了下调。生物膜的形成能力在基因缺失后出现了上调,可能是由于存在其他如群体感应等信号通路的调控作用。烟草过敏性反应的试验也说明hemO不影响西瓜噬酸菌与非寄主烟草的不亲和互作,烟草叶片组织的受侵部位坏死,限制病菌扩展。同时,西瓜噬酸菌对寄主西瓜的致病力调节也会受到hemO的影响,这一过程中可能涉及多个毒力因子,因为该基因的缺失使得包括鞭毛、菌毛、胞外水解酶和T3SS等的关键基因表达量出现下调,其中胞外水解酶是由Ⅱ型分泌系统(Type II secretion system,T2SS)分泌的重要致病力因子,而hrpG和hrpX是调控T3SS的关键基因。以上结果表明hemO对西瓜噬酸菌致病力的调控机制可能是由这些因素共同参与的。
在此研究中,血红素氧化酶基因hemO在西瓜噬酸菌的致病力等多种生物学表型的调节过程中发挥作用,而血红素氧化酶调控这些过程的分子机制仍不明确,还有待于进一步的解析。
参考文献
[1] BURDMAN S,WALCOTT R.Acidovorax citrulli:generating basic and applied knowledge to tackle a global threat to the cucurbit industry[J].Molecular Plant Pathology,2012,13(8):805-815.
[2] 趙廷昌,孙福在,王兵万,等.哈密瓜细菌性果斑病病原菌鉴定[J].植物病理学报,2001,31(4):357-364.
[3] 阎莎莎.瓜类细菌性果斑病菌种内遗传多样性的研究[D].北京:中国农业科学院,2011.
[4] DUTTA B,GITAITIS R,SMITH S,et al.Interactions of seedborne bacterial pathogens with host and non-host plants in relation to seed infestation and seedling transmission[J].PloS One,2014,9(6):e99215.
[5] JIANG C H,WU F,YU Z Y,et al.Study on screening and antagonistic mechanisms of Bacillus amyloliquefaciens 54 against bacterial fruit blotch (BFB) caused by Acidovorax avenae subsp. citrulli[J].Microbiological Research,2015,170:95-104.
[6] FRANKENBERG-DINKEL N.Bacterial heme oxygenases[J].Antioxidants & Redox Signaling,2004,6(5):825-834.
[7] KIKUCHI G,YOSHIDA T,NOGUCHI M,et al.Heme oxygenase and heme degradation[J].Biochemical and Biophysical Research Communications,2005,338(1):558-567.
[8] RYTER S W,ALAM J,CHOI A M.Heme oxygenase-1/carbon monoxide:from basic science to therapeutic applications[J].Physiological Reviews,2006,86(2):583-650.
[9] WILKS A J A,SIGNALING R.Heme oxygenase:evolution,structure,and mechanism[J].Antioxidants & Redox Signaling,2002,4(4):603-614.
[10] 税芸,刘马峰,程安春.细菌血红素降解蛋白结构特点及作用机制[J].中国生物化学与分子生物学报,2015,31(8):806-814.
[11] YAN S,YANG Y,WANG T,et al.Genetic diversity analysis of Acidovorax citrulli in China[J].European Journal of Plant Pathology,2013,136(1):171-181.
[12] ZHANG X,ZHAO M,YAN J,et al.Involvement of hrpX and hrpG in the virulence of Acidovorax citrulli strain Aac5,causal agent of bacterial fruit blotch in cucurbits[J].Frontiers in Microbiology,2018,9:507.
[13] SCHAFER A,TAUCH A,JAGER W,et al.Small mobilizable multi-purpose cloning vectors derived from the Escherichia coli plasmids pK18 and pK19:selection of defined deletions in the chromosome of Corynebacterium glutamicum[J].Gene,1994,145(1):69-73.
[14] KOVACH M E,ELZER P H,HILL D S,et al.Four new derivatives of the broad-host-range cloning vector pBBR1MCS,carrying different antibiotic-resistance cassettes[J].Gene,1995,166(1):175-176.
[15] ZHANG Y,WEI C,JIANG W,et al.The HD-GYP domain protein RpfG of Xanthomonas oryzae pv. oryzicola regulates synthesis of extracellular polysaccharides that contribute to biofilm formation and virulence on rice[J].PloS one,2013,8(3):e59428.
[16] KVITKO B H,COLLMER A.Construction of Pseudomonas syringae pv. tomato DC3000 mutant and polymutant strains[M]. Methods in Molecular Biology,2011,712:109-128.
[17] WALCOTT R R,GITAITIS R D.Detection of Acidovorax avenae subsp. citrulli in watermelon seed using immunomagnetic separation and the polymerase chain reaction[J].Plant Disease,2000,84(4):470-474.
[18] JOHNSON K L,MINSAVAGE G V,LE T,et al.Efficacy of a nonpathogenic Acidovorax citrulli strain as a biocontrol seed treatment for bacterial fruit blotch of cucurbits[J].Plant Disease,2011,95(6):697-704.
[19] 王健超,袁云云,代园凤,等.西瓜噬酸菌吡哆醛磷酸(VB6)营养缺陷型与致病性相关[J].农业生物技术学报,2013,21(9):1093-1102.
[20] STEPANOVIC S,VUKOVIC D,HOLA V,et al.Quantification of biofilm in microtiter plates:overview of testing conditions and practical recommendations for assessment of biofilm production by staphylococci[J].APMIS,2007,115(8):891-899.
[21] BAHAR O,GOFFER T,BURDMAN S.Type IV pili are required for virulence,twitching motility,and biofilm formation of Acidovorax avenae subsp. citrulli[J].Molecular Plant-microbe Interactions,2009,22(8):909-920.
[22] WANG T,GUAN W,HUANG Q,et al.Quorum-sensing contributes to virulence,twitching motility,seed attachment and biofilm formation in the wild type strain Aac-5 of Acidovorax citrulli[J].Microbial Pathogenesis,2016,100:133-140.
[23] 張爱萍,张晓晓,吴林娜,等.西瓜噬酸菌趋化性及鞭毛素基因 ΔcheAΔfliC 双突变体构建及功能[J].农业生物技术学报,2017,25(11):1838-1850.
[24] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCT method[J].Methods,2001,25(4):402-408.
[25] MCGRANE R,BEATTIE G A.Pseudomonas syringae pv. syringae B728a regulates multiple stages of plant colonization via the bacteriophytochrome BphP1[J].MBio,2017,8(5):e01178.
[26] WU L,MCGRANE R S,BEATTIE G A.Light regulation of swarming motility in Pseudomonas syringae integrates signaling pathways mediated by a bacteriophytochrome and a LOV protein[J].MBio,2013,4(3):e00334-13.
[27] BONOMI H R,TOUM L,SYCZ G,et al.Xanthomonas campestris attenuates virulence by sensing light through a bacteriophytochrome photoreceptor[J].EMBO Rep,2016,17(11):1565-1577.
[28] 程兴军,刘马峰,程安春.革兰氏阴性菌血红素转运系统结构及功能特点[J].生物化学与分子生物学报,2014,30(9):848-855.
[29] OCHSNER U A,VASIL M L.Gene repression by the ferric uptake regulator in Pseudomonas aeruginosa:cycle selection of iron-regulated genes[J].Proceedings of the National Academy of Sciences,1996,93(9):4409-4414.
[30] MAZMANIAN S K,SKAAR E P,GASPAR A H,et al.Passage of heme-iron across the envelope of Staphylococcus aureus[J].Science,2003,299(5608):906-909.
[31] SKAAR E P.The battle for iron between bacterial pathogens and their vertebrate hosts[J].Plos Pathogens,2010,6(8):e1000949.
[32] WANDERSMAN C,DELEPELAIRE P.Bacterial iron sources:from siderophores to hemophores[J].Annual Review of Microbiology,2004,58:611-647.
[33] LIU H,DONG C,ZHAO T,et al.Functional analysis of the ferric uptake regulator gene fur in Xanthomonas vesicatoria[J]. Plos One,2017,11(2):e0149280.
[34] CHA J Y,LEE J S,OH J I,et al.Functional analysis of the role of Fur in the virulence of Pseudomonas syringae pv. tabaci 11528: Fur controls expression of genes involved in quorum-sensing[J].Biochemical and Biophysical Research Communications,2008,366(2):281-287.

