MAH制度下构建药品不良反应损害救济体系的影响因素分析
贾夏怡 朱岩冰 刘佐仁 侯鸿军 杨世民




中圖分类号 R951 文献标志码 A 文章编号 1001-0408(2019)20-2746-06
DOI 10.6039/j.issn.1001-0408.2019.20.03
摘 要 目的:为构建我国药品不良反应损害救济体系提供参考。方法:采用普查法对陕西省内全部217家药品生产企业进行问卷调查。采用Fisher’s精确检验和Pearson χ2检验及多元Logistic回归分析影响我国在药品上市许可持有人(MAH)制度下构建药品不良反应损害救济体系的因素及各因素间的交互作用。结果:本研究共调查药品生产企业217家(发放调查问卷217份),回收209份,筛去无效问卷,共获有效问卷204份,有效回收率为94.01%。经Fisher’s精确检验和Pearson χ2检验筛选出9个独立影响因素,分别为企业上年度营业额、药学技术人员占比、是否设置研发部门、近3年是否取得新药/仿制药批件、是否主动开展药品上市后安全性评价工作、药品不良反应专员对MAH制度中涉及药品不良反应相关政策的熟悉与否、对MAH制度是否促进医药产业发展的认知、MAH全面实施后企业的发展方向、对药品不良反应损害救济缺少法律依据的认知等。上述因素对生产企业对于MAH制度下构建药品不良反应损害救济体系的态度有显著影响,P值均小于0.05。多元Logistic回归分析显示,药品不良反应专员是否熟悉MAH制度中涉及药品不良反应相关政策是MAH制度下构建药品不良反应损害救济体系的主要影响因素(P=0.044),并且与企业是否赞同MAH制度下构建药品不良反应损害救济体系的态度呈正相关(B=1.697)。结论:药品不良反应专员熟悉MAH制度中涉及药品不良反应相关政策的药品生产企业更倾向于赞同构建MAH制度下药品不良反应损害救济体系。
关键词 药品上市许可持有人;药品不良反应损害救济体系;影响因素;药品生产企业
ABSTRACT OBJECTIVE: To provide reference for constructing ADR damage relief system in China. METHODS: Questionnaire survey was conducted among 217 pharmaceutical manufacturers in Shaanxi province by census method. Fisher’s exact test, Pearson χ2 test and multivariate Logistic regression analysis were used to analyze the factors effecting construction of ADR damage relief systerm unter marketing authorization holder (MAH) system, and the interaction among various factors. RESULTS: A total of 217 drug manufacturers were investigated in this study (217 questionnaires were sent out). 209 questionnaires were collected and 204 valid questionnaires were screened out with recovery rate of 94.01%. Totally 9 independent influential factors screened by Fisher’s exact test and Pearson χ2 test had a significant impact on the attitude of building ADR damage relief system under MAH system, i.e. the last year’s earnings of enterprises, the proportion of pharmaceutical technicians, whether to set up R&D departments, whether to obtain new drugs/generic drugs in recent 3 years, whether to actively carry out post-marketing safety evaluation of drugs, whether ADR commissioners are familiar with ADR-related policies in MAH system, cognition about whether MAH system promotes the development of pharmaceutical industry, the development direction of enterprises after the full implementation of MAH, cognition about the lack of legal basis for ADR damage relief (P<0.05). Multivariate Logistic regression analysis showed that whether the ADR specialist was familiar with the ADR-related policies in MAH system was the main influential factor for constructing ADR damage relief system under the MAH system (P=0.044). It was positively correlated with the attitude of approving the construction of ADR damage relief system under MAH system (B=1.697). CONCLUSIONS: The pharmaceutical manufacturers, in which ADR specialists who are familiar with the ADR-related policies in the MAH system, are more inclined to agree to constructing ADR damage relief system under MAH system.
KEYWORDS Marketing authorization holder; ADR damage relief system; Influential factor; Pharmaceutical manufacturer
全国药品不良反应监测网络统计数据显示,近年来我国累计收到《药品不良反应/事件报告表》的数量逐年递增,不良反应/事件报告比例持续增加,严重不良反应报告在2013-2017年间增加了5个百分点,新的和严重药品不良反应/事件报告在2013-2017年间增加了8个百分点[1-2]。我国药品不良反应损害情况不容乐观,由此引发的药品不良反应纠纷日益增多,建立药品不良反应损害救济体系迫在眉睫。
MAH制度通常指拥有药品生产技术的药品研发机构、科研人员、药品生产企业等主体,通过提出药品上市许可申请获得药品上市许可批件,并对药品质量在其整个生命周期内承担主要责任的制度[3]。纵观西方发达国家及我国台湾地区,药品上市许可持有人(Marketing authorization holder,MAH)制度(以下简称“MAH制度”)下药品不良反应损害救济体系并无统一模式,都是根据自身特点而设计的。例如,美国和德国利用市场力量,建立了完善的商业保险制度来进行药品安全风险防控[4-5];日本和我国台湾地区则采取药品不良反应损害救济基金制度[6-7]。然而,我国关于药品不良反应的法律法规尚不健全,现有的《药品不良反应报告和监测管理办法》仅在药品不良反应的报告及监测制度方面作了规定,缺乏医疗事故、医疗诉讼和药品质量事故处理的依据[8];同时,由于没有法定的鉴定机构,在处理药品不良反应纠纷案件时,责任追溯困难,使得药品不良反应损害救济体系的研究及建立浅尝辄止。
自2015年MAH制度在我国10个省市试点起,其效果显著,使得我国药品不良反应损害救济体系的建立可期。由于MAH是药品全生命周期的第一责任人,当发生药品不良反应时,患者的损害救济及赔偿问题有源可溯,因而MAH制度的全面实施将为我国药品不良反应损害救济体系的建立提供适宜的政策环境。本研究基于药品生产企业视角,对MAH制度下构建药品不良反应损害救济体系的影响因素进行分析,旨在为构建我国药品不良反应损害救济体系提供参考。
1 对象与方法
1.1 调查对象
采用普查的方法对陕西省内所有217家药品生产企业进行问卷调查。问卷调查以电子邮件形式发送至药品生产企业负责不良反应的相关人员。调查时间为2019年1-3月。
1.2 问卷内容及回收
采用自行设计的问卷进行调查,问卷内容主要包括两部分,即MAH制度下药品不良反应损害救济体系构建内容及影响因素分析。本研究旨在探讨影响因素,因而本文仅罗列问卷中涉及影响因素分析的题目,详见表1。经检验,调查问卷的Cronbach’s α值为0.788,表明问卷信度可接受;问卷的KMO值为0.679,P<0.05,表明问卷效度良好。
1.3 统计学方法
本研究采用SPSS 24.0软件对数据进行分析。采用Fisher’s精确检验和Pearson χ2检验对自变量进行单因素分析,筛选出有统计学意义的自变量后运用多元Logistic回归(无序多分类Logistic回归)分析各自变量的相互影响。P<0.05为差异有统计学意义。
2 结果
2.1 问卷回收情况
本研究共调查药品生产企业217家(发放调查问卷217份),回收209份,筛去无效问卷,共获有效问卷204份,有效回收率为94.01%。
2.2 受访者基本情况
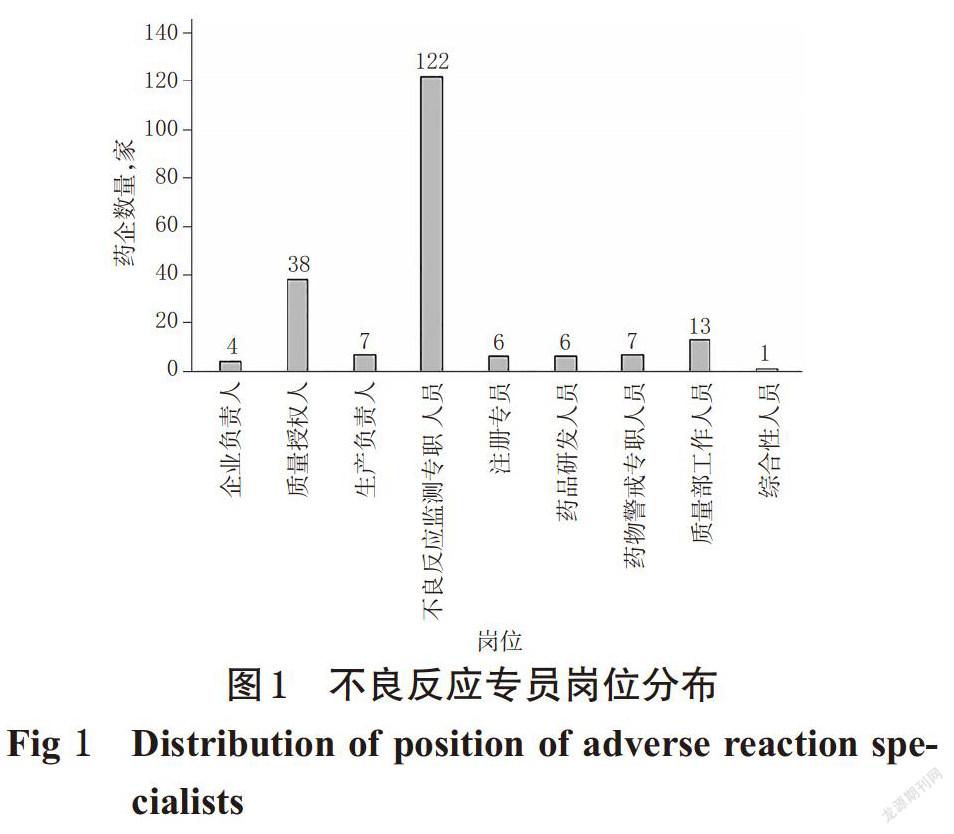
204家生产企业中,涵盖了外资企业、合资企业、国营企业和民营企业,其中民营企业182家,占89.22%;小型企业(从业人员20~299人且营业额在300~<2 000万元)58家、中型企业(从业人员300~999人且营业收入在2 000万元~<4亿元)142家、大型企业(从业人员≥1 000人且营业收入≥4亿元)4家[9];有57.35%的药品生产企业药学技术人员占比在25%以下。我国《药品不良反应报告和监测管理办法》第13条明确规定:“药品生产企业应当设立专门机构并配备专职人员,药品经营企业和医疗机构应当设立或指定机构并配备专(兼)职人员,承担本单位的药品不良反应报告和监测工作”[7]。由图1可见,有155家(75.98%)药品生产企业将药品不良反应工作归职于除生产负责人、质量授权人及企业负责人外的其他人员,其中129家(63.24%)药品生产企业设有药品不良反应、药物警戒专职人员或部门,其余26家(12.75%)药品生产企业将药品不良反应归于注册专员或研发人员等负责。但根据近5年国家药品不良反应监测年度报告数据显示,药品生产企业药品不良反应报告率远低于医疗机构和药品经营企业[1-2]。
2.3 Fisher’s精確检验及Pearson χ2检验结果
以药品生产企业对MAH制度下药品不良反应损害救济体系构建的态度作为因变量,以企业性质、员工数、上年度营业额等12个因素为自变量进行Fisher’s精确检验,结果见表2。此外,由于自变量“是否设置研发部门”不存在预测频数小于5的情况,因此对该自变量进行Pearson χ2检验,结果χ2=22.271,df=2,P=0.000。
由上述检验结果可知,企业性质、员工数、对药品不良反应/事件的赔偿能力、药品上市后是否购买保险对应的P值分别为0.187、0.537、0.252、0.132(均大于0.05),表明上述4个因素对于药品生产企业对MAH制度下构建药品不良反应救济体系的态度并无显著影响。
上年度营业额、药学技术人员占比、近3年是否取得新药/仿制药批件、是否主动开展药品上市后安全性评价工作、药品不良反应专员对MAH制度中涉及药品不良反应相关政策的熟悉与否、对MAH制度是否促进医药产业发展的认知、MAH全面实施后企业的发展方向、对药品不良反应损害救济缺少法律依据的认知、是否设置研发部门对于药品生产企业对MAH制度下构建药品不良反应损害救济体系的态度有显著影响,P值均小于0.05,因此这9个因素为MAH制度下构建药品不良反应损害救济体系的独立影响因素。
2.4 多元Logistic回归分析结果
为进一步分析影响药品生产企业对MAH制度下药品不良反应损害救济体系构建的态度的主要因素,以及上述9个具有统计学意义的自变量之间的相互作用,笔者进一步对上述9个自变量进行了多元Logistic回归分析。根据本研究中因变量及自变量性质,初步采用有序多分类Logistic回归进行数据分析,但经平行线检验,P=0.03(<0.05),表明该方法的参数估算值无意义,因此改用无序多分类Logistic回归进行分析,结果见表3。
根据表3结果,影响药品生产企业对MAH制度下药品不良反应损害救济体系构建的态度的主要因素是:药品生产企业药品不良反应专员对MAH制度中涉及药品不良反应相关政策的熟悉与否。
药品不良反应专员是否熟悉MAH制度中涉及药品不良反应内容相关政策与药品生产企业对构建药品不良反应损害救济体系的态度显著相关。在持赞同态度的药品生产企业药品中,不良反应专员熟悉MAH制度中涉及药品不良反应相关政策的显著性水平P=0.044,并且与企业赞同态度呈正相关(B=1.697),表明药品不良反应专员熟悉MAH制度中涉及药品不良反应相关政策的药品生产企业更倾向于选择赞同态度。此外,药品不良反应专员熟悉相关政策的企业中选择赞同态度者占比是不熟悉相关政策的企业中选择赞同态度者的5.457倍。可见,药品生产企业药品不良反应专员熟悉MAH制度中涉及药品不良反应相关政策是MAH制度下构建药品不良反应损害救济体系的主要影响因素。
3 讨论
本研究基于药品生产企业视角研究了MAH制度下构建药品不良反应损害救济体系的影响因素。企业上年度营业额、药学技术人员占比、是否设置研发部门、近3年是否取得新药/仿制药批件、是否主动开展药品上市后安全性评价工作、药品不良反应专员对MAH制度中涉及药品不良反应相关政策的熟悉与否、对MAH制度是否促进医药产业发展的认知、MAH全面实施后企业的发展方向、对药品不良反应损害救济缺少法律依据的认知这9个因素是MAH制度下构建药品不良反应损害救济体系的独立影响因素。对上述9个独立因素进行交叉分析的结果表明,药品生产企业药品不良反应专员是否熟悉MAH制度中涉及药品不良反应相关政策是MAH制度下构建药品不良反应损害救济体系的主要影响因素。
3.1 上年度营业额
企业上年度营业额与药品生产企业对MAH制度下构建药品不良反应损害救济体系的态度显著相关。年度营业额较高的企业对发生药品不良反应损害之后的赔偿能力较强,具有研发新药的意愿及趋势,对构建药品不良反应损害救济体系更趋于选择赞同态度。
3.2 药学技术人员占比
在调查中发现,陕西省87.74%(179家)的药品生产企业药学技术人员占比集中在10%~50%,多数药品生产企业的药品不良反应专员无医学或临床药学专业背景,对收集到的药品不良反应报告数据的分析不够深入。药学技术人员占比与药品生产企业对MAH制度下构建药品不良反应损害救济体系的态度显著相关,企业的药学技术人员占比越高,对构建药品不良反应损害救济体系更趋于选择赞同态度。
3.3 是否设置研发部门和近3年是否取得新药/仿制药批件
是否设置研发部门和近3年是否取得新药/仿制药批件与药品生产企业对于MAH制度下构建药品不良反应损害救济体系的态度显著相关。设置药品研发部门的药品生产企业对构建药品不良反应损害救济体系更趋于选择赞同态度。进一步对部分药品生产企业的相关人员进行访谈了解到,设置研发部门的企业对药品不良反应的认知更加客观、深入;未设置药品研发部门的企业对药品不良反应存在理解误区,认为药品不良反应会使消费者质疑企业生产的药品质量,从而影响药品的销售状况,而没有意识到及时监测、上报药品不良反应,定期修订药品说明书及标签对于生产企业的保护作用。
3.4 是否主动开展药品上市后安全性评价工作
是否主动开展药品上市后安全性评价工作与药品生产企业对于MAH制度下构建药品不良反应损害救济体系的态度显著相关。本次调查发现,陕西省84.31%(172家)的药品生产企业主动开展药品上市后安全性评价工作,这些企业对于构建药品不良反应损害救济体系更趋于选择赞同态度。药品安全性再评价,是药品上市后再评价的一部分,主要是依据药品上市后的临床安全性研究和不良反应监测,从而对药品在社会人群中的用药风险进行评估和量化[10]。上市后药品的安全性评价可以进一步发掘药品潜在的不良反应与毒性[11]。经对药品生产企业药品不良反应专员访谈可知,通过参加各类培训会议,当前药品生产企业对已上市药品被动和主动监测的意识较强,但仍需提高药品不良反应监测数据的收集和分析质量。
3.5 对MAH制度是否促进医药产业发展的认知
药品生产企业对MAH制度是否促进医药产业发展的认知情况与其对于MAH制度下构建药品不良反应损害救济体系的态度显著相关。本次调查发现,75.00%(153家)的药品生产企业认为MAH制度可以促进医药产业发展,这些企业对构建药品不良反应损害救济体系更趋于选择赞同态度。另有23.04%(47家)的药品生产企业对于MAH制度是否促进医药产业发展持保留意见,这些企业对构建药品不良反应损害救济体系更趋于选择“一般”态度。在MAH制度下,建立药品不良反应损害救济体系可以把单个MAH的风险分散到整个药品行业中,由所有MAH、药品生产企业和整个社会共同承担风险,有利于制药行业提高生产效率,实现稳步、长远的发展[12]。
3.6 MAH全面实施后企业的发展方向
MAH全面实施后企业的发展方向与药品生产企业对MAH制度下构建藥品不良反应损害救济体系的态度显著相关。本次调查发现,陕西省76.96%(157家)的药品生产企业有选择成为MAH的意愿,这些企业对构建药品不良反应损害救济体系更趋于选择赞同态度。其中,39.71%(81家)的企业选择既生产自家品种,又接受其他MAH的委托生产;37.25%(76家)的企业选择只生产自家品种;18.14%(37家)的企业选择成为MAH,将品种委托其他药品生产企业生产。可见,MAH制度为药品生产企业日后转型升级提供了政策指引,部分企业虽具有生产能力却选择委托生产,将重心聚焦于新药研发,以往部分生产企业把批文文号作为资本,以逐利为目的、忽视药品生产安全、低层次重复申报的情况可能有望改善。
3.7 对药品不良反应损害救济缺少法律依据的认知
药品生产企业对药品不良反应损害救济缺少法律依据的认知与其对于MAH制度下构建药品不良反应损害救济体系的态度显著相关。我国现行法律对药品不良反应无明确界定、行政法规也不支持单纯以药品不良反应提起诉讼导致药品不良反应发生后存在责任追溯困难的情况,药品生产和使用单位有时也陷入了无休止的诉讼案件,浪费了大量的社会资源,也不利于保护药品生产企业的创新积极性[13]。因此,多数企业对于药品不良反应损害救济体系构建持赞同态度。
3.8 药品不良反应专员对MAH制度中涉及药品不良反应相关政策的熟悉与否
药品不良反应专员熟悉MAH制度中涉及药品不良反应相关政策的药品生产企业更倾向于赞同构建MAH制度下药品不良反应损害救济体系。近年来,我国药品不良反应监测工作快速发展,已建成覆盖国家、省、地市的三级监测体系,国家药品不良反应监测网络拥有药品生产经营企业和医疗机构等30余万家网络注册用户;但同时,也存在药品生产企业药品不良反应报告意识不强、报告主体责任尚未完全落实等问题。针对这些问题,在MAH试点的过程中,《关于药品上市许可持有人直接报告不良反应事宜的公告》明确了MAH为药品不良反应监测的主体,企业应健全药品不良反应监测体系,指定药品不良反应监测负责人,设立专门机构,配备专职人员等来直接报告药品不良反应[14]。
综上所述,建议药品生产企业从思想上重视药品不良反应,加强对药品不良反应专职人员及企业负责人员关于MAH制度及其中涉及药品不良反应相关知识与政策的培训;合理分配人员,增加具有医学或临床药学专业背景的药品不良反应专职人员数量;强化药品生产企业报告意识,提高企业药品不良反应监测上报率,加强对药品不良反应监测数据的分析评价,及时汇总、提取风险信号并采取应对措施。此外,全面实行MAH制度及在MAH制度下构建药品不良反应损害救济体系应充分参考药品生产企业的意见,对各企业年度营业额、药学技术人员占比、研发能力、取得新药/仿制药批件情况及药品上市后安全性评价工作进行综合考量,对综合能力较强的企业应重点培养成为MAH并首先在这类MAH 中试点实行药品不良反应损害救济体系。
参考文献
[ 1 ] 国家食品药品监督管理总局.国家药品不良反应监测年度报告:2013年[J].中国药物评价,2014,31(4):254- 256.
[ 2 ] 国家药品监督管理局.国家药品不良反应监测年度报告:2017年[J].中国药物评价,2018,35(2):154-160.
[ 3 ] 姚慧.利用商业保险做好风险转移[N].中国保险报,2016-11-09(007).
[ 4 ] Suggested definition and relationships among medicationmisadventures,medicationerrors,adverse drug events,and adverse drug reactions[J]. Am J Health SystePharm,1998,55(2):165-166.
[ 5 ] 陈云,任磊,颜建周,等. MAH制度下日本药品不良反应损害救济基金制度研究[J].中国药事,2017,31(12):1395-1403.
[ 6 ] 徐敢,刘听.浅析我国台湾地区药害救济法及制度借鉴[J].中国医院管理,2006,26(8):13-16.
[ 7 ] 衛生部.药品不良反应报告和监测管理办法[S]. 2011-01-17.
[ 8 ] 何道慧.浅析药品上市许可持有人制度试点对我国医药行业的政策影响[J].北方药学,2017,14(6):150-151.
[ 9 ] 国家统计局.统计上大中小微型企业划分办法[J].轻工标准与质量,2011(5):24.
[10] 班雅倩.药品上市后安全性评价质量评估指标体系研究[D].郑州:河南大学,2014.
[11] 张靖,李红颖,耿兴超,等.药品生命周期管理最新指南介绍与安全性评价的作用浅析[J].中国药事,2018,32(6):770-774.
[12] 易彦辰.我国药品不良反应补偿救济制度研究[D].昆明:云南大学,2012.
[13] 黄登笑,盛红彬,孙姬,等.药物不良反应补偿体系国际比较研究[J].医学与哲学,2008,29(10):23-24.
[14] 国家药品监督管理局.国家药品监督管理局关于药品上市许可持有人直接报告不良反应事宜的公告[S]. 2018- 09-29.
(收稿日期:2019-05-27 修回日期:2019-09-13)
(编辑:孙 冰)

