大孔吸附树脂富集纯化番泻豆荚中番泻苷的工艺研究
李满香 张进芳 陈伟 王黔阳 康冀川 何珺

摘 要:探究大孔吸附树脂富集纯化番泻豆荚中番泻苷的最佳工艺。以番泻豆荚为原料,采用高效液相测定番泻苷A、B含量,以吸附率及解吸率为指标,采用静态吸附试验对5种大孔树脂进行筛选,优选出吸附解吸性能最佳的大孔树脂,并对纯化条件进行优化,确定最佳工艺参数。结果表明:AB-8型树脂对番泻豆荚中番泻苷有较好的吸附及解吸附效果,其最佳工艺为:树脂饱和吸附量按生药计为0.21 g/g,径高比为1∶8,上样流速为1 BV/h,洗脱流速为2 BV/h,以3 BV水除杂,3 BV 30%乙醇洗脱,纯化后产品中番泻苷A、B总含量高达26.05%。结论:AB-8型树脂适合富集纯化番泻豆荚中番泻苷。
关键词:番泻豆荚;番泻苷;大孔吸附树脂;纯化
中图分类号:R284.2
文献标识码:A
文章编号:1008-0457(2019)02-0037-06 国际DOI编码:10.15958/j.cnki.sdnyswxb.2019.02.007
Abstract:To explore the optimal technology for enrichment and purification of sennoside from senna pod with macroporous resin. Methods: The content of sennaside A and B were determined by the HPLC. By using adsorption rate and desorption rate as the indices, five kinds of macroporous resins were screened by the static adsorption test. The best macroporous resin with better adsorption and desorption properties, and the optimal purification conditions of resin were obtained based on static adsorption. Results: Experiment results showed that AB-8 resin possessed high absorption capacity. The best technical parameters were obtained as follows: saturation adsorption capacity of resins 0.21 g/g (equivalent as crude drug), the ratio of diameter to height 1∶8, absorption flow rate 1 BV/h, desorption flow rate 2 BV/h, 3 BV water impurity, eluent with 3 BV 30% ethanol. The total content of sennoside A and B in the purified product were as high as 26.04%. Conclusion: The AB-8 macroporous adsorption resin has the best enrichment and purification efficiency for sennoside from senna pod.
Key words:senna pod; sennoside; macroporous resin; purification
番瀉为豆科决明属的矮小灌木,高1 m左右,有狭叶番泻(Cassia angustifolia Vahl.)和尖叶番泻(Cassia acutifolia Lelile)之分[1],前者主产于印度,后者主产于埃及,我国广东、广西、云南也有引种。番泻叶中含有番泻苷A、B、C、D、大黄酸、芦荟大黄素、芦荟大黄素双蒽醌苷等[2-5]多种有效成分,具有泻下、抑菌、止血、增强平滑肌收缩及肌肉松弛与解痉等作用[6-10]。在番泻的所有部位中,番泻叶是研究开发与应用最主要的部位,番泻豆荚多被忽略,造成资源的浪费,并且我国番泻叶来源主要依靠进口,所以开发新的药用部位以及扩大资源利用是目前亟待解决的任务。李静等[11]研究表明,番泻苷A、B在番泻豆荚中也有,且含量均比番泻叶高。番泻提取物是生产减肥药品的重要原料药,其主要成分为番泻苷A、B,所以提高番泻提取物中番泻苷A、B含量对减肥药生产市场具有重要意义。然而,番泻苷A、B在番泻豆荚中总含量仅为2%左右,所以对番泻豆荚番泻苷A、B富集纯化十分必要。大孔树脂是一类吸附性和筛分性相结合的分离材料,选择性及稳定性高,操作简便、富集效果好,成本低,适宜用于工业化生产[12]。现有研究只对番泻叶番泻苷进行了富集纯化[13-14],但尚未见番泻豆荚中番泻苷A、B富集纯化的相关报道。因此,本文首次采用大孔树脂对番泻豆荚番泻苷A、B进行富集纯化研究,期望为工业生产高含量番泻提取物提供理论参考,同时对拓展番泻药材新的药用部位及扩大药源提供一定的依据。
1 材料与方法
1.1 药材与试剂
干燥番泻豆荚:2017年10月购于广西玉林;对照品:番泻苷A(批号:SEA08030204,纯度≥98%)、番泻苷B(批号:SEB06040102,纯度≥98%),日本药局方标准品;AB-8、DM130、ZX-17、ADS-F8、HPD417型大孔吸附树脂:购于郑州勤实科技有限公司;色谱级甲醇和乙腈:德国MERCK;碳酸氢钠:重庆北培精细化工厂;磷酸:天津市永大化学试剂有限公;水为娃哈哈水(贵阳娃哈哈昌盛饮料有限公司)和蒸馏水。
1.2 仪器与设备
U.S(1100 series)分析型HPLC:Agilent Technology公司;BSA124S和BT25S电子天平:北京赛多利斯科学仪器;电热恒温水浴锅:HH.SY21-Ni6,北京长源实验设备厂;YA·ZD·5型电热蒸馏水器:其他为一般常规仪器。
1.3 番泻苷A、B含量测定方法
1.3.1 色谱条件
色谱柱:Supersil-T C18分析柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.4%磷酸水(20:80);检测波长:340 nm;柱温:25℃;流速:1.0 mL/min;进样量10 μL。
1.3.2 对照品溶液制备
精密称取干燥至恒重的番泻苷A、B对照品各3.06 mg,3.60 mg,置于25 mL棕色容量瓶中,加入含0.1%碳酸氢钠的30%甲醇溶液进行超声溶解,定容至刻度,摇匀,置4℃冰箱中保存备用。
1.3.3 供试品溶液的制备 取番泻豆粉末0.5 g,精密称定置于锥形瓶中,加入0.5%碳酸氢钠50 mL,称定重量,超声处理(功率500 W,频率40 kHz,40℃)30 min,迅速冷至室温,补足原重,摇匀,0.45 μm微滤膜滤过,取续滤液,即得。
1.3.4 标准曲线的绘制
精密吸取混合对照品储备液0.2,0.4,0.6,0.8,1.0 mL 分别置于5 个2 mL容量瓶中,用含0.1%碳酸氢钠的30%甲醇溶液定容至刻度,摇匀,分别进样10 μL,以进样质量浓度为横坐标,峰面积为纵坐标绘制标准曲线,进行线性回归,得番泻苷A的回归方程为y=7610.8 x + 24308(R.2= 0.9997),线性范围为12.24~61.20 μg/mL,番泻苷B的回归方程为y= 6486.3x + 28145(R.2= 0.9997),线性范围为14.40~72.00 μg/mL,结果表明二者线性关系良好。
1.3.5 精密度试验
精密吸取1.3.3项混合对照品储备液10 μL,注入高效液相色谱仪,连续进样6次,记录每次峰面积。结果番泻苷A、B峰面積值的RSD分别为0.23%,0.23%(n=6),表明仪器精密度良好。
1.3.6 重复性试验
精密称取番泻豆荚6份,按1.3.3供试品溶液的制备方法制备样品,分别精密吸取各样品溶液10 μL,注入高效液相色谱仪,记录峰面积,计算各样品中番泻苷A、B的含量。结果番泻苷A、B含量的RSD分别为0.42%,0.71%(n=6),表明方法重复性良好。
1.3.7 稳定性试验
精密称取番泻豆荚1份,按1.3.3供试品溶液的制备方法制备样品,分别于室温(25℃)放置0,4,8,12,24,48 h时进样10 μL,高效液相色谱分析,记录峰面积,分别计算2种样品中番泻苷A、B含量。结果番泻豆荚中番泻苷A、B含量的RSD分别为0.86%,1.18%(n=6),表明该样品制备方法制备的番泻叶及番泻豆荚供试品溶液在48 h内稳定性良好。
1.3.8 加样回收率试验
精密称取番泻豆荚6份,每份准确加入混合对照品储备液2.0 mL,按1.3.3供试品溶液的制备方法制备样品,分别进样10 μL,高效液相色谱分析,记录峰面积,计算各样品中番泻苷A、B的加样回收率。结果番泻苷A、B的平均回收率分别为98.49%,96.37%(n=6),加样回收率RSD分别为0.81%,0.26%(n=6),表明该检测方法回收率良好,符合要求。
1.3.9 上样液的制备
称取干燥番泻豆荚适量,按料液比为1∶15,加入0.5%NaHCO3溶液,在70℃水浴中加热提取2 h,过滤,二次提取,合并滤液,避光8℃保存,备用。
1.3.10 采用外标法计算番泻苷A、B含量
番泻苷A、B含量(mg/mL)=(C标(mg/mL)×A样×0.98)/A标,其中C标为对照品浓度;A样为样品峰面积;A标为对照品峰面积。
1.4 静态吸附筛选大孔吸附树脂型号
1.4.1 大孔树脂预处理[15]
准确称取5种树脂湿重各20 g,先用95%乙醇充分浸泡树脂24 h,再用大量蒸馏水洗涤,洗涤至无醇味。然后用4倍树脂体积量的5%HCl溶液搅拌浸泡3 h除去碱性物质,用蒸馏水洗至中性。再用4倍树脂体积量的5%NaOH溶液搅拌浸泡3 h,除去酸性物质,最后用蒸馏水洗至中性即可使用。
1.4.2 树脂静态吸附-解吸实验
准确称取5种树脂湿重各10.0 g 置于具塞锥形瓶中,分别加入上样液140 mL,置25℃恒温摇床,120 r/min的速率振荡吸附15 h,使番泻苷充分吸附,过滤测定并计算滤液中番泻液苷A、B总含量,将滤过大孔树脂用大量水洗后,转移至具塞锥形瓶中,加入70%乙醇溶液150 mL,置于25 ℃恒温震荡床解吸15 h,使番泻苷充分被解吸,测定并计算流出液中番泻苷A、B总含量。
1.5 AB-8树脂富集纯化番泻苷工艺参数考察
1.5.1 泄露曲线的考察
取900 mL上样液,上50 mL (40.0 g) AB-8树脂柱,每50 mL收集一份流出液,共收集16份,测定并计算解吸液中番泻苷A、B总质量浓度。
1.5.2 上样流速对番泻苷吸附效果的影响
取处理好的50 mL(40.0 g) AB-8树脂各3份,分别湿法装入相同规格的层析柱中,再取3份250 mL等质量浓度番泻苷A、B提取液上柱,并控制上样流速分别为1、2、3 BV/h进行动态吸附,分别收集流出液,测定并计算流出液中番泻苷A、B总含量。
1.5.3 洗脱流速对番泻苷解吸效果的影响
取处理好的50 mL (40.0 g) AB-8樹脂各3份,分别湿法装入相同规格的层析柱中,再取3份250 mL等质量浓度番泻苷A、B提取液均以1 BV/h上柱,分别控制洗脱流速为1、2、3 BV/h进行动态解吸,先水洗至流出液无颜色,记下用水量为3 BV,再用30%乙醇洗脱,分别收集150 mL 30%乙醇洗脱液,测定并计算洗脱液中番泻苷A、B总含量。
1.5.4 洗脱剂浓度的确定
将处理好的100 mL AB-8树脂湿法装柱,上样500 mL,上样流速为1 BV/h,水洗至流出液无颜色,再依次用10%、20%、30%、40%、50%、60%、70%乙醇各3 BV进行洗脱,洗脱流速2 BV/h,分别收集各乙醇洗脱液,测定并计算洗脱液中番泻苷A、B总含量。
1.5.5 洗脱剂用量的考察
将450 mL上样液上100 mL AB-8柱,3 BV水除杂后,用5 BV 30%乙醇洗脱,100 mL收集一份洗脱液,测定并计算洗脱液中番泻苷A、B总含量。
1.5.6 树脂径高比对番泻苷吸附及解吸效果的影响
取3根等规格的树脂柱,湿法装入处理好的AB-8,使径高比分别为1∶4、1∶6和1∶8,上相应比例量的等质量浓度上样液,用3 BV水除杂、再用5 BV 30%乙醇洗脱,收集每1 BV 30%乙醇洗脱液,测定并计算提取物中番泻苷A、B总质量浓度。
1.5.7 工艺验证试验
平行称取番泻豆荚15.0 g三份,按1.3.8方法制得番泻豆荚上样液,按确定的最优纯化工艺,即以AB-8树脂床径高比为1∶8,上样流速为1 BV/h,洗脱流速为2 BV/h上,3 BV水去杂,3 BV 30%乙醇洗脱,收集30%乙醇洗脱液,70℃真空浓缩至干,称重,测定并计算解吸液中番泻苷A、B总含量。
2 结果与分析
2.1 不同树脂静态吸附率及解吸率的比较
由表1可知,在静态吸附饱和状态下,5种树脂中对番泻豆荚番泻苷吸附量最大的是AB-8型大孔树脂,达到9.16 mg/g,是DM130的1.22倍,更明显高于其他3种树脂。同时在静态洗脱中,对番泻苷解吸率最大的也是AB-8,其解吸能力最强。综合吸附及解吸性能分析,选用AB-8型吸附树脂富集纯化番泻豆荚番泻苷。
2.2 泄漏曲线的考察
通过分析图1可知,流份6与流份5相比,番泻苷质量浓度明显升高,即树脂柱出现泄漏现象,此时上样总体积为250 mL,相当于含有8.3 g生药。因此,确定AB-8型大孔吸附树脂对番泻豆荚番泻苷的饱和吸附量为0.21 g/g。
2.3 上样流速对番泻苷吸附效果的影响
通过分析图2可知,随着上样流速的增大,流出液中番泻苷A、B总含量也随之增高,说明高流速上样时目标成分损失大,低流速可使目标成分充分吸附于树脂,综合考虑,选择上样流速为1 BV/h。
2.4 洗脱流速对番泻苷解吸效果的影响
通过分析图3可知,洗脱液中番泻苷A、B总含量最高的是洗脱流速为1 BV/h时,其次是洗2 BV/h时,但是二者相差不大,说明2种洗脱流速下番泻苷解吸充分,而洗脱流速为3 BV/h时,洗脱液中番泻苷A、B总含量极低,说明解吸不完全。综合解吸效果及时间考虑,确定洗脱流速为2 BV/h。
2.5 洗脱剂浓度的确定
通过分析图4可知,当乙醇浓度小于30%时,洗脱液中番泻苷A、B总含量随洗脱剂浓度的增高而增加;当乙醇浓度大于30%时,洗脱液中番泻苷A、B总含量呈下降趋势,40%以及更高浓度乙醇洗脱液中番泻苷A、B总含量甚微,即用30%乙醇就能最大限度将番泻苷解吸完全,故确定最佳洗脱溶剂为30%乙醇。
2.6 洗脱剂用量的考察
通过分析图5可知,第2 BV 30%乙醇洗脱液中番泻苷A、B总含量已达到最大值,第3 BV 30%乙醇洗脱液中番泻苷A、B总含量甚微,说明已基本解吸完全,因此,确定3 BV为30%乙醇洗脱剂最佳用量。
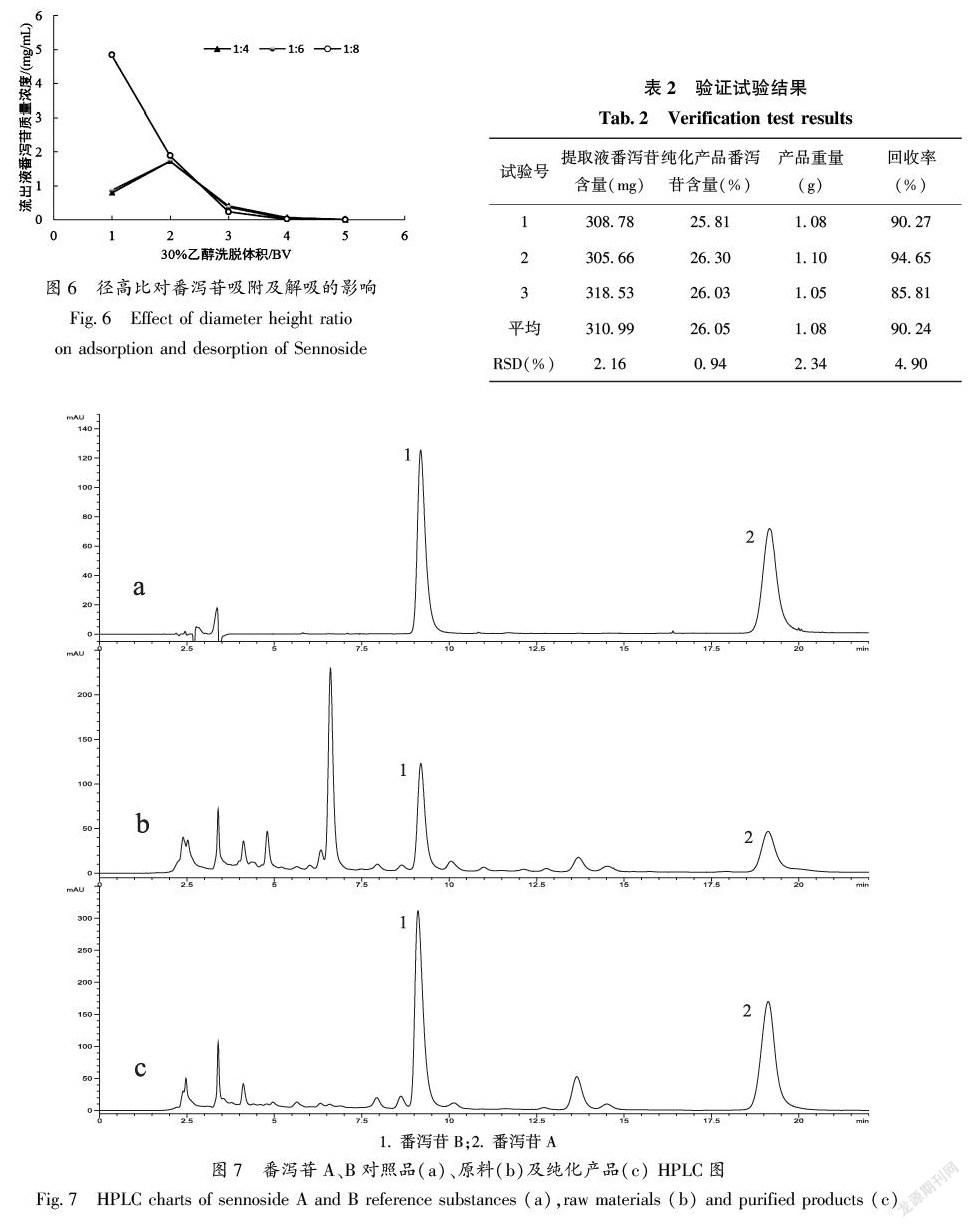
2.7 树脂径高比对番泻苷吸附及解吸效果的影响
通过分析图6可知,当径高比为1∶8时,番泻苷集中被第1、2 BV洗脱剂解吸出来,此时番泻苷质量浓度是径高比为1∶4、1∶6相应量的2倍,这可能是树脂床过短导致目标物质泄漏引起,三者比较,径高比为1∶8时分离效果最好,利于得到高含量产品,因此确定1∶8为最佳径高比。
2.8 工艺验证
由表2可知,富集纯化番泻豆荚中番泻苷平均含量高达26.05%,平均回收率为90.24%。由图7可知,经该工艺的富集纯化后,可得到较高含量的番泻苷提取物,其HPLC图如图7-c,原料HPLC图为7-b,二者图谱对比表明,该工艺能有效去除提取液中部分杂质,使目标成分含量提高,因此,该优化工艺对番泻豆荚番泻苷富集纯化有显著效果,且工艺稳定可靠。
3 结论与讨论
我国番泻来源少,用量大,充分利用现有资源以及提高番泻提取物的含量一直是亟待解决的问题。而大孔树脂富集纯化番泻豆荚中番泻苷的研究尚未见报道,本试验通过静态吸附和解吸附试验研究了5种型号不同的大孔树脂富集纯化番泻豆荚中的番泻苷,结果表明,AB-8型树脂对番泻豆荚番泻苷的吸附和解吸附能力较好,具有良好的富集纯化作用。富集纯化工艺筛选得到的最佳参数如下:树脂对番泻豆荚生药的饱和吸附量为0.21 g/g,上样流速为1 BV/h,洗脱流速为2 BV/h,树脂径高比为1∶8,3BV水去杂,30%乙醇为洗脱溶剂,洗脱溶剂量为3 BV。
大孔树脂分离法与其他纯化方法在富集有效成分方面相比较,具有减少杂质的突出优越性,本论文番泻豆荚番泻苷富集纯化工艺操作温和简便,经济合理,为番泻资源的全面开发与利用提供了技术支持。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典2015年版一部[M].北京:中国医药科技出版社,2015:347.
[2] DEQUEKERR. Some aspects of the chemical determination of the anthracene constituents of senna leaf and tincture[J].Boll Chim Farm,1962,10(1):290.
[3] 孙森凤,张颖颖. 番瀉叶成分及药理作用研究进展[J].山东化工,2017,46(13):44-45.
[4] LEMLI J,TOPPET S,CUVEELE J, et al. Naphthalene glycosides in Cassia senna and Cassia angustifolia[J].Planta Medica,1981,43(1):11.
[5] 毕海林,肖裕章,胡 军,等.番泻叶的研究概况[J].中国兽医杂志,2017,53(4):108-111.
[6] 张 苗,顾 燕. HPLC法在测定番泻总苷胶囊中番泻苷AB含量中的应用[J].现代医药卫生,2015,31(21):3235-3237.
[7] 韩雯雯. 番泻叶抑菌成分的提取分离与抑菌作用研究[D].呼和浩特:内蒙古农业大学,2012.
[8] 黄 娟,张 靖,徐 文,等.番泻叶提取液中番泻苷A、番泻苷B的稳定性考察[J].中国医院药学杂志,2014,34(10):794-797.
[9] 邵 峰,陈慧娟,刘荣华,等.黑顺片总生物碱对番泻叶致小鼠腹泻及大鼠离体小肠平滑肌运动的影响[J].中药材,2013,36(11):1805-1809.
[10] 金施施,牛换云,丁 辉,等.正交实验法优化番泻叶的提取工艺[J].天津中医药大学学报,2016,35(2):122-125.
[11] 李 静,车景超,曲 佳,等.寿国香.HPLC法测定番泻豆荚中番泻苷A和番泻苷B[J].中草药,2007(12):1897-1898.
[12] CHEN Y,ZHANG W,ZHAO T,et al. Adsorption properties of macroporous adsorbent resins for separation of anthocyanins from mulberry[J].Food Chemistry,2016,194(1):712-722.
[13] 张 阳. 大孔吸附树脂分离番泻叶中二蒽酮类化合物的研究[D].天津:天津大学,2006.
[14] 顾 燕,薛 明,刘 萌,等.番泻总苷的纯化工艺研究[J].中成药,2010,32(11):1986-1988.
[15] 仲 冉,何 珺,徐 洋,等.大孔吸附树脂富集纯化罗汉果茎叶中山奈苷的工艺研究[J].食品科技,2018,43 (3):196-200.

