黑皮鸡枞液体菌种发酵罐培养条件的优化
徐宁 冯立国 王春晖 等
摘要:【目的】優化黑皮鸡枞液体菌种发酵罐培养条件,为大规模培养黑皮鸡枞液体栽培菌种及提高黑皮鸡枞菌产量和品质提供参考依据。【方法】采用液体发酵罐培养技术,以黑皮鸡枞液体菌种的菌球直径、均匀度、菌丝干重、漆酶、纤维素酶和多酚氧化酶活性为指标,通过单因素试验和均匀试验,优化碳(C)源、氮(N)源、碳氮添加量比(C/N)、接种量、装液量、培养温度和培养时间,筛选出黑皮鸡枞液体菌种发酵罐培养的最佳培养基和发酵工艺,并开展液体菌种栽培试验。【结果】黑皮鸡枞液体菌种发酵罐培养的最佳培养基为20.0 g葡萄糖+4.0 g高粱粉+3.0 g K2HPO4+1.0 g MgSO4+2片维生素B1+1000.0 mL蒸馏水,pH 6.5;发酵工艺:装液量12 L,接种量12%,培养温度25 ℃,转速90 r/min,培养时间100 h,罐压0.3 MPa,通气量0.9 m3/h。栽培试验结果表明,在最佳培养基和培养工艺条件下获得的液体菌种其栽培黑皮鸡枞菌丝生长速度快,满袋时间为29 d,平均每袋产量约360.0 g,生物学转化率达78.0%。【结论】将液体菌种发酵罐培养技术与工厂化栽培技术有机结合,可实现黑皮鸡枞菌的规模化、标准化、现代化和工厂化生产。
关键词: 黑皮鸡枞;液体菌种;发酵罐培养
中图分类号: S646.9 文献标志码: A 文章编号:2095-1191(2019)02-0344-06
Abstract:【Objective】The culture conditions of fermenting tanks for Oudemansiella raphanipes liquid strain were optimized,which provided reference for large-scale cultivation of liquid culture strains and the improvement of the yield and quality of O. raphanipes. 【Method】Using liquid fermenter culture technology,the ball diameter,uniformity,dry weight of the mycelium,laccase activity, cellulase activity and polyphenol oxidase activity of the liquid strain of O. raphanipes were used as indicators. Through single factor and uniform experiments,optimized carbon(C) source,nitrogen(N) source,carbon and nitrogen add ratio(C/N),inoculum amount,volume of liquid,culture temperature and incubation time, the optimum medium and fermentation process of O. raphanipes liquid strains were screened,and the cultivation experiment of liquid strain was carried out. 【Result】The best medium for fermentation of O. raphanipes liquid strains by fermenter:glucose 20.0 g+sorghum powder 4.0 g+K2HPO4 3.0 g+MgSO4 1.0 g+vitamin B1 2 tablets+distilled water 1000.0 mL,pH 6.5. Fermentation process:liquid content 12 L,inoculation amount 12%,culture temperature 25 ℃,stirring speed 90 r/min,culture time 100 h,tank pressure 0.3 MPa,ventilation volume 0.9 m3/h. The results of the cultivation experiment showed that the mycelium of the O. raphanipes cultivated in the liquid culture under the optimal medium and the optimum process conditions had a fast growth rate,the mycelium full bag time was 29 d,and the average yield each bag was about 360.0 g. The biological conversion rate reached 78.0%. 【Conclusion】It is possible to realize the large-scale,standardized and modern industrial production of O. raphanipes by combining the liquid strain fermenter production technology with the industrial cultivation technology.
Key words: Oudemansiella raphanipes; liquid strain; fermenter culture
0 引言
【研究意义】黑皮鸡枞(Oudemansiella raphanipes)属担子菌亚门、层菌纲、伞菌目、伞菌科,是珍稀且药食用价值极高的食用菌,与松茸、羊肚、黑虎掌同列为我国四大名菌,被誉为菌中之冠(Kirk et al.,2001;Saha,2008;付子艳和李荣春,2009)。目前,液体菌种发酵罐培养技术已广泛应用于食用菌生产,但仍存在菌丝质量差、菌球生产时间长及菌球大小不均匀等缺点。食用菌的菌种质量直接关系到产量和质量,而在实际生产中对黑皮鸡枞液体菌种培养条件尚不完全清楚。因此,优化黑皮鸡枞液体菌种发酵罐培养条件,对实现黑皮鸡枞大规模栽培及提高黑皮鸡枞菌的产量和品质具有重要意义。【前人研究进展】目前,国内关于鸡枞菌液体菌种培养的研究主要集中在摇瓶培养条件筛选等方面,而与发酵罐培养技术相关的研究较少。胡忠策和郑晓冬(2002)对鸡枞菌发酵培养基进行优化,结果表明,当培养基组成为4.29%大米水解糖、0.31% KH2PO4、0.53%酵母粉和pH 4.5时,在28 ℃、150 r/min条件下培养5 d,鸡枞菌的生物量达19.8 g/L。胡尚勤等(2008)研究发现,鸡枞菌菌丝体在碳(C)源为葡萄糖、氮(N)源为氨基酸时,最适C∶N为12~14∶1。罗晓妙(2010)研究表明,利用天然营养培养基筛选出较适宜鸡枞菌菌丝体生长的摇瓶培养基配方为玉米粉20.0 g/L+麸皮10.0 g/L+少量维生素B1(VB1)和维生素C(Vc),在此培养基基础上的培养条件为pH 4.5、温度27 ℃、转速90 r/min。曾先富等(2012)研究发现,在25~33 ℃、pH 6.0~7.0、以葡萄糖为C源、酵母膏为N源的培养基上,鸡枞菌菌丝生长速度快,菌丝粗壮、浓白、致密。熊亚和李敏杰(2013)采用响应面试验研究C源、N源和生长因子对鸡枞菌菌丝体产量的影响,结果表明,在添加20.233 g/L葡萄糖、2.146 g/L蛋白胨和0.149 g/L维生素B6的培养基中菌丝体干重最重。薛林浩等(2013)研究发现,pH、麸皮、玉米粉、大豆粉、K2HPO4和MgSO4对液体发酵的黑皮鸡枞生物量和形态均有较明显影响。徐兵等(2017)研究认为,黑皮鸡枞菌种摇瓶液体发酵最适条件为培养溫度26 ℃、转速175 r/min、pH 7.6、发酵周期25 d。李艳丽(2018)研究发现,秦岭地区野生鸡枞菌菌丝摇瓶液体培养最佳营养条件为2.15%葡萄糖、0.22%酵母膏、20.00%马铃薯、0.27% KH2PO4、0.05% MgSO4·7H2O和0.015%维生素B1;菌丝摇瓶液体培养环境条件为pH 6.0,装液量300.0 mL(500.0 mL三角瓶)、温度26 ℃、转速140 r/min。【本研究切入点】目前,关于利用发酵罐培养技术培养黑皮鸡枞液体菌种的研究尚无文献报道。【拟解决的关键问题】优化黑皮鸡枞液体菌种发酵罐培养条件,以获得可用于大规模栽培黑皮鸡枞的液体菌种,为提高黑皮鸡枞菌的产量和品质提供参考依据。
1 材料与方法
1. 1 试验材料
黑皮鸡枞菌株015由湖南农业大学提供,黑皮鸡枞菌株018由湖南省食用菌研究所提供,黑皮鸡枞菌株016由湖南省微生物研究院提供。
1. 2 试验方法
1. 2. 1 斜面菌种制备 将菌种接于斜面培养基上,25 ℃恒温培养7 d,作为下一步摇瓶培养的菌种。
1. 2. 2 摇瓶菌种制备 于500 mL三角瓶中装入250.0 mL培养基,在121 ℃、0.12 MPa压力下灭菌30 min。冷却后每瓶接入3块1.0 cm2经活化的斜面菌种,25 ℃、90 r/min摇床培养5 d,得到液体菌种。
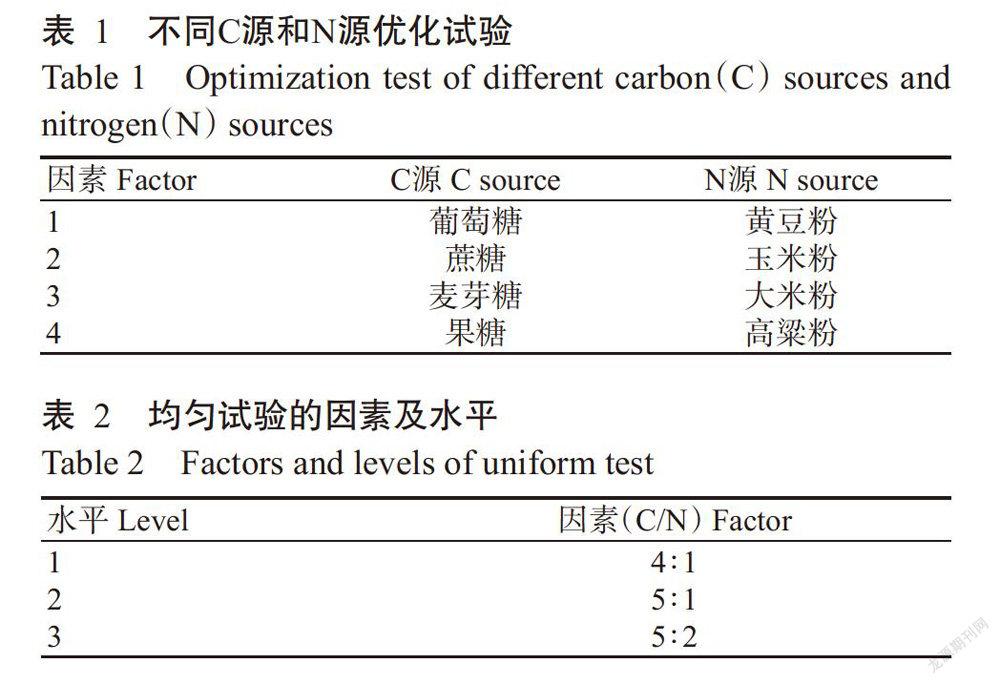
1. 2. 3 液体培养基C源、N源及其添加量比(C/N)优化 基础培养基为3.0 g K2HPO4+1.0 g MgSO4+2片维生素B1+1000.0 mL蒸馏水,pH 6.5。C源优化:在基础培养基中添加4.0 g高粱粉为N源,再分别添加20.0 g葡萄糖、蔗糖、麦芽糖、果糖为C源。采用15 L发酵罐,装液量12 L,接种量12%,转速90 r/min,罐压0.3 MPa,通气量0.9 m3/h,于25 ℃培养100 h后取样观察菌丝长势,测定菌丝生长速度。N源优化:在基础培养基中添加20.0 g葡萄糖为C源,再分别添加4.0 g黄豆粉、玉米粉、大米粉、高粱粉为N源。采用15 L发酵罐,装液量12 L,接种量12%,转速90 r/min,罐压0.3 MPa,通气量0.9 m3/h,于25 ℃培养100 h后取样观察菌丝长势,测定菌丝生长速度。
通过C源和N源的单因子试验(表1),筛选出黑皮鸡枞菌种摇瓶培养最适的C源和N源。采用均匀试验设计,在单因素试验基础上进行C源、N源和C/N优化试验。其因素及水平设计见表2。
1. 2. 4 发酵工艺优化 在最佳培养基的基础上,对发酵罐培养的接种量、装液量、培养温度、培养时间进行优化,以获得黑皮鸡枞液体菌种发酵罐发酵工艺。
采用15 L发酵罐,分别设10、11和12 L 3种装液量,10%、12%和15% 3种接种量,20、25和30 ℃ 3种培养温度和80、100和120 h 3种培养时间。将装有培养基的发酵罐于121 ℃灭菌30 min,冷却后接入摇瓶培养的种子液,加入消泡剂大豆植物油,在转速90 r/min、罐压0.2 MPa、通气量0.9 m3/h条件下培养,获得液体菌种。发酵结束后取样,通过显微镜观察菌液杂菌污染情况、菌丝体形态特征和结构特点及菌液颜色,测定菌丝球直径、菌丝体干重及菌液纤维素酶、漆酶和多酚氧化酶活性。
1. 2. 5 栽培试验 在无菌接种室将发酵罐培养的液体菌种注入栽培袋中,每袋注入3.0 mL后置于20 ℃无菌培菌室培养,菌丝长满菌袋后进行出菇培养。
1. 3 测定指标及方法
1. 3. 1 菌丝体干重测定 将滤纸于60 ℃烘至恒重后过滤菌液,获得菌丝体,菌丝体经蒸馏水洗涤,5000 r/min离心取沉淀,重复数次后抽滤脱水,真空冷冻干燥至恒重后称重,计算菌丝体干重。
1. 3. 2 菌丝球长度测定 随机取菌球20个,排列成直线,测其总长度,重复3次,取平均值。
1. 3. 3 纤维素酶活性测定 参照白燕和王维新(2012)的方法,采用3,5-二硝基水杨酸法测定纤维素酶活性。纤维素酶活性以样品与底物反应30 min后光密度的改变值表示,单位为U。
纤维素酶活性=N×OD值对应的葡萄糖量/30×1
式中,N为酶液稀释倍数,30为糖化所用时间(min),1为反应酶液体积(mL)。
1. 3. 4 漆酶活性测定 参照朱海潇(2008)的方法测定漆酶活性=ΔOD600/mL,单位为U。
1. 3. 5 多酚氧化酶活性测定 参照孙月娥等(2011)的方法测定多酚氧化酶活性,测定时粗酶液稀释20倍。多酚氧化酶活性=ΔOD410/mL,单位为U。
2 结果与分析
2. 1 黑皮鸡枞液体菌种培养基C源、N源和C/N的优化结果
2. 1. 1 不同C源对黑皮鸡枞菌丝生长的影响 由表3可知,不同C源培养的黑皮鸡枞菌丝长势存在差异,生长速度间差异显著(P<0.05,下同),其中以葡萄糖为C源的黑皮鸡枞菌丝生长速度为0.41 cm/d,显著快于以蔗糖、麦芽糖和果糖为C源的黑皮鸡枞菌丝生长速度,且菌丝生长较整齐、浓密、健壮。因此,选取葡萄糖为黑皮鸡枞菌丝培养的最适C源。
2. 1. 2 不同N源对黑皮鸡枞菌丝生长的影响 由表4可知,不同N源培养的黑皮鸡枞菌丝长势存在差异,生长速度间差异显著,其中以高粱粉为N源的黑皮鸡枞菌丝生长速度为0.45 cm/d,显著快于以玉米粉、大米粉和黄豆粉为N源的黑皮鸡枞菌丝生长速度,且菌丝长势最强;以玉米粉为N源的黑皮鸡枞菌丝生长不整齐、菌丝稀疏细弱,生长速度最慢。因此,选取高粱粉为黑皮鸡枞菌丝培养的最适N源。
2. 1. 3 不同C/N对黑皮鸡枞菌丝生长的影响 由表5可知,不同C/N的黑皮鸡枞菌丝鲜重存在差异,其中5号培养基的菌丝鲜重最重,达32.38 g/100 mL,因此最适宜黑皮鸡枞菌丝生长的C/N為5∶1,即在基础培养基中葡萄糖和高粱粉的添加量分别为20.0和4.0 g,黑皮鸡枞液体菌种发酵罐培养的最佳培养基组成为20.0 g葡萄糖、4.0 g高粱粉、3.0 g K2HPO4、1.0 g MgSO4和2片维生素B1。
2. 2 黑皮鸡枞液体菌种发酵工艺的优化结果
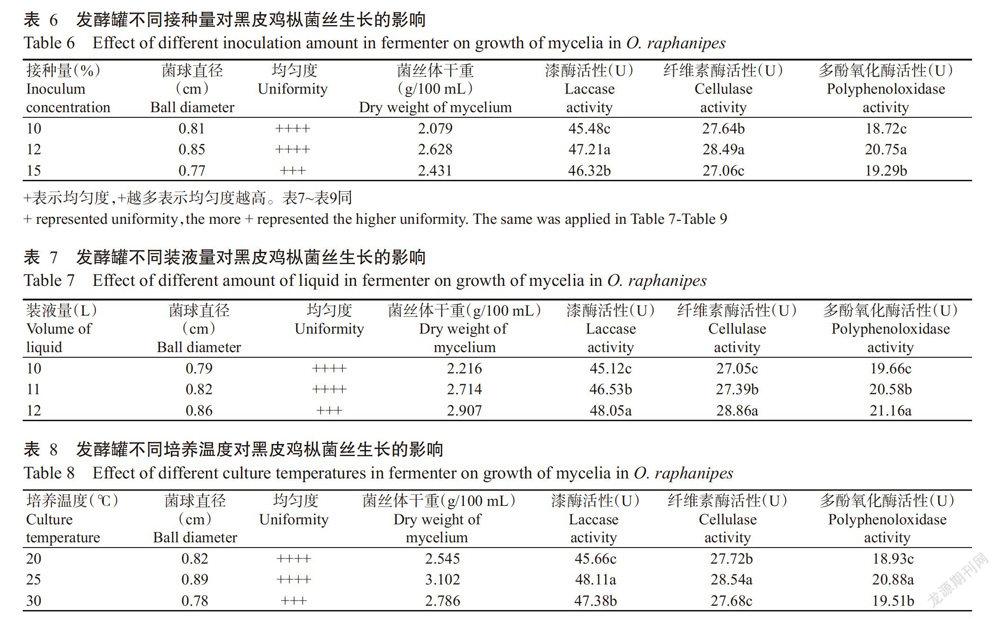
2. 2. 1 发酵罐接种量的优化 由表6可知,各接种量黑皮鸡枞菌丝的漆酶活性、纤维素酶活性和多酚氧化酶活性间均存在显著差异。其中,接种量为12%时,菌球直径最大,为0.85 cm,且大小均匀,其漆酶活性、纤维素酶活性和多酚氧化酶活性均显著高于其他接种量处理。因此,黑皮鸡枞菌丝生长的发酵罐最适接种量为液体摇瓶装液量的12%。
2. 2. 2 发酵罐装液量的优化 由表7可知,各发酵罐装液量黑皮鸡枞菌丝的漆酶活性、纤维素酶活性和多酚氧化酶活性间均存在显著差异。其中,装液量为12 L时,菌丝的生物量(菌丝体干重)最大,为2.907 g/100 mL,其漆酶活性、纤维素酶活性和多酚氧化酶活性均显著高于其他装液量处理。因此,黑皮鸡枞菌丝生长的发酵罐培养最适装液量为12 L。
2. 2. 3 发酵罐培养温度的优化 由表8可知,发酵罐不同培养温度下黑皮鸡枞菌丝的漆酶活性、纤维素酶活性和多酚氧化酶活性间均存在显著差异。其中,发酵罐培养温度为25 ℃时,菌丝体生长最快,菌球直径最大,为0.89 cm,且菌丝体干重最重,其漆酶活性、纤维素酶活性和多酚氧化酶活性均显著高于其他发酵罐培养温度处理。因此,黑皮鸡枞液体菌种发酵罐培养最适温度为25 ℃。
2. 2. 4 发酵罐培养时间的优化 由表9可知,各发酵罐培养时间黑皮鸡枞菌丝的漆酶活性、纤维素酶活性和多酚氧化酶活性间均存在显著差异。其中,发酵罐培养时间为100 h时,菌球直径最大,菌丝体干重最重,其漆酶活性、纤维素酶活性和多酚氧化酶活性均显著高于其他发酵罐培养时间处理。因此,黑皮鸡枞液体菌种发酵罐培养最适时间为100 h。
2. 3 栽培试验结果
在无菌接种室内将发酵罐培养获得的液体菌种注入栽培袋中进行出菇培养,结果在最佳工艺条件下培养的菌种菌丝生长速度快,菌丝长满18 cm×36 cm聚丙烯塑料袋时间为29 d,子实体单生,直立,暗褐色,鲜嫩醇香,平均每袋产量约360.0 g,生物学转化率达78.0%(图1和图2)。说明该液体菌种可在生产中推广应用。
3 讨论
目前关于食用菌液体菌种研究的报道很多,已应用于生产的品种有茯苓、侧耳、金针菇、香菇、黑木耳、猴头菇和灵芝等。通过发酵罐培养获得的液体菌种具有生产周期短、成本低、菌龄一致、纯度高、接种简便、不受季节限制、可连续自动化生产和提高食用菌生物转化率等优点(戴建清和曾志恒,2012;郭尚和王慧娟,2013),但制备食用菌发酵罐液体菌种对生产工艺和技术条件要求较高,因此我国现有的规模化食用菌工厂化生产企业大部分仍以固体菌种为主,发酵罐液体菌种仅用于杏鲍菇、金针菇和蟹味菇等工厂化品种的生产。
苏跃稳等(2016)研究认为,培养基、接种量、接种时间、温度、pH和通气量等因素是液体菌种发酵罐培养技术成功与否的关键。聂晓东(2009)通过对摇瓶进行放大试验,在5 L发酵罐水平上得到鸡枞菌的培养条件为:接种量10%、摇床转速80 r/min、装液量3 L、温度28 ℃和pH 4.0,在此条件下鸡枞菌的生物量达最大值。本研究在15 L发酵罐水平上得到黑皮鸡枞菌优化后的培养条件为:接种量12%、摇床转速90 r/min、装液量12 L、温度25 ℃和pH 6.5,与聂晓东(2009)的研究结果存在差异,可能与研究的鸡枞菌种属不同、选用的C源和N源不同有关。
真菌菌丝体在发酵培养过程中会向外分泌多种胞外酶如木质素酶、半纤维素酶、纤维素酶、漆酶、多酚氧化酶和过氧化氢酶等(王谦和胡卫静,2016)。目前,有关食用菌液体发酵生理指标检测的研究报道甚少,不同的培养条件对菌丝生长和多种酶活性的影响差异明显。本研究通过对黑皮鸡枞液体菌种发酵过程中的菌球数量、pH、纤维素酶活性、漆酶活性、多酚氧化酶活性等影响菌丝生长的生理指标进行测定,可有效监测黑皮鸡枞液体菌种的制备过程,为液体菌种活性评价提供参考依据,也可为进行100、500和1000 L等发酵罐的逐级扩大生产提供技术支持。
4 结论
通过15 L发酵罐液体菌种培养基优化和发酵工艺优化,获得黑皮鸡枞液体菌种发酵的最佳培养基为20.0 g葡萄糖+4.0 g高粱粉+3.0 g K2HPO4+1.0 g MgSO4+2片维生素B1+1000.0 mL蒸馏水,pH 6.5;发酵工艺为:装液量12 L,接种量12%,培养温度25 ℃,转速90 r/min,培养时间100 h,罐压0.3 MPa,通气量0.9 m3/h。在此优化的培养基和发酵工艺下将黑皮鸡枞液体菌种接种于栽培袋,生物学转化率达78.0%。可见,将液体菌种发酵罐培养技术与工厂化栽培技术有机结合,可实现黑皮鸡枞菌的规模化、标准化、现代化和工厂化生产。
参考文献:
白燕,王维新. 2012. 刺参肠道蛋白酶、淀粉酶、脂肪酶与纤维素酶活性的测定方法[J]. 饲料工业,33(20):28-32. [Bai Y,Wang W X. 2012. Methods for determination of intestinal protease,amylase,lipase and cellulase activity of sea cucumber[J]. Feed Industry,33(20):28-32.]
戴建清,曾志恒. 2012. 食用菌液体菌种研究现状及发展趋势[J]. 中国食用菌,31(5):1-3. [Dai J Q,Zeng Z H. 2012. Research status and development trends of liquid spawn of edible mushroom[J]. Edible Fungi of China,31(5):1-3.]
付子艳,李荣春. 2009. 云南鸡枞菌属关系的初步研究[J]. 福建农林大学学报(自然科学版),38(3):271-274. [Fu Z Y,Li R C. 2009. Initial research in phylogenetics relationship of Termitomyces Heim in Yunnan,China[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition),38(3):271-274.]
郭尚,王慧娟. 2013. 食用菌深层发酵技术及其应用[J]. 山西农业科学,41(8):885-888. [Guo S,Wang H J. 2013. Submerged fermentation technology of edible fungus and its application[J]. Journal of Shanxi Agricultural Sciences,41(8):885-888.]
胡尚勤,劉天贵,李贤柏. 2008. 鸡枞菌的培养条件研究[J]. 食品与生物技术学报,27(1):67-70. [Hu S Q,Liu T G,Li X B. 2008. Research of the nutrition requirement of the Termitomyces albuminosu[J]. Journal of Food Science and Biotechnology,27(1):67-70.]
胡忠策,郑晓冬. 2002. 鸡枞菌液体深层发酵的研究[J]. 菌物系统,21(1):98-101. [Hu Z C,Zheng X D. 2002. Study on submerged fermentation of abieties[J]. Mycosystema,21(1):98-101.]
李艳丽. 2018. 鸡枞菌培养基优化及人工栽培技术研究[D]. 汉中:陕西理工大学. [Li Y L. 2018. Research on optimization and artificial cultivation technology of Termitomyces albuminosus culture[D]. Hanzhong:Shaanxi University of Technology.]
罗晓妙. 2010. 液态发酵产鸡枞菌菌丝体的条件优化[J]. 食品科技,35(3):29-32. [Luo X M. 2010. Optimization of liquid-state fermentation conditions for producing mycelium of Termitomyces albuminousus[J]. Food Science and Technology,35(3):29-32.]
聂晓东. 2009. 鸡枞菌丝体及其皂苷的深层发酵条件的优化[D]. 无锡:江南大学. [Nie X D. 2009. Optimization of submerged culture in mycelia and saponin in Termitomyces albuminosus[D]. Wuxi:Jiangnan University.]
孙月娥,张俊韬,王卫东. 2011. 金针菇中多酚氧化酶活性测定及其护色研究[J]. 食品工业,(11):68-70. [Sun Y E,Zhang J T,Wang W D. 2011. PPO activity determination and antibrowning measurement for Flammulina velutipes[J]. Food Industry,(11):68-70.]
苏跃稳,路鹏,郭群群,王健. 2016. 食用菌液体深层发酵的研究进展[J]. 食品安全质量检测学报,7(2):645-650. [Su Y W,Lu P,Guo Q Q,Wang J. 2016. Progress in edible fungus by submerged fermentation[J]. Journal of Food Safety and Quality,7(2):645-650.]
王谦,胡卫静. 2016. 大型食药用真菌深层发酵研究进展[J]. 食品安全质量检测学报,7(3):1240-1246. [Wang Q,Hu W J. 2016. Research progress on submerged fermentation of macroscopic edible fungi[J]. Journal of Food Safety and Quality,7(3):1240-1246.]
熊亚,李敏杰. 2013. 鸡枞菌菌丝体基础培养基的优化[J]. 食品与机械,29(4):185-189. [Xiong Y,Li M J. 2013. Optimization of basic medium for mycelium of Collybia albuminosa by response surface methodology[J]. Food and Machinery,29(4):185-189.]
徐兵,张雅君,冀宏. 2017. 黑皮鸡枞菌丝体液体发酵条件优化[J]. 常熟理工学院学报,31(2):104-108. [Xu B,Zhang Y J,Ji H. 2017. Optimization of liquid fermentation conditions for the mycelia of Termitomyces Heim[J]. Journal of Changshu Institute Technology,31(2):104-108.]
薛林浩,王晓东,蔡虹,范红春,党会,黎勇. 2013. 黑皮鸡枞菌液体培养基优化[J]. 内江师范学院学报,28(10):24-27. [Xue L H,Wang X D,Cai H,Fan H C,Dang H,Li Y. 2013. Optimization of liquid culture medium for Termitomyces Heim[J]. Journal of Neijiang Normal University,28(10):24-27.]
曾先富,陳阳婷,熊维全,罗小波. 2012. 鸡枞菌菌丝体培养试验[J]. 食用菌,34(6):9-10. [Zeng X F,Chen Y T,Xiong W Q,Luo X B. 2012. Experiment on mycelium culture of Termitomyces[J]. Edible Fungi,34(6):9-10.]
朱海潇. 2008. 食用菌产漆酶能力的比较及漆酶性能的研究[D]. 福州:福建农林大学. [Zhu H X. 2008. The comparison for the capacity laccase production in various types of edible fungi and the characterization of laccase[D]. Fuzhou:Fujian Agriculture and Forestry University.]
Saha T. 2008. Cellobiose dehydrogenase production by the mycelial culture of the mushroom Termitomyces clypeatus[J]. Process Biochem,43(6):634-641.
Kirk P M,Cannon P F,David J C,Stalpers J A. 2001. Ainsworth & Bisby’s Dictionary of the Fungi[M]. Wallingford:CAB1 Publishing.
(责任编辑 思利华)

