光裸方格星虫纤溶酶对急性血瘀模型大鼠血液流变性异常及血管内皮损伤的改善作用研究
黄媛恒 黄晓亮 覃斐章 李福森 庞丽君 李映新
摘 要 目的:研究光裸方格星蟲纤溶酶(SNFE)对急性血瘀模型大鼠血液流变性异常及血管内皮损伤的改善作用。方法:将SD大鼠随机分为对照组、模型组、阿司匹林组(100 mg/kg)和SNFE低、高剂量组(2 500、5 000 U/kg),每组10只,每天灌胃1次,连续给药7 d,第6天给药后1 h,除对照组外,其余各组大鼠均皮下注射盐酸肾上腺素0.8 mg/kg,再以冰水浴复制急性血瘀模型。次日给药后2 h腹主动脉采血,使用全自动血流变仪测定全血黏度(高、中、低切变率)、血浆黏度、红细胞比容、红细胞聚集指数、红细胞变形指数等血液流变学指标,酶联免疫吸附法测定血浆中一氧化氮(NO)、内皮素1(ET-1)含量及其比值,苏木精-伊红(HE)染色观察主动脉血管内皮的损伤程度。结果:与对照组比较,模型组大鼠的高、中、低切变率的全血黏度以及血浆黏度、红细胞聚集指数、ET-1含量均显著升高,红细胞变形指数、NO含量和NO/ET-1比值均显著降低,差异均有统计学意义(P<0.05或P<0.01)。与模型组比较,SNFE高剂量组大鼠的高、中、低切变率的全血黏度以及血浆黏度、红细胞比容、红细胞聚集指数、ET-1含量均显著降低,红细胞变形指数、NO含量和NO/ET-1比值均显著增加,差异均有统计学意义(P<0.05或P<0.01);SNFE低剂量组大鼠仅红细胞变形指数和NO/ET-1比值均显著增加,ET-1含量显著降低,差异均有统计学意义(P<0.05或P<0.01)。血管内皮染色图显示,与对照组比较,模型组大鼠主动脉各层结构松散无序,内膜缺损不完整,空泡增加,内皮损伤明显;各给药组大鼠内皮也均有不同程度损伤,但损伤程度均较模型组轻。结论:SNFE对急性血瘀模型大鼠的血液流变性异常和血管内皮损伤均有改善作用。
关键词 光裸方格星虫纤溶酶;急性血瘀模型;血液流变性;血管内皮;大鼠
ABSTRACT OBJECTIVE: To study the improvement effects of fibrinolytic enzyme from Sipunculus nudus (SNFE) on hemorheology disorder and vascular endothelium injury in naked acute blood stasis model rats. METHODS: SD rats were randomly divided into control group, model group, aspirin group (100 mg/kg) and SNFE high-dose and low-dose groups (2 500, 5 000 U/kg), with 10 rats in each group. They were given relevant medicine intragastrically once a day, for consecutive 7 d. One hour after the 6th day of administration, except for control group, other groups were given adrenaline hydrochloride 0.8 mg/kg subcutaneously, and then the acute blood stasis model was induced by ice-water bath. Blood was collected from abdominal aorta 2 h after the next day. Blood rheological parameters such as whole blood viscosity (high, medium and low shear rate), plasma viscosity, hematocrit, erythrocyte aggregation index and erythrocyte deformability index were measured by automatic rheometer. The contents of NO and ET-1 in plasma and their ratio were determined by ELISA, and the damaged degree of vascular endothelium were observed by HE staining. RESULTS: Compared with control group, whole blood viscosity of high, medium and low-shear rate, plasma viscosity, erythrocyte aggregation index and ET-1 content were increased significantly in model group, while erythrocyte deformability index, NO content and NO/ET-1 ratio were decreased significantly, with statistical significance (P<0.05 or P<0.01). Compared with model group, whole blood viscosity of high, medium and low-shear rate, plasma viscosity, hematocrit, erythrocyte aggregation index and ET-1 content were decreased significantly in SNFE high-dose groups. Erythrocyte deformability index, NO content and NO/ET-1 ratio were increased significantly, with statistical significance (P<0.05 or P<0.01). In SNFE low-dose group, erythrocyte deformability index and NO/ET-1 ratio were increased significantly, while ET-1 content was decreased significantly, with statistical significance (P<0.05 or P<0.01). Vascular endothelial staining showed that compared with control group, the structure of aorta layers in model group was loose and disordered, the endothelial defect was incomplete, the vacuoles increased, and the endothelial damage was obvious. The endothelium of rats in each administration group was damaged to varying degrees, but the degree of injury was lighter than in model group. CONCLUSIONS: SNFE can improve hemorheological abnormalities and vascular endothelial injury in rats with acute blood stasis.
KEYWORDS Naked fibrinolytic enzyme from Sipunculus nudus; Acute blood stasis model; Hemorheology; Vascular endothelium; Rats
光裸方格星虫(Sipunculus nudus)俗称“沙虫”,为星虫门科海洋无脊椎软体动物,分布于无污染的浅海或潮间带的泥沙中,在我国以广西北部湾产量最大,质量最优。方格星虫性平,味甘、咸,肉质鲜美脆嫩,营养丰富,是食补中的佳品[1]。据报道,方格星虫虫体含有多糖、氨基酸、脂肪酸等多种成分,有延缓衰老、抗疲劳、提高免疫力、抗辐射、抗病毒、护肝、提高记忆力等作用[2-3]。本课题组前期从方格星虫的内脏中提取出一种纤维蛋白溶解酶——方格星虫纤溶酶(SNFE),其为丝氨酸蛋白酶,具有良好的溶栓和抗凝血活性,且该纤溶酶无溶血作用和致出血活性,其作为一种潜在的抗血栓药物,表现出良好的开发前景[4-6]。
血瘀证是由机体内气机逆乱、气血运行不畅所致的瘀积凝滞,或离开经脉的血液无法及时消散以致停留一处所致的多种病症的总称,临床表现为瘀血内阻所引起疼痛、肿块、舌紫、脉涩、出血等各种症候,为中医常见病症[7]。血瘀证主要特点为血流不畅,《实用血瘀证诊断标准》[8]中也以血液流变、凝血、纤溶、微循环检测提示血液瘀滞作为血瘀证诊断的一个重要的实验室指标。研究表明,血瘀证涉及多个复杂的病理生理变化,不仅与血液流变改变有关,与血管内皮细胞损伤、血脂代谢异常也有着密切的联系[9-11]。本研究通过大鼠皮下注射大剂量肾上腺素加冰水浴刺激引起“暴怒”和“寒邪”,造成急性血瘀模型,研究SNFE对该模型血液流变异常及血管内皮损伤的影响,并测定血浆中舒血管因子——一氧化氮(NO)及缩血管因子——内皮素1(ET-1)的含量,初步探讨SNFE活血化瘀及抗血栓的机制。
1 材料
1.1 仪器
SA9000 全自动血流变仪(北京赛科希德科技发展有限公司);TGL-16A冷冻离心机(长沙平凡仪器仪表有限公司);Spectramax Plus384连续波长酶标仪(美国MD公司);BHS光学显微镜(日本Olympus公司)。
1.2 药品与试剂
SNFE(广西医科大学药学院药学实验中心提供,批号:20180916,经纤维蛋白平板法测定活性为50 U/mg);阿司匹林肠溶片(拜耳医药保健有限公司,批号:BJ27607,规格:0.1 g);盐酸肾上腺素注射液(广州明兴制药厂,批号:161201,规格:1 mL ∶ 1 mg);伊红染液(韩国Biosharp公司,批号:XH184601);苏木精染液(北京索莱宝科技有限公司,批号:329D0312);NO、ET-1酶联免疫试剂盒(美国R&D Systems 公司,批号:335566、221475);水合氯醛为分析纯,实验用水均为蒸馏水。
1.3 动物
SD大鼠,♀(有研究表明♀大鼠的血流变指标变化较♂大鼠更为明显[12]),体质量为(200±20) g,由广西医科大学实验动物中心提供,实验动物生产许可证号:SCXK(桂)2014-0002,实验动物使用许可证号:SYXK(桂)2014-0003。本实验操作符合广西医科大学动物伦理相关规章规定。
2 方法
2.1 血瘀模型建立
将SD大鼠随机分为对照组、模型组、阿司匹林组和SNFE高、低剂量组,每组10只。SNFE高、低剂量组大鼠分别给予5 000、2 500 U/kg的SNFE(根据预实验结果显示,剂量为2 500 U/kg时血瘀模型大鼠的血流变指数发生改變,因此以该剂量为SNFE的低剂量,高剂量为低剂量的2倍);阿司匹林组大鼠给予100 mg/kg的阿司匹林[12-13],对照组和模型组大鼠均给予生理盐水,每天灌胃给药1次,连续给药7 d,第6天药后1 h,除对照组外,其余各组大鼠皮下注射0.8 mg/kg的盐酸肾上腺素,2 h后将大鼠放入冰水中游泳5 min,取出大鼠擦干皮毛,2 h后再次皮下注射0.8 mg/kg的盐酸肾上腺素,建立血瘀模型[12-13]。
2.2 血液流变学指标测定
造模次日末次给药后2 h,用10%水合氯醛(3 mL/kg)麻醉大鼠,腹主动脉采血,采用肝素抗凝采血管采血5 mL,使用全自动血流变仪测定各组大鼠的全血黏度(高、中、低切变率:200/s、50/s、1/s)、血浆黏度、红细胞比容、红细胞聚集指数以及红细胞变形指数。
2.3 血浆中NO和ET-1的含量测定
肝素抗凝管采血完毕后,换乙二胺四乙酸(EDTA)抗凝采血管继续采血约2 mL,以3 000 r/min离心15 min,取血浆至EP管放置,-80 ℃冰箱保存。采用酶联免疫吸附法测定各组大鼠血浆中NO和ET-1的含量,具体操作严格按照试剂盒说明书进行。使用酶标仪测定吸光度,数据处理采用ELISACalc软件进行数据处理,并拟合曲线,计算含量。
2.4 主动脉血管病理形态学观察
采血完毕后,处死大鼠,分离并摘取心脏主动脉,用生理盐水漂洗后保存于10%中性福尔马林,常规石蜡包埋、制作切片并进行苏木精-伊红(HE)染色,于显微镜下观察血管内膜及主动脉壁各层结构的完整程度。
2.5 统计学方法
实验数据均以x±s表示 ,组间比较采用SPSS 16.0软件进行单因素方差分析,P<0.05表示差异有统计学意义。
3 结果
3.1 血液流变学指标变化
与对照组比较,模型组大鼠的高、中、低切变率的全血黏度以及血浆黏度、红细胞聚集指数均显著升高,红细胞变形指数显著降低,差异均有统计学意义(P<0.05或P<0.01),提示造模成功。与模型组比较,SNFE高剂量组大鼠的高、中、低切变率的全血黏度以及血浆黏度、红细胞比容、红细胞聚集指数均显著降低,红细胞变形指数显著增加,差异均有统计学意义(P<0.05或P<0.01);SNFE低剂量组大鼠的血浆黏度显著降低,红细胞变形指数显著增加,差异均有统计学意义(P<0.01);阿司匹林组大鼠的高、低切变率的全血黏度以及血浆黏度、红细胞聚集指数和红细胞变形指数均显著降低,差异均有统计学意义(P<0.05或P<0.01),其余指标无明显变化(P>0.05)。各组大鼠全血黏度的测定结果见表1,血浆黏度、红细胞比容、红细胞聚集指数及红细胞变形指数的测定结果见表2。
3.2 血浆中NO和ET-1含量变化
与对照组比较,模型组大鼠血浆中NO 含量和NO/ET-1比值显著降低,ET-1含量显著升高,差异均有统计学意义(P<0.01)。与模型组比较,SNFE高剂量组大鼠血浆中NO 含量和NO/ET-1比值显著升高,ET-1含量显著降低,差异均有统计学意义(P<0.05);SNFE低剂量组和阿司匹林组大鼠血浆中ET-1含量显著降低,NO/ET-1值显著升高,差异均有统计学意义(P<0.05)。各组大鼠血浆中NO、ET-1含量的测定结果见表3。
3.3 血管内皮形态变化
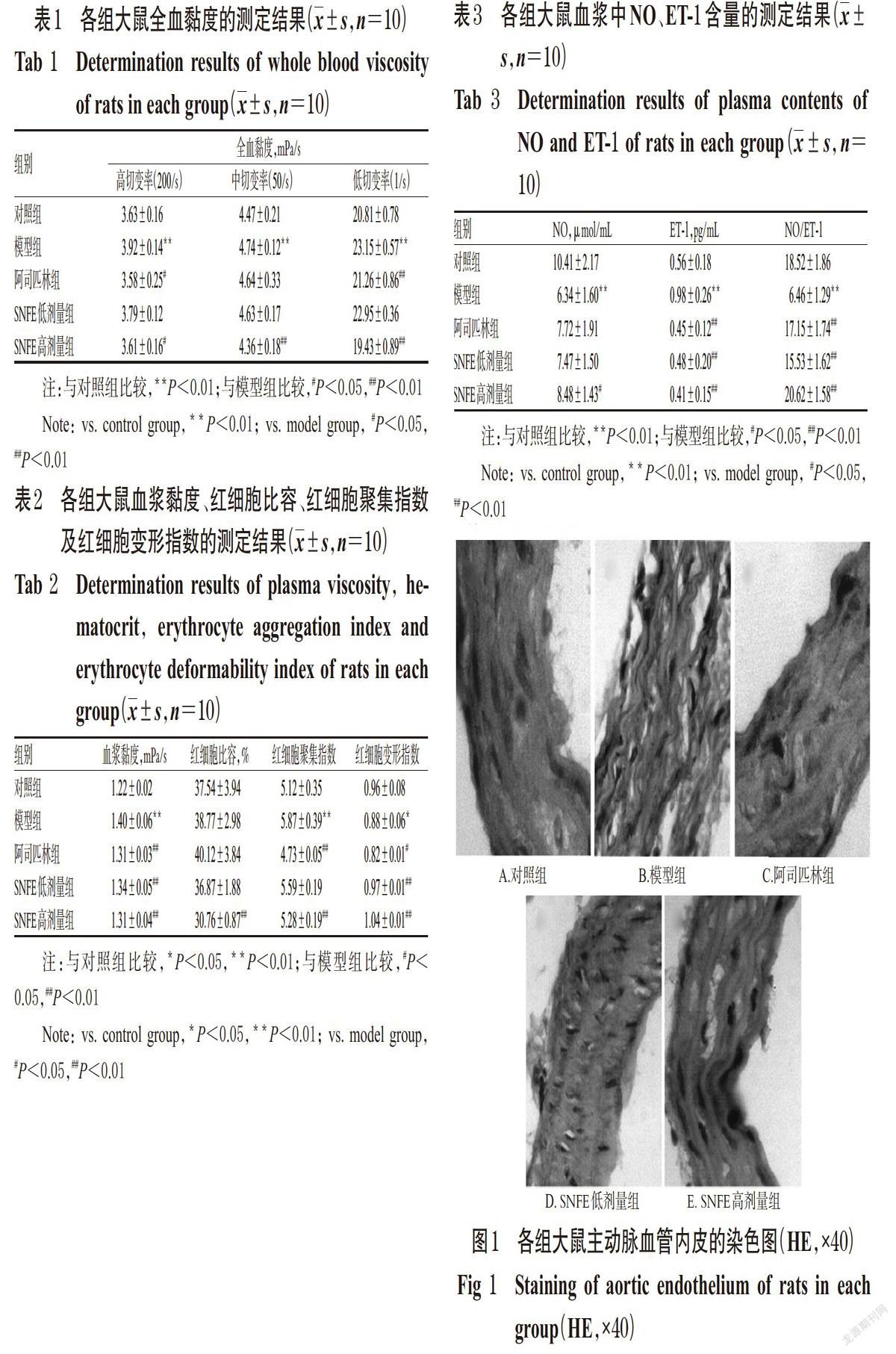
对照组大鼠主动脉壁各层结构紧凑,内膜光滑完整。模型组大鼠主动脉各层结构松散无序,内膜缺损不完整,空泡增加,内皮损伤明显。SNFE高、低剂量组大鼠内皮结构基本完整,但主动脉壁各层结构变松散及出现空泡,其中低剂量组松散程度及内膜、血管壁层损伤更严重,但均较模型组轻。阿司匹林组大鼠血管内膜及结构完整,空泡少,损伤程度小。各组大鼠主动脉血管内皮的染色图见图1。
4 讨论
血液流动状态改变、血液性质改变以及血管内皮损伤是血栓形成的三个重要诱因[14],血液黏滞性增加、血液浓稠、流动性变差引起血流缓慢、停滞或者涡旋的形成,激活凝血因子,最终导致血栓性疾病的发生。血瘀证是一种血液运行不畅、停滞瘀积所引起的疾病,其血液具备浓、凝、黏、聚,即血栓性血液的突出特点,可引起微循环障碍以及血栓形成。实际上,血栓性疾病就属于中医学血证中的“瘀血证”,研究表明,许多活血化瘀药具有抗血栓作用[15]。
在血瘀证的诊断依据中,血液流变学检查是实验室诊断最常用也是最为成熟的方法,其考察血液成分的流动性及变形能力,可以反映影响血流的各种因素通过不同途径产生的同一效应,即血液流动性、黏滞性、变形性及凝固性的改变[15],也常作为检测血瘀模型动物建模成功与否的重要指标。
目前,血瘀证动物模型复制方法主要根据寒邪、郁怒、气虚、外伤等血瘀的病因病机,其中郁怒和寒邪被认为是急性血瘀形成的主要病因。通过大剂量注射肾上腺素加冰水浴刺激引起“暴怒”和“寒邪”是制备大鼠急性血瘀模型常用的方法[12-13]。
本实验结果发现,模型组大鼠全血黏度及血浆黏度升高反映血液的黏滞性(黏)增大,致使血液的流动性变差;红细胞聚集指数增加(聚),致使血栓栓塞及中风的风险增加;红细胞比容是反映血液浓稠度的指标,其值越大则血液越“浓”;红细胞变形指数是决定高切率下全血黏度的关键因素,红细胞变形指数降低,高切变率全血黏度增高。与对照组比较,模型组大鼠的血液流变学指标改变表明了其血液变黏、稠、聚,流动性变差,提示急性血瘀造模成功。SNFE可以逆转模型大鼠上述血液流变学指标的改变,尤其以高剂量最为明显,说明SNFE有纠正血液高黏滞状态、改善微循环的作用。
有研究表明,血管内皮损伤与血瘀证及血栓的发生、发展及发病机制有关[9-10,16]。血管内皮能分泌多种血管活性物质,在正常生理条件下,这些血管活性物质之间存在动态平衡,维持正常血管内皮功能,当血管内皮损伤、功能紊乱,可造成 NO/ET-1、前列环素/血栓素A2、组织纤溶酶原激活剂/组织纤溶酶原激活剂抑制物失衡,导致血管壁炎症反应,血液成分及血液流变学指标的改变[17]。其中,NO是由血管内皮细胞合成并释放的最重要的舒血管因子,可扩散至血管壁平滑肌细胞激活鸟氨酸环化酶,介导环磷酸乌苷(cGMP)调控的血管舒张,此外,还具有抑制血小板聚集、抑制单核细胞黏附于内皮细胞、抑制平滑肌细胞增殖等作用[18]。ET是迄今为止已知的最强缩血管活性物质,主要通过激活钙通道、增加钙内流介导血管平滑肌收缩,缺血、缺氧、血栓素等刺激可以增加ET-1的合成和释放,发挥促进血管平滑肌细胞增殖和血栓形成的作用[19]。血瘀证研究表明[20],NO降低和ET-1升高可能是血瘀证的病理基础之一。因此,通过对主动脉血管进行HE染色及测定血浆中NO、ET-1含量观察血管内皮功能可以初步探讨SNFE活血化瘀的作用机制。HE染色结果表明,模型组大鼠主动脉各层结构松散无序,尤其是血管内膜缺损不完整,损伤较重;与模型组比较,SNFE高、低剂量组大鼠血管内膜损伤程度有所减轻。血浆中NO和ET-1的含量测定结果表明,SNFE高、低剂量组大鼠血浆中ET-1含量以及NO/ET-1比值均明显高于模型组,提示SNFE可能通过维持NO和ET-1的合成分泌平衡,保护血管内皮,改善急性血瘀症血液流变性,发挥活血化瘀的作用。
参考文献
[ 1 ] 陈细香,林秀雁,卢昌义,等.方格星虫属动物的研究进展[J].海洋科学,2008,32(6):66-70.
[ 2 ] 陈永祥,吕萍.方格星虫药理学活性的研究概况[J].中西医结合心血管病杂志,2017,5(2):58-59.
[ 3 ] 徐艳,王慧芹,邹杰,等.方格星虫生物活性成分的研究进展[J].广西科学院学报,2015,31(4):273-280.
[ 4 ] 雷丹青,李肖肖,廖共山.广西沿海裸体方格星虫纤维蛋白溶解酶的研究[J].天然产物研究与开发,2013,25(7):897-902.
[ 5 ] 李映新,黄晓亮,黄媛恒,等.光裸方格星虫纤溶酶SNFE的抗凝作用及机制研究[J].中国药房,2017,28(28):3938-3941.
[ 6 ] 李映新,李肖肖,黄媛恒,等.光裸方格星虫纤溶酶SNFE体外溶栓作用及安全性初評[J].天然产物研究与开发,2016.DOI:10.16333/j.1001-6880.2016.11.018.
[ 7 ] 唐宗海.血证论[M]. 2 版.北京:人民卫生出版社,2016:23,97.
[ 8 ] 中国中西医结合学会活血化瘀专业委员会.实用血瘀证诊断标准[J].中国中西医结合杂志,2016,36(10):1163.
[ 9 ] 黄敏,谢建祥,吴锐,等.血瘀证目征与血管内皮细胞损伤的关系[J].中华中医药杂志,2011,26(4):781-784.
[10] 江泳,徐蓉娟,李红,等.血瘀证与血管内皮功能障碍的关系[J].辽宁中医药大学学报,2013,15(6):57-59.
[11] 孙卡雷,郎江明,魏爱生,等.糖尿病血瘀证患者脂质代谢的相关研究[J].山东中医药杂志,2004,23(1):13-15.
[12] 李伟霞,黄美艳,唐于平,等.大鼠急性血瘀模型造模方法的研究与评价[J].中国药理学通报,2011,27(12):1761- 1765.
[13] 黄媛恒,覃斐章,庞辉,等.螺旋藻激酶对急性血瘀模型大鼠的影响[J].重庆医学,2017,46(36):5047-5051.
[14] CHUNG I,GY L. Virchow’s triad revisited:blood constituents[J]. Pathophysiol Haemost Thromb,2003,33(5/6):449-454.
[15] 周瑜,方锐,王国佐.活血化瘀方药对血瘀证模型的作用机制的研究进展[J].中医药导报,2015,23(12):87-90.
[16] 李宏力,李玉文,刘天龙,等. Z-没药甾酮对急性血瘀模型大鼠凝血和血管内皮功能的改善[J].中国药房,2016,27(19):2615-2617.
[17] 陈福锋,郑亚男,杜文杰,等.龙血竭胶囊抗慢性血瘀证作用的研究[J].药物评价研究,2015,38(3):274-278.
[18] 刘时彦,黄为民,张润慧,等.盐敏感性高血压大鼠炎症因子和内皮损伤因子的表达[J].中国动脉硬化杂志,2015,23(8):779-783.
[19] 吕建卫,邓文诚,李如辰.银杏叶片对急性脑梗死患者血浆ET-1、NO 及 TNF-α的影响[J].河北中医,2010,32(6):901-903.
[20] 李兴琴,张俊刚,郝娜,等.二种血瘀证动物模型内皮功能及血流变学的比较[J].中国比较医学杂志,2007,17(8):478-490.
(收稿日期:2019-06-13 修回日期:2019-08-05)
(編辑:邹丽娟)

