原花色素对酿酒酵母cAMP-PKA信号转导途径的影响
祝凯丽,商文倩,史明珠,张慧,李静媛
(青岛农业大学 食品科学与工程学院,山东 青岛,266109)
氧化胁迫是葡萄酒发酵过程中经常面临的胁迫之一[1]。酿酒酵母在面临H2O2胁迫时会表现出菌体生长受到抑制和细胞相应的防御基因会发生变化[2]。cAMP-PKA信号转导是细胞胞外信号分子与受体相结合,从而引起胞内cAMP的水平变动而调解酵母细胞代谢、增殖、分化、压力抗性等。cAMP是细胞内参与调节物质代谢和生物学功能的重要物质,它广泛参与机体内的各种生理活动,是生物体内重要的第二信使[3]。PKA是酿酒酵母中蛋白激酶A,其活性与海藻糖含量之间具有密切相关性[4]。海藻糖是一种非还原性的二糖,由葡萄糖以α,α-1,1糖苷键连接而成,广泛存在于各种生物体内,在高温、高渗透压、酒精、氧化等逆境环境中能够保护微生物细胞质膜的完整性和蛋白质的稳定性[5-7]。本实验以原花色素为切入点,将原花色素与cAMP-PKA信号转导途径相联系,通过考察酵母在氧化胁迫中内源性海藻糖的积累情况及胞内海藻糖的逆境合成信号传递系统,分析酵母逆境防御应答机制及原花色素在此机制中起到的作用。
1 材料与方法
1.1 试验材料
1.1.1 酵母菌株
SaccharomycescerevisiaeAWRI R2由Marivin(Australian)公司商业化,具有良好的发酵性能。
1.1.2 主要试剂
原花色素、cAMP标准品(纯度为97.71%),购于北京索莱宝科技有限公司;海藻糖标准品,购于北京万佳首化生物科技有限公司;RNA提取试剂盒,购于天根生化科技有限公司;逆转录试剂盒(GoldenstarTMRT6 cDNA Synthesis Mix,gDNA remover selected),购于北京擎科新业生物技术有限公司。
1.1.3 培养基
YPD液体培养基(g/L):葡萄糖20,蛋白胨20,酵母膏10。
模拟葡萄汁(model synthetic meddium,MSM)培养基:由陈琳等首先使用,模拟标准葡萄汁中确定的化学成分,该培养基模拟酿酒酵母的发酵环境,适于研究葡萄酒酿造酵母的生物发酵特性[8]。
1.2 试验方法
1.2.1 发酵体系
将培养体系分别置于确定的氧化胁迫条件下。外加一定浓度的原花色素,设定对照,发酵体系如表1所示。

表1 不同发酵体系浓度梯度Table 1 Concentration gradient of different fermentation systems
1.2.2 发酵实验
在进行发酵前将酵母菌AWRI R2接种到YPD培养基中,28 ℃,150 r/min,12~14 h富集酵母菌。二次活化接种到50%培养基中富集12~14 h后,接种到培养基中,28℃静置培养。定时称重确定最终取样时间。
1.2.3 酵母细胞破碎
离心收集细胞,用冰冷的 0.1 mol/L的咪唑盐酸缓冲液(含 1 mmol/L DTT, pH=7.4)冲洗2次。250 mg(湿重)菌体与 0.5 mL上述缓冲液混合,0 ℃超声破碎(80 个循环,每循环破碎 3 s,停 3 s), 4 ℃离心取上清液用于酶活、cAMP等的测定。
1.2.4 酵母细胞内cAMP含量
参照苏豫梅等[9]的方法。色谱条件:色谱柱为HydersirBDSC18(250 mm×4.6 mm,5 μm)、流动相为V(0.1mol/L KH2PO4)∶V(甲醇)=85∶15、流速为1.0 mL/min、柱温35℃、进样量5 μL、检测波长254 nm,定量方法:采用外标法按峰面积进行定量。
cAMP标准曲线的绘制:称取适量cAMP标准品,加去离子水溶解后设置不同浓度梯度的cAMP标准品,分别为1、4、8、10、20 mg/L,过0.45μm滤膜,在前述的色谱条件下进行分析,记录色谱峰面积,以cAMP含量为横坐标,峰面积为纵坐标,绘制标准曲线。
1.2.5 酵母菌海藻糖含量测定
按LIU等[10]的方法,海藻糖的检测使用高效液相色谱仪(Waters 2695, Milford, MA, USA),色谱柱为Aminex HPX-87H (300mm×7.8mm) (Bio-Rad, USA)。柱温65℃,流动相为 0.005 mol/L H2SO4,流速为 0.600 mL/min。检测器选择示差检测器,进样量为 5 μL。
海藻糖标准曲线的绘制:称取适量海藻糖标准品,设置不同的浓度梯度,分别为1、4、8、10、20 mg/L的标样,过0.45μm滤膜,在前述的色谱条件下进行检测分析,记录色谱峰面积,以海藻糖含量为横坐标,峰面积为纵坐标,绘制标准曲线。
1.2.6 环腺苷酸环化酶酶活测定
参照侯晓月等[11]的试验方法,把Na2ATP作为反应底物,反应1 min后所产生cAMP的含量(μg/mL)。然后参照苏豫梅等[9]的方法测cAMP含量。
腺苷酸环化酶的测定方法:向含有沉淀的EP管里加入80 μL 30℃预热的31 mmol/L Na2ATP溶液和31 mmol/L MnCl2溶液,再加入30℃预热的840 μL 0.31 mol/L MES缓冲液,将加入反应混合物的EP管于30℃保温10 min。终止酶活反应采用煮沸法,沸水浴煮沸1min后,让酶失活。冷却、离心、过滤,用液相色谱法测定滤液中的cAMP含量。3次重复实验。
一个单位酶活(Unit)的定义为:在上述实验条件下,每min产生1 μmol cAMP所需要的酶量定义为一个酶活单位。
1.2.7 荧光定量PCR分析
1.2.7.1 酵母RNA的提取及反转录
采用天根生化科技有限公司RNA提取试剂盒进行RNA提取并进行反转录。
总RNA的提取;
(1)50~100 mg菌体在液氮中迅速研磨成粉末,加入450 μL RL,旋涡振荡混匀,56 ℃孵育3 min。
(2)所有溶液转移至过滤柱CS上(过滤柱CS放在收集管中),12 000 r/min离心5 min,小心吸取收集管中的上清至RNase-Free的离心管中。
(3)缓慢加入0.5倍上清体积的无水乙醇(通常为225 μL),混匀(此时可能出现沉淀),将得到的溶液和沉淀一起转入吸附柱CR3中,1 200r/min离心30~60 s,倒掉收集管中的废液,将吸附柱CR3放回收集管中。
(4)向吸附柱CR3中加入350 μL去蛋白RW1,12 000 r/min离心30~60 s,倒掉收集管中的废液,将吸附柱CR3放回收集管中。
(5)DNase I工作液的配制:取10 μL DNase I储存液放入新的RNase-Free离心管中,加入70 μL RDD溶液,轻柔混匀。
(6)向吸附柱CR3中央加入80 μL的DNase I工作液,室温放置15 min。
(7)向吸附柱CR3中加入350 μL去蛋白液RW1,12 000 r/min离心30~60 s,倒掉收集管中的废液,将吸附柱CR3放回收集管中。
(8)向吸附柱CR3中加入500 μL漂洗液RW,室温静置2min,12 000 r/min离心30~60 s,倒掉收集管中的废液,将吸附柱CR3放回收集管中。
(9)重复步骤8
(10)12 000 r/min离心2 min,倒掉废液,将吸附柱CR3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
(11)将吸附柱CR3放入一个新的RNase-Free离心管中,向吸附膜的中间部位悬空滴加30~100 μL RNase-Free ddH2O,室温放置2 min,12 000 r/min离心2 min,得到RNA溶液。-80℃保存RNA样本。
反转录:
(1)将RNA模板,RNase-Free water,10 x gDNA remover buffer置于冰上融解备用。
(2)在无核酸酶的微量离心管中按表2配制反转录反应体系(10 μL):

表2 反转录反应体系Table 2 Reverse transcription reaction system
注:用枪头轻轻混匀,短暂离心后,42℃孵育2min,随后60℃孵育5min。
(3)混合物迅速置于冰上冷却,短暂离心后加入表3所示组分:
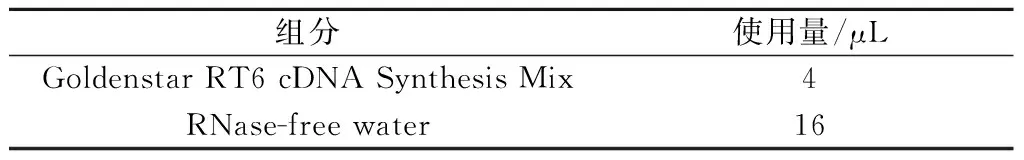
表3 荧光定量体系Table 3 Fluorescence quantitative system
(4)用枪头轻轻混匀,短暂离心后,50℃孵育15min,85℃孵育5min,置于冰上或冷藏备用。
1.2.7.2 引物设计
引物设计如表4所示。

表4 Real-time PCR所需的引物Table 4 Primers required for real-time PCR
注:据报道酵母的Actin基因在发酵过程中的表达量没有变化,被作为参照。其他基因的表达量需要与此基因相比得到。
1.2.7.3 荧光定量PCR程序
荧光定量PCR程序采用20 μL体系,程序为: 95 ℃预变性1 min, 95 ℃变性10 s,55 ℃ 退火10 s,72 ℃延伸10 s,40个循环;95 ℃延伸15 s,60 ℃延伸15 s。
样品送往青岛擎科梓熙生物技术有限公司进行检测。
2 结果与分析
2.1 酵母菌生长曲线
图1中酵母菌的生长速度呈现明显的差别,添加H2O2的体系中酵母菌的增长速度最慢,而添加了H2O2后再加入原花色素的体系酵母菌的生长速度远远超过只添加原花色素的体系,甚至超过了空白组。由此可见,H2O2营造的氧化胁迫条件抑制了酵母菌的繁殖与增长,而在氧化胁迫条件下加入原花色素可以促进酵母菌的繁殖与增长。为研究添加原花色素后培养体系中的变化,将从海藻糖含量以及关键代谢通路等指标进行验证。
图1 酵母菌的生长曲线Fig.1 Yeast growth curve
2.2 胞内海藻糖含量
海藻糖作为应激代谢的产物,在不同的胁迫条件下会保护生物大分子[12-14]。由图2可知不同发酵体系中酵母胞内海藻糖含量差异非常明显。添加H2O2的体系中胞内海藻糖最低,而添加H2O2后加入原花色素后胞内海藻糖的含量明显升高,且高于空白组,这说明原花色素可以刺激酵母在氧化胁迫条件下产生海藻糖抵抗逆境。
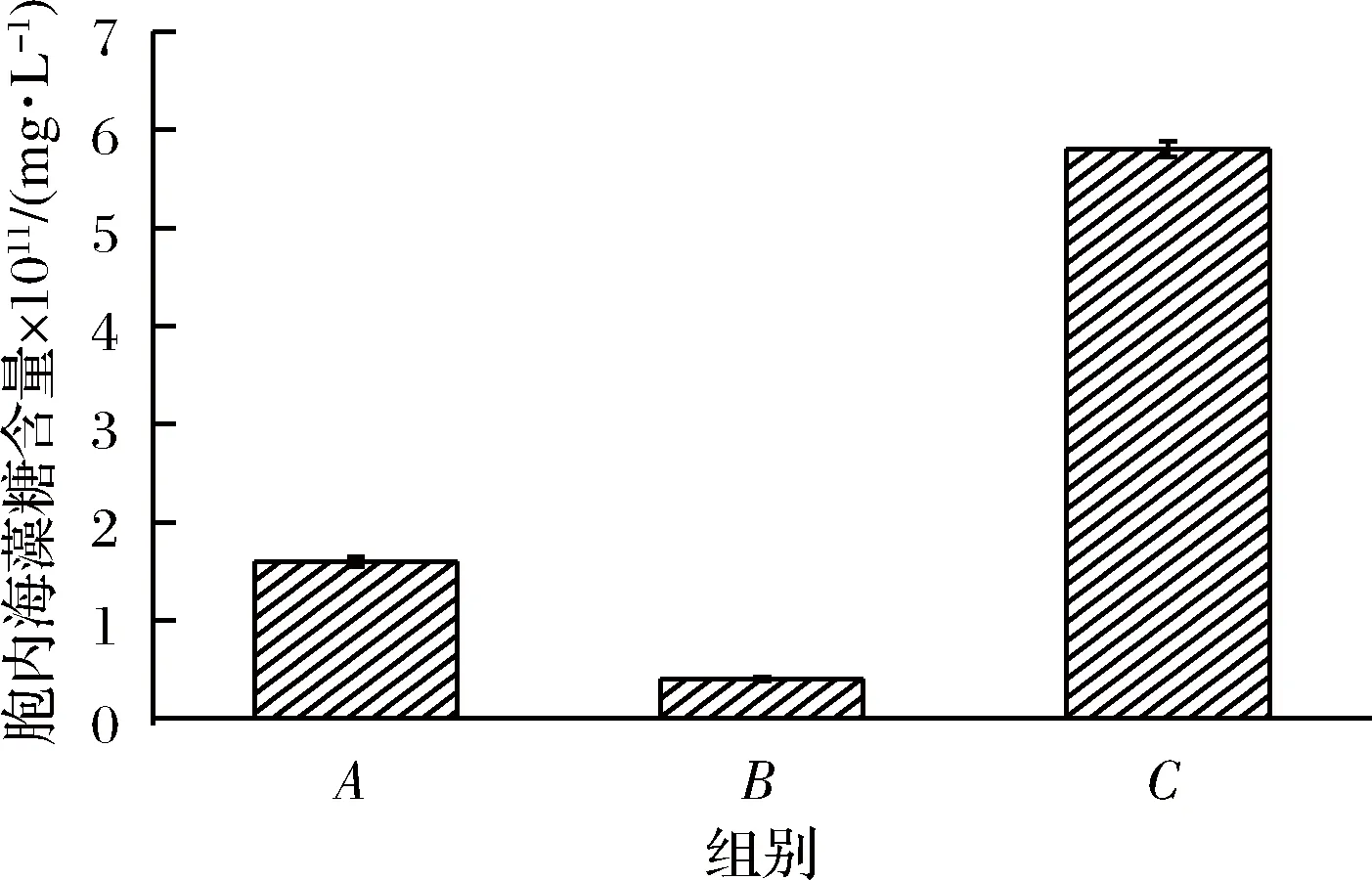
图2 不同发酵体系中酵母胞内海藻糖含量Fig.2 Intracellular trehalose content of yeast in different fermentation systems
然而原花色素作为大分子物质,无法进入细胞,不能直接作为信号因子调控细胞的代谢活动来应对发酵环境中的多种胁迫因子[15]。原花色素是如何作用于酵母,引起海藻糖含量变化起到保护酵母的作用?cAMP-PKA信号转导是细胞胞外信号分子与受体相结合,从而引起胞内cAMP的水平变动而调解酵母细胞的各种代谢活动的一种途径[3]。有研究表明, PKA可调节从细胞生长到对营养、渗透压和压力的应激反应过程,PKA活性与海藻糖含量之间具有密切相关性[16-17]。因此为探究海藻糖变化原因,我们将从关键信号转导途径等方面进行验证。
2.3 cAMP及关键基因和酶测定
由图3~图6可知,不同处理的酵母菌细胞中,CYR1和Actin基因的熔解曲线均呈现单一峰,说明基因片段特异性良好,可以用于进行后续的检测。同时根据循环数曲线,设定基因CYR1阈值为558.6。
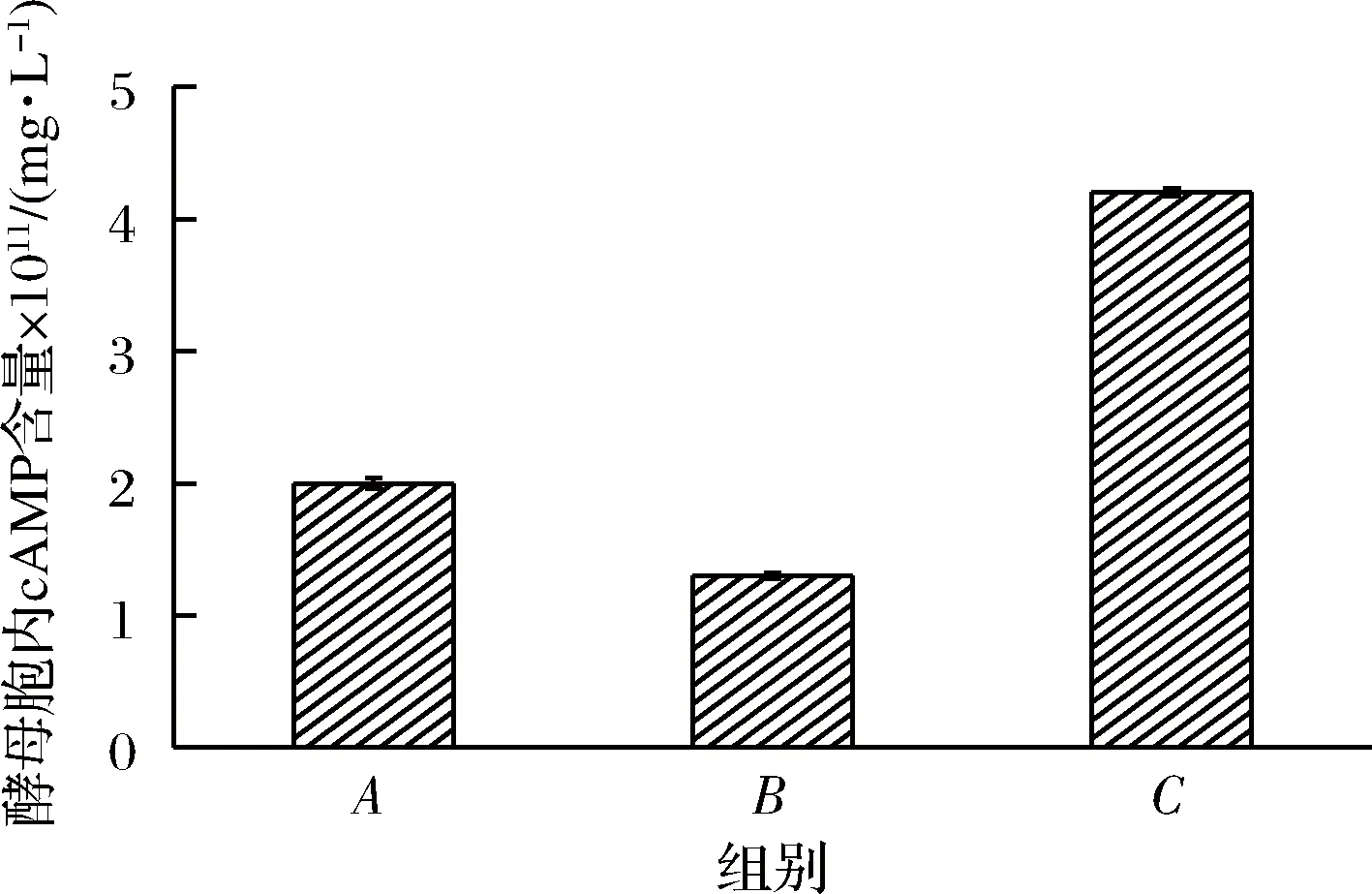
图3 酵母胞内cAMP的含量Fig.3 Intracellular cAMP content in yeast

图4 不同发酵体系的腺苷酸环化酶酶活Fig.4 Adenylate cyclase enzyme activity in different fermentation systems

图5 CYR1和Actin基因特异性片段熔点的Real-Time PCR分析Fig.5 Agarose gel electrophoretic analysis of the specific fragment smelting point of Actin and CYR1

图6 基因CYR1的标准曲线Fig.6 Standard curve of gene CYR1
基因CYR1的标准曲线均呈现良好的线性关系,相关系数为0.998,说明此标准曲线可用。标准曲线为Y=-4.094X+6.156。其中Y为达到阈值所需要循环数的lg值;X为初始模板。
实时定量PCR有绝对定量和相对定量之分,绝对定量通过标准曲线得到起始模板的精确拷贝数,相对定量又分为相对标准曲线法和比较CT法(2-△△CT法),通过内参照的标定可分析基因在样本中的表达差异。本研究应用2-△△CT法处理数据。数据如图7所示。

图7 不同发酵体系中酵母CYR1基因的相对表达量Fig.7 Relative expression levels of yeast CYR1 gene in different fermentation systems
体系B中酵母菌cAMP含量最低。体系C中cAMP的含量最高,甚至远远超过了空白组的含量。腺苷酸环化酶和CYR1基因呈现相同的趋势,即在添加H2O2的体系中酶活和相对表达量最低,在添加H2O2后添加原花色素的体系中最高,且高于空白组,这说明原花色素是从基因水平改变了基因的表达量,最终影响了cAMP生成量。
2.4 PKA关键基因分析
由图8可知,不同发酵体系中的酵母细胞中BCY1和Actin基因的熔解曲线都呈现出单一峰,说明该基因片段特异性较好,可以继续进行后续检测。同时根据循环数曲线,设定基因BCY1阈值为940.6。
由图9可知,编码基因BCY1的标准曲线呈现良好的线性关系,相关系数为0.991。说明此标准曲线可用。
标准曲线为Y=-2.925X+11.85,其中Y为达到阈值所需要循环数的lg值;X为初始模板。
不同发酵体系中酵母菌BCY1基因的相对表达量如图10所示。体系C中BCY1基因较体系A有所升高,体系B较体系A有所降低,这说明原花色素可以缓解H2O2对BCY1基因的抑制作用,并对其基因的表达起到促进作用。有研究表明,BCY1是PKA调节亚基的编码基因,当细胞内环腺苷酸cAMP含量升高时,cAMP会与PKA调节的亚基BCY1相结合,释放出催化亚基从而激活PKA,BCY1基因的表达量会影响PKA的活性[4]。结合图3所示,BCY1基因的相对表达量与cAMP都升高,这可能会提高PKA的含量。而PKA含量的提高可能会导致海藻糖含量的提高,这与图2所示结果一致。

图8 BCY1和Actin基因特异性片段熔点的Real-Time PCR分析Fig.8 Real-Time PCR analysis of specific melting points of BCY1 and Actin genes

图9 基因BCY1的标准曲线Fig.9 Standard curve of gene BCY1

图10 不同发酵体系中酵母BCY1基因的相对表达量Fig.10 Relative expression levels of yeast BCR1 gene in different fermentation systems
3 讨论
生物体氧化还原状态对于细胞适应外界环境起到重要的指示作用[18-19]。研究表明多种信号分子作用于膜受体后,可通过G蛋白激活腺苷酸环化酶,产生第二信使cAMP。cAMP作为第二信使,进一步激活PKA、Epac及下游的调控元件,从而调节细胞内活动[20]。本文中cAMP-PKA做为胞外信号转导途径,其关键基因CYR1的相对表达量升高使得其编码腺苷酸环化酶酶活提高,从而使得cAMP含量升高,激活PKA。而PKA的活性与海藻糖产量存在密切关系,PKA的增多促使酵母产生海藻糖抵抗外界环境变化。
王建发等研究证明芍药苷通过cAMP-PKA信号通路发挥对心肌梗死大鼠的保护作用,且治疗作用呈剂量相关性[21]。张莘莘等研究黑灵芝多糖能够引起胞内cAMP浓度升高、PKA活性增强,从而激活小鼠结肠癌细胞内cAMP-PKA信号[22]。研究证明柴胡皂苷A降低IL-1β的致热作用可通过降低下丘脑cAMP的分泌和PKA的活性,抑制胞浆信号转导通路PKA系统实现[23]。三七叶总皂苷能逆转抑郁大鼠行为学症状以及调节海马体cAMP、PKA、BDNF的水平。三七叶总皂苷具有良好的抗抑郁作用,其作用机制与调控海马体cAMP、PKA、BDNF水平有关[24]。综合前人研究,cAMP-PKA途径的调控作用广泛存在于生物体中,对调节各方面机能起着重要的作用,而本文也正是依托海藻糖的变化对cAMP-PKA途径进行了研究,CYR1作为调控cAMP的关键基因,CYR1的升高与cAMP的酶活呈现相同变化趋势,这说明在氧化胁迫下加入原花色素可以从基因水平改变表达量,从而使得腺苷酸环化酶酶活升高,增加了cAMP的生成量;cAMP的变化导致PKA含量的增加,最终使得海藻糖增加,以保护酵母抵抗逆境。

