墨兰假鳞茎瓶内诱导及其生长的影响因素研究
林辉锋 莫智龙 陈昌铭

摘 要:为探寻墨兰瓶内诱导假鳞茎形成和生长膨大的最佳配方组合,以墨兰组培苗为材料,研究不同基础培养基种类、蔗糖浓度、pH值、激素组合对兰属墨兰假鳞茎形成和生长的影响。结果表明:诱导墨兰假鳞茎形成和促进其生长的最佳基本培养基为N6、蔗糖浓度30 g·L-1、pH 5.2、激素组合6BA 0.1 mg·L-1+ZT 0.5 mg·L-1+NAA 0.5 mg·L-1。该研究结果可促进墨兰组培苗假鳞茎的形成及生长,提高幼苗成活率、缩短种苗栽培时间。
关键词:墨兰;假鳞茎;诱导;生长;培养基
Abstract:In order to explore the best formula combination for inducing the formation and growth expansion of Cymbidium sinense in the bottle, the effects of different types of basal culture medium, sucrose concentration, pH value and hormone combination on the formation and growth of Cymbidium sinense were studied. The results showed that the optimal formula combination for inducing the formation and growth of Cymbidium sinense pseudobulb was that basic culture medium of N6, sucrose concentration of 30 g·L-1, pH value of 5.2, and hormone combination of 6BA 0.1 mg·L-1+ZT 0.5 mg·L-1+NAA 0.5 mg·L-1. The results could promote the formation and growth of tissue culture seedling pseudobulb of Cymbidium sinense, improve the survival rate of seedlings and shorten the cultivation time of seedlings.
Key words:Cymbidium sinense; Pseudobulb; Induce; Growth; Culture medium
墨蘭Cymbidium sinense,别称报岁兰、拜岁兰,隶属兰科兰属地生兰,原产我国台湾、福建南部、广东、广西等地,为七大类传统国兰之一。其叶片形态独特飘逸,花序直立,花量大,花色素雅,花瓣幽香四溢,有“花中君子”之美称,深受消费者的喜爱。同时,墨兰的根还具有一定的平喘药用功效[1],其花亦可提取精油[2],做一些美容化妆品。墨兰集观赏、药用和经济价值为一体,为我国出口量最大的国兰种类[3]。
传统采用对野生兰花的大量挖掘和分株进行国兰种苗繁育,因其破坏种质资源、繁殖系数小、生长周期慢等特点,远远不能满足膨胀的兰花市场需求[4],植物组织培养能有效缓解当前的状况[5]。自1973年科研人员通过建兰进行组织培养成功获得无菌植株,之后相继建立了春兰、墨兰等组织培养快速繁殖无性系[6-7],当前国内在国兰组培快繁体系研究上较为完善。假鳞茎是兰科植物特有的变态茎,能够长出叶芽与花芽,并且储存水分与养分[8],假鳞茎的兴衰可直接影响兰花的生长。谢玲超等[9]报道了通过假鳞茎出芽萌生龙根,再由龙根顶芽分生出叶和假鳞茎组织,最后发育成兰株的地上组织的兰花假鳞茎繁殖技术,进一步探讨了不同栽植期、不同种类兰花对假鳞茎成苗时间长短的影响,但主要体现在室外栽培上。室内关于兰科植物假鳞茎方面的组培研究主要集中在白芨方面,李慧敏等[10]通过研究得出假鳞茎在促进白芨组培苗成活率的提高、生育周期的缩短方面效果显著。孙宇龙[11]为了探究组织培养中白芨假鳞茎的诱导和增大的最佳培养基配方,进行了单因素试验和多因素正交试验,并得出了最佳培养基配方。国兰假鳞茎的组培研究上,仅有汤访评[12]研究了通过形态解剖研究黑暗处理条件下春兰组培苗的假鳞茎发育,观察了假鳞茎伸长、发育形成根状茎,其形态未有变化。在本实验室前期的组织培养过程中发现,拥有假鳞茎的组培苗生长情况明显较好、死亡率较低,诱导假鳞茎的形成在提高国兰组培苗质量方面效果显著,能有效提高组培苗的成活率。因此,研究探寻墨兰瓶内诱导假鳞茎形成和生长膨大的最佳配方组合,对提高幼苗成活率、缩短种苗栽培时间都具有重要意义。
1 材料与方法
1.1 试验材料
供试墨兰组培苗来自三明市农业科学研究院花卉研究所,组培种苗规格为高度6 cm,带根3条。
1.2 试验方法
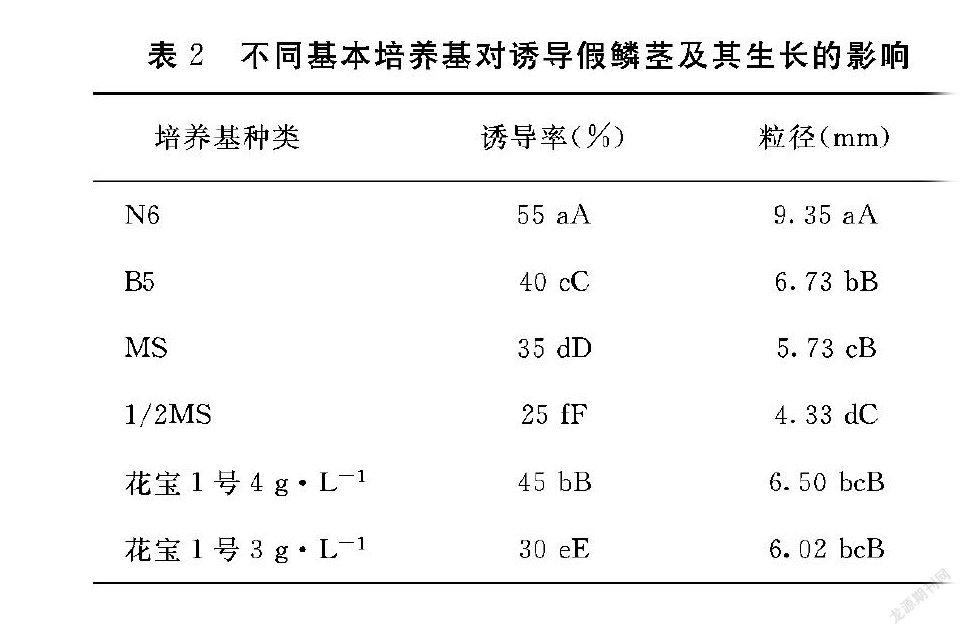
1.2.1 不同基本培养基对墨兰假鳞茎诱导及其生长影响 试验设计基本培养基分别为:N6、B5、MS、1/2MS、花宝1号4 g·L-1、花宝1号3 g·L-1。每种基本培养基内附加活性炭1 g·L-1、香蕉泥50 g·L-1。每种培养基3瓶,每瓶接种5株幼苗,重复3次。置于温度23~25℃,光强1800 lx,光照时间16 h的培养室中培养。
1.2.2 不同蔗糖浓度对墨兰假鳞茎诱导及其生长影响 试验设计以N6为基本培养基,设置蔗糖浓度梯度为0、10.0、20.0、30.0、40.0 g·L-1。培养基内附加活性炭1 g·L-1、香蕉泥50 g·L-1。每种培养基3瓶,每瓶接种5株幼苗,重复3次。置于温度23~25℃,光强1800 lx,光照时间16 h的培养室中培养。
1.2.3 不同pH值对墨兰假鳞茎诱导及其生长影响 试验设计以N6为基本培养基,设置pH梯度为5.4、5.2、5.0、4.8、4.5。培养基内附加活性炭1 g·L-1、香蕉泥50 g·L-1。每种培养基3瓶,每瓶接种5株幼苗,重复3次。置于温度23~25℃,光强1800 lx,光照时间16 h的培养室中培养。
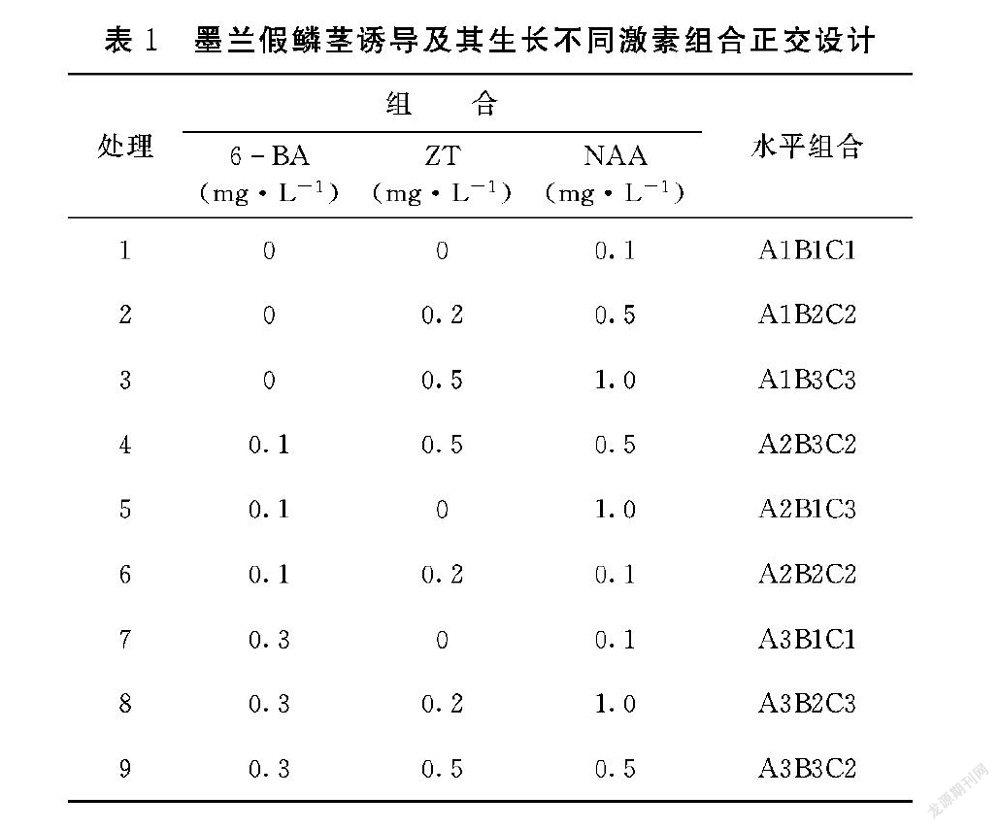
1.2.4 不同种类激素组合对墨兰假鳞茎诱导及其生长影响 试验设计以N6为基本培养基,添加6BA、ZT、NAA 3种激素,采用三因素三水平的正交试验设计(表1),共9个处理。培养基内附加活性炭1 g·L-1、香蕉泥50 g·L-1、蔗糖30 g·L-1、pH 5.2。每种培养基3瓶,每瓶接间16 h的培养种5株幼苗,重复3次。置于温度23~25℃,光强1800 lx,光照时室中培养。
1.2.5 观察测量和数据统计分析 待培养90 d后,从培养瓶内移出组培苗,在操作台上去除组培苗上附着的培养基等残留物,用无菌水清洗过后用游标卡尺测量假鳞茎粒径,并计算诱导率。得到的数据用SPSS软件进行分析处理。假鳞茎粒径、平均粒径及平均诱导率的计算方法:
2 结果与分析
2.1 不同基本培养基对墨兰假鳞茎诱导及其生长影响
从表2可以看出,6种基本培养基在诱导组培苗假鳞茎形成方面存在着极显著差异,其中诱导组培苗假鳞茎形成效果最好的是N6,诱导率达到55%,6种基本培养基对假鳞茎的诱导效果依次为N6>花宝1号4 g·L-1>B5>MS>花宝1号3 g·L-1>1/2MS;MS、花宝1号4 g·L-1、花宝1号3 g·L-1在促假鳞茎生长方面差异不显著,因此对促进假鳞茎生长膨大影响的差异不大。6种基本培养基对促进假鳞茎生长膨大的效果依次为N6>B5>花宝1号4 g·L-1>花宝1号3 g·L-1>MS>1/2MS。由此可见,墨兰假鳞茎诱导较佳基础培养基为N6。
2.2 不同蔗糖浓度对墨兰假鳞茎诱导及其生长影响
从表3可以看出,组培苗假鳞茎的诱导率随着蔗糖浓度的提升不断提高,假鳞茎的平均粒径随着蔗糖浓度的提高出现先升高后下降的情况。当蔗糖浓度为20、30 g·L-1时,假鳞茎粒径达到最大,两者差异不显著,在假鳞茎诱导率上,蔗糖浓度30 g·L-1显著大于20 g·L-1,因此研究认为蔗糖浓度30 g·L-1是较为适合的假鳞茎诱导和生长蔗糖浓度,在此浓度下,组培苗假鳞茎的诱导率高,并能很好地促进假鳞茎的生长发育。
2.3 不同pH值对墨兰假鳞茎诱导及其生长影响
從表4可以看出,在诱导率上,pH 5.4、5.2、5.0时假鳞茎的诱导率不存在显著性差异,pH 4.8、4.5同样不存在显著性差异,随着pH值的降低,假鳞茎的诱导率呈现下降趋势。而在粒径上,所设定的pH值对假鳞茎的膨大生长不存在显著性差异。综合数据分析,pH 5.2为诱导假鳞茎及其生长较适合的pH值。
2.4 不同激素组合对诱导假鳞茎及其生长的影响
从表5可以看出,根据正交设计的方差分析,以诱导率为目的时,3种激素的主效作用6BA>NAA>ZT。以粒径为目的时,3种激素的主效作用6BA>ZT>NAA,进一步多重比较分析(表5),当激素组合6BA 0.1 mg·L-1、ZT 0.5 mg·L-1、NAA 0.5 mg·L-1时,是诱导假鳞茎形成并促进其生长的最佳激素浓度,其诱导率可达90.33%,粒径达12.36 mm。
3 讨论与结论
假鳞茎是兰花储存养分和水分的器官,花芽和叶芽都着生在假鳞茎的基部根茎部分,假鳞茎的大小可直接影响兰花生长壮弱[13]。假鳞茎的大小受兰花品种、植株健壮度等影响[14]。培养基是组织培养中试验材料生存和发育的根基,犹如栽培植物的土壤和施用的肥料[15],对离体兰花器官和组织细胞的生长至关重要。其主要由无机盐、有机化合物和复合添加物组成,不同植物对营养的需求随植物种类不同而有变化。本试验研究N6、B5、MS、花宝1号4 g·L-1、花宝1号3 g·L-1作为基本培养基对墨兰假鳞茎诱导及其生长的影响,结果表明N6培养基是对墨兰假鳞茎诱导较适宜培养基。MS培养基为兰花组织培养最常用的培养基,能满足大多数兰花组织培养的营养需求,其钾盐、铵盐含量较高,为高盐成分培养基。因此,采用MS培养基进行兰花组织培养有时显得营养过剩。B5和N6为高硝酸盐培养基,B5含较高的盐酸硫胺素和较低的氨态氮,在兰花培养上适用于发芽和壮苗培养;N6培养基最初是为培养禾谷类植物花药和花粉设计的,其优点是培养基的组成成分比较简单,能基本满足兰花假鳞茎生长过程中对于营养元素供给的要求。而花宝1号为设施栽培培育种苗常用的肥料,本研究结果表明随着花宝1号施用量增加,兰花假鳞茎诱导率显著提高,而粒径表现差异不显著,这可能与花宝1号中的氮含量较少所致,建议在用花宝1号为基本培养基时可适当添加硝酸铵以平衡氮素含量。
植物组织培养过程中的碳源主要来源是培养基添加蔗糖,有时也会使用麦芽糖或乳糖,果糖和葡萄糖则见少量使用[16]。组培苗的生长情况在不同的糖浓度影响下也是不同的,糖类不仅能提供组培苗生长发育过程中所需要的能量,而且还具有调节培养基渗透压的作用,使培养基的渗透压始终保持在相对稳定的状态。本研究结果表明30 g·L-1是较为适合假鳞茎诱导和生长的蔗糖浓度,在此浓度下,组培苗假鳞茎的诱导率较高,且有利于假鳞茎生长发育。自然界中兰花生长于偏酸性、腐殖质丰富的土壤中,成株栽培最佳pH范围为4.5~5.5,兰花原球茎在偏酸性的条件下生长较好。国兰组培时对培养基pH较为敏感,培养基pH值一般在5.1~5.4范围内[14]。本研究结果显示pH 5.2是较为适合的pH值,有利于假鳞茎的诱导与促进其生长膨大,与前人报道一致。
植物激素是一类小分子的简单有机化合物,具有十分复杂、多样的生理效应,在植物的生长发育上发挥着很大的调节功能[17]。不同的激素组合搭配使用的效果不同,相同的激素组合搭配时用量不同,其效果也不同。不同用量的配比对组培苗生长发育的影响存在差异,如常见的生长素(NAA)与细胞分裂素(BA)配合使用时,如果NAA含量較多,则芽的分化受到促进,如6BA含量较多,则有利于类原球茎的增殖与根的形成。本研究结果发现,当6BA浓度为0.1 mg·L-1、ZT浓度为0.5 mg·L-1、NAA浓度为0.5 mg·L-1时,组培苗假鳞茎的诱导率最高,达90.33%;以浓度0.5 mg·L-1ZT与浓度0.1 mg·L-1NAA两者搭配,对促进组培苗假鳞茎的生长效果最好,粒径达到13.28 mm。6BA对诱导假鳞茎的形成效果最好,对促进假鳞茎的生长效果不明显。
综上所述,本研究针对墨兰假鳞茎瓶内诱导及其生长的影响因素进行研究,筛选出墨兰假鳞茎瓶内诱导及其生长的最佳基本培养基为N6、蔗糖浓度30 g·L-1、pH 5.2、激素组合6BA 0.1 mg·L-1+ZT 0.5 mg·L-1+NAA 0.5 g·L-1。在此条件下兰花组培苗假鳞茎的诱导效果最佳,生长膨胀情况最好。
参考文献:
[1]柯文明,关见留,曾晓春.墨兰的急性毒性和平喘的初步研究[J].广东教育学院学报,2004,24(2):87-89.
[2]李杰,王再花,章金辉,等.墨兰品种‘企黑’的花朵精油成分分析[J].热带作物学报,2016,37(1):86-91.
[3]谢利,王芬,曾瑞珍, 等.农杆菌介导的墨兰遗传转化[J].生物工程学报,2015,31(4):542-551.
[4]凌晓祺.国兰花期调控与组培快繁技术优化的研究[D].杭州:浙江大学,2016.
[5]程芬芳,陈新荣,陈莹莹,等.墨兰的组织培养研究进展[J].黑龙江农业科学,2015(3):155-159.
[6]余道平.春兰组织培养技术体系研究[D].成都:四川农业大学,2005.
[7]周辉明,林辉锋,尚伟,等.垂花蕙兰种子无菌播种和快速繁殖[J].福建农业学报,2013, 28(10):18-22.
[8]张毓,张佐双,赵世伟.世界观赏兰花[M].沈阳:辽宁科学技术出版社,2004.
[9]谢玲超,单筱玲,邰雁眉,等.兰花假鳞茎繁殖技术研究初报[J].现代园艺,2007(2):13.
[10]李慧敏,杨冠海,李明静,等.白芨瓶内假鳞茎诱导研究[J].南方农业学报,2013, 44(10):1607-1612.
[11]孙宇龙.白及的假鳞茎诱导、遗传资源鉴定与评价的研究[D].南京:南京师范大学,2015:4,11-18.
[12]汤访评.黑暗条件下春兰组培苗假鳞茎发育的形态解剖研究[C]//中国观赏园艺研究进展,北京:中国林业出版社,2013:274-277.
[13]王春华.怎样甄别兰草的壮弱[J].花卉,2007(9):14.
[14]李子红,贾燕.珍品兰花快速繁殖与养护[M].上海科学技术出版社,2006.
[15]余道平.春兰组织培养技术体系研究[D].成都:四川农业大学,2005.
[16]丁燕芬,王岩,龙春林.中国兰花组织培养研究进展[J].安徽农业科学,2007(8):2247-2248,2250.
[17]傅向东,钱秀红,毛碧增,等.几种理化因子对建兰原球茎生长分化的影响[J].浙江农业大学学报,1997(5):65-68.
(责任编辑:柯文辉)

