守恒法在高中化学解题中的应用
万正国
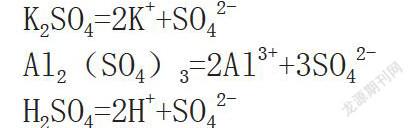
摘 要:在高中化学课程的教育指导中,守恒法有着积极的应用价值,也贯穿在高中化学课程教学的始终,是学生解决化学问题的宠儿。在本文中就从质量守恒、电荷守恒等方面出发,浅谈如何有效地落实化学课堂中的守恒法应用。
关键词:高中化学;守恒法;质量守恒
“守恒”强调的是前后的不变性,目的是在变化的化学反应当中找出不变的元素,诸如质量守恒、电荷守恒,以及原子守恒等,以便找到化学习题解决的突破口,从而提高问题解决的效率。
一、质量守恒
例1:在下列表述中,与质量守恒定律相符的是()
A一根蜡烛进行燃烧,在燃烧之后生成的水和二氧化碳的质量和与原蜡烛的质量相等
B将镁条在空气中进行燃烧,最后得到的生成物要比原本镁条的质量多
C将高锰酸钾进行加热分解后,剩余的固体质量与原本放入的高锰酸钾质量一致
D粗盐过滤前后得到的精盐和杂质的质量与原本粗盐的质量相等
习题解析:要完成对本题的分析,我们首先应当明确质量守恒定律中涉及的各个要素,一是化学反应,一是参与反应前后的质量等。所以,在A选项当中,参与反应的物质是蜡烛和氧气,生成的物质是水和二氧化碳,所以,单纯地说蜡烛的质量与生成物之间的质量是不对等的。因此,A选项错误。镁条在空气中进行燃烧的过程,需要有氧气的介入,而氧气的质量和镁条的质量之和与生成物的质量之和是相等的,因此,单纯比较镁条和燃烧后的物质,自然后者要大于前者。所以,B选项正确。在高锰酸钾受热分解后,生成物中包含氧气这一气体,而气体并不会附着在固体上,因此,剩余的固体质量是要小于原本参与反应的反应物的质量,因此,C选项错误。而在D选项当中所描述的现象不是化学反应,因此不能够使用质量守恒定律进行描述。综上所述,本题的正确选项是B。
二、电荷守恒
例2:有硫酸鉀、硫酸铝和硫酸所组成单混合溶液,其PH=1,铝离子的物质的量浓度是0.4mol/L,硫酸根离子的
物质的量浓度是0.8mol/L,则钾离子的物质的量浓度是多少呢?
A.0.25mol/LB.0.2mol/LC.0.3mol/LD.0.4mol/L
习题解析(一般解法):由硫酸钾、硫酸铝和硫酸的化学式进行推理:硫酸钾(K2SO4)、硫酸铝[Al2(SO4)3]、硫酸(H2SO4),在将这三种溶液进行混合后,溶液中的硫酸根的来源也就确定了。在明确溶液的PH值是1后,可以得知溶液当中的c(H+)=10-1mol/L。之后,将溶于溶液中的三种物质电离方程式进行书写:
K2SO4=2K++SO42-
Al2(SO4)3=2Al3++3SO42-
H2SO4=2H++SO42-
由上述电离方程式可知,通过硫酸电离的硫酸根的物质的量浓度是氢离子的一半,所以硫酸根的物质的量浓度是0.05mol/L;通过硫酸铝电离出的硫酸根的物质的量浓度是铝离子的1.5倍,而从题目可知铝离子的物质的量浓度是0.4mol/L,所以硫酸根的物质的量浓度是0.6mol/L;而通过硫酸钾溶液电离出的硫酸根物质的量浓度是总硫酸根物质的量浓度减去硫酸铝和硫酸的,因此数值为0.8mol/L-0.6mol/L-0.05mol/L=0.15mol/L。同时,通过硫酸钾电离后得到的硫酸根物质的量浓度是钾离子的一半,所以钾离子的物质的量浓度是0.15mol/L×2=0.3mol/L。因此,本题的正确答案是C。
三、原子守恒
例3:将适量的浓硝酸和一定量的铜进行反应,在铜被完全溶解后,一共得到22.4毫升的气体,那么在整个浓硝酸与铜进行作用的过程中,使用的硝酸物质的量是多少?已知铜的质量是38.4毫克,气体也存在于标准状况下。
习题解析:这道题目是典型的使用原子守恒进行计算的习题。通过题目中的描述,以及我们对硝酸和铜反应的了解,我们能够知道,在整个反应的过程中,参与反应的物质是硝酸和铜,生成的物质包含硝酸铜和一氧化氮或者二氧化氮,其中硝酸起到了不同的作用。
具体来说:
当硝酸与铜进行反应时,一部分硝酸起到酸的作用生成硝酸铜,在这一过程中用去的硝酸的物质的量=2n(Cu)=(38.4×10-3)÷64mol×2=1.2×10-3mol;另一部分硝酸起到氧化的作用,不管生成的气体成分是什么,都是硝酸的还原产物,所以这部分硝酸的物质的量是(22.4×10-3)÷22.4mol=1×10-3mol。所以,在整个反应的过程中,一共消耗的硝酸的物质的量是1.2×10-3mol+1×10-3mol=2.2×10-3mol。
四、电子守恒
例4:硫化亚铁与一定浓度的硝酸进行反应,生成硝酸铁、硫酸铁、二氧化氮、四氧化二氮、一氧化氮和水,当二氧化氮、四氧化二氮、一氧化氮的物质的量之比是1:1:1时,反应物之间的物质的量比是多少呢?
习题解析:此反应是氧化还原反应,在反应过程中的得失电子数是相等的,所以,如若将参与得失电子反应的硫化亚铁、硝酸的物质的量分别设定为a、b,则根据得失电子守恒,会有a×(1+8)=(b÷4)×1+(b÷4)×2+(b÷4)×3,b=6a。此外,因为起酸性作用的硝酸的物质的量是硝酸铁的物质的量的三倍,即3×(a-a/3×2)=a,所以,参与反应的硫化亚铁和硝酸的物质的量之比是a:(a+b)=1:7.
总而言之,守恒法在高中化学教学中具有积极的应用价值,也是教师指导学生提高解题效率的不二法宝。
参考文献
[1]李睿哲.高中化学的解题思路和技巧[J].科技风,2016(24):195.
[2]刘霞.守恒法在高中化学解题中的应用分析[J].中学化学教学参考,2016(18):51.

