低温胁迫对转SoTUA基因甘蔗生理生化特性的影响
唐丽华 黄婵 陈教云 杨丽涛 邢永秀 农友业 李杨瑞




摘要:【目的】研究低溫胁迫对转α-微管蛋白(TUA)基因甘蔗生理生化特性的影响,对甘蔗TUA基因(SoTUA)进行功能鉴定,为甘蔗抗寒品种选育提供参考依据。【方法】通过对pCAMBIA3300载体上的标记基因GFP进行PCR扩增及测序,鉴定转SoTUA基因阳性甘蔗品系。从中选择4个转基因品系(L1、L2、L3和L4),以野生型ROC22植株为对照(CK),对各处理进行低温(4 ℃)胁迫处理,在胁迫第0、4、7和12 d时分别测定不同处理甘蔗的生理生化指标。【结果】运用PCR筛选得到转SoTUA基因T1代甘蔗植株,对其中4个品系及CK的低温胁迫试验结果表明,在低温下各品系可溶性糖含量以不同模式变化,转基因各品系普遍高于CK;各品系中的可溶性蛋白在冷驯化前期强烈诱导,总体变化趋势为先升高后降低,转基因各品系普遍高于CK;各品系中丙二醛(MDA)含量增加,其中CK的增幅最大;过氧化物酶(POD)活性下降,除L2外,POD活性变化总体上呈先升高后降低的变化趋势;脯氨酸含量在低温胁迫过程中的变化趋势无明显规律。利用改进的极点排序法对各品系抗寒性进行评价,可知各品系抗寒性强弱排序为:L3>L1>L2>L4>CK。【结论】低温胁迫下4个转SoTUA基因甘蔗品系在生理生化指标上的表现均优于CK,即SoTUA基因在甘蔗体内的过量表达有利于甘蔗抗寒性能的提高。
关键词: 甘蔗;SoTUA基因;生理生化;抗寒性
中图分类号: S566.101 文献标志码: A 文章编号:2095-1191(2019)05-0950-07
Abstract:【Objective】This study was conducted to investigate the effects of low temperature stress on physiological and biochemical characteristics of α-tubulin(TUA) transgenic sugarcane,and to identify the function of sugarcane TUA gene(SoTUA). It provided reference for sugarcane cold-resistant variety breeding. 【Method】SoTU Atransgenic sugarcane lines were identified by PCR amplification and sequencing of GFP marker gene on vector pCAMBIA3300. Four transge-nic lines(L1,L2,L3 and L4) were chosen for a low temperature(4 ℃)stress assay when the wild type of sugarcane variety ROC22 was used as control(CK). The changes of physiological and biochemical indexes were measured at 0,4,7,12 d after treatment. 【Result】The SoTUA transgenic T1 sugarcane plants were screened by PCR, and the results of low temperature stress assay on four lines and the control showed that the soluble sugar content of each line varied in different patterns at low temperature, and the transgenic lines were generally higher than the CK. Soluble protein of all lines was strongly induced in the early stage of cold treatment, the overall change trend was first increased and then decreased, and the transgenic lines were generally higher than the CK. Malonaldehyde(MDA) content in each line increased, especially in the control. Peroxidase(POD) activity decreased, except for L2, POD activity generally increased and then decreased. The proline content change had no obvious regulations during the low temperature stress. The improved pole ordination me-thod was used for the comprehensive evaluation of cold resistance. The results showed that the cold resistance of all the lines was ranked as L3>L1>L2>L4>CK. 【Conclusion】The physiological and biochemical performances of the four SoTUA transgenic sugarcane lines were better than the CK under low temperature stress. Therefore,it can be concluded that the overexpression of SoTUA gene in sugarcane is conducive to the improvement of cold resistance.
Key words: sugarcane; SoTUA gene; physiology and biochemistry; cold resistance
0 引言
【研究意义】甘蔗是热带和亚热带作物,属喜温、喜光作物(李杨瑞,2010)。寒害不仅影响甘蔗的地理分布,同时降低甘蔗的蔗糖分和产量,是甘蔗产区的主要气候灾害之一(欧钊荣等,2008)。利用传统育种方法提高作物耐寒性收效甚微(Sanghera et al.,2011),而转基因等分子生物技术可为提高甘蔗抗寒性提供有效方法。微管是细胞骨架的重要组成成分,在细胞生长及维持细胞形态中发挥重要作用,此外微管与质膜密切相连,被认为是信号感知与转导的主要场所及下游通路的主要靶标(Gilroy and Trewavas,2001;Wasteneys and Galway,2003)。已有研究报道了微管对作物抗寒性的直接作用(Pihakaski-Maunsbach and Puhakainen,1995)。α-微管蛋白(TUA)是微管的主要成分之一(Farajalla and Gulick,2007)。因此,对转TUA基因甘蔗不同品系进行低温胁迫,通过测定其生理生化指标的变化而评价各品系的抗寒性,并对甘蔗TUA基因(SoTUA)进行功能鉴定,可为甘蔗抗寒品种选育提供参考依据。【前人研究进展】在低温胁迫下,微管在调节及传导信号中扮演重要角色,微管瞬时解聚可触发植物冷驯化,增强植物抗寒性(Abdrakhamanova et al.,2003)。Kerr和Carter(1990)研究发现,低温胁迫下,微管稳定剂处理可使黑麦抗寒性降低,说明微管瞬时解聚有利于增强植株抗寒性。Abdrakhamanova等(2003)选取3种不同抗寒性的小麦品种进行低温胁迫,发现在抗性品种中微管发生瞬时快速解聚并形成冷稳定性微管;敏感性品种未觀察到微管瞬时解聚,当使用除草剂脉冲处理使微管解聚后,则可诱导抗寒性。Farajalla和Gulick(2007)在小麦中鉴定出15个TUA家族基因,且发现这些基因的表达量在低温下以不同的模式变化。张云(2015)在华南忍冬中克隆得到TUA3基因,将其转入拟南芥中,结果表明,转TUA3拟南芥在高钙胁迫下可维持较高的细胞质浓度。【本研究切入点】本课题组前期从甘蔗品种GT28叶片中克隆得到SoTUA基因,基因全长1558 bp,编码450个氨基酸,其编码蛋白分子质量为49.6 kD,理论等电点为4.8(张保青,2013);并通过农杆菌转化法将SoTUA基因转入甘蔗品种ROC22中,通过PCR检测获得转SoTUA基因阳性T0代植株(孙波,2016)。对于已获得的转SoTUA基因阳性甘蔗植株,其后代在抗寒方面的功能还有待进一步验证。【拟解决的关键问题】对已获得的转SoTUA基因阳性甘蔗植株后代进行低温胁迫,测定转SoTUA基因甘蔗品系的生理生化指标变化,对转SoTUA基因进行功能验证,为SoTUA基因功能研究及甘蔗抗寒品种选育提供参考依据。
1 材料与方法
1. 1 试验材料
试验材料为本课题组获得的T1代转SoTUA基因甘蔗中的4个品系(L1、 L2、L3和L4),对照为野生型ROC22植株(CK)。
1. 2 试验方法
试验于2017年8月在广西大学甘蔗研究所温室大棚内进行。甘蔗长至8叶时,选取长势一致的植株,转入人工气候培养室进行4 ℃低温处理,光强为200~300 μmol/m2·s,光周期为12 h,相对湿度为60%~70%。低温处理时长为12 d,每个品系每处理重复4次,分别在0、4、7和12 d采集植株+1叶,经液氮冷冻后,保存于-80 ℃冰箱中以备检测,采样时间为早上8:00—9:00。低温胁迫天数结合甘蔗植株外部形态变化进行设计,在低温胁迫4和7 d时,观察到对照组甘蔗植株叶片发生不同程度的卷曲,其比例分别为50%和75%(发生卷曲株数/总株数),在12 d时观察到叶脉发生水渍化。
1. 3 转基因甘蔗鉴定
1. 3. 1 转基因甘蔗DNA提取 在甘蔗移栽存活后,采集植株+1叶,去掉叶脉,采用改进的SDS方法提取叶片DNA(邵敏,2015)。
1. 3. 2 PCR检测 根据pCAMBIA3300载体上的标记基因GFP设计1对引物,引物序列为GFPF(5'-GATGGCCCTGTCCTTTTACCA-3')和GFPR(5'-TT TTCGTTGGGATCTTTCGAA-3'),扩增产物长度为700 bp。以提取的转基因甘蔗叶片DNA为模板,进行PCR检测。PCR反应体系25.0 μL:2×Taq MasterMix 12.5 μL,上、下游引物各1.0 μL,DNA模板2.0 μL,RNase-Free H2O 8.5 μL。以pCAMBIA3300-SoTUA-GFP重组质粒作为阳性对照,甘蔗品种ROC22野生型植株为阴性对照,然后用1%琼脂糖凝胶电泳进行检测。切胶后使用胶回收试剂盒对PCR产物进行回收,并送至生工生物工程(上海)股份有限公司进行测序,将测序结果在NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列比对。
1. 4 测定项目及方法
可溶性糖含量采用硫酸蒽酮法测定(李合生,2000);可溶性蛋白含量采用考马斯亮蓝G-250法测定(李合生,2000);丙二醛(MDA)含量采用硫代巴比妥酸显色法测定(高俊凤,2006);过氧化物酶(POD)活性采用愈创木酚法测定(郝再彬和苍晶,2004);脯氨酸含量采用磺基水杨酸法测定(汤章城,1999)。
1. 5 统计分析
试验数据使用Excel 2007和SPSS 15.0进行处理与分析。采用改进的极点排序法对各甘蔗品系及对照组进行抗寒性评价,其中各指标采用低温胁迫处理12 d时测定值与常温时测定值的相对值来表示:相对值(%)=(低温胁迫处理下某指标测定值/常温下某指标测定值)[×]100(唐仕云等,2012)。
2 结果与分析
2. 1 转基因甘蔗DNA提取结果
如图1所示,1%琼脂糖凝胶电泳检测DNA条带,条带清晰明亮,说明DNA质量较好,可用于下一步检测。
2. 2 转基因甘蔗PCR检测结果
如图2所示,阳性对照及部分甘蔗样品在700 bp处出现明亮单一的条带,出现双条带可能是由于引物不特异所致,阴性对照与H2O均无条带。将700 bp处条带进行切割,使用胶回收试剂盒回收PCR产物后测序,测序结果表明PCR扩增产物为GFP基因,出现条带的部分甘蔗植株即为转SoTUA基因甘蔗植株。
2. 3 低温胁迫下转SoTUA基因甘蔗的生理生化变化
2. 3. 1 可溶性糖含量变化 如图3所示,随着低温胁迫时间的推进,L1和L2品系的可溶性糖含量在低温胁迫第12 d内略有降低;L3品系的可溶性糖含量呈双峰变化趋势,在第12 d时达最高值;L4品系的可溶性糖含量呈缓慢降低趋势;CK的可溶性糖含量在第4~7 d时激降,第7 d达最低值。在低温胁迫第7和12 d时,L1、L3和L4品系的可溶性糖含量分别较CK高39.9%、45.5%、54.8%和26.1%、50.6%、30.4%,均达显著差异水平(P<0.05,下同)。
2. 3. 2 可溶性蛋白含量变化 如图4所示,4个转基因品系与CK甘蔗叶片的可溶性蛋白含量总体变化趋势一致,表现为低温处理4 d内缓慢上升或下降,均在第7 d时升至最高值,随后又有所下降。在0 d时,CK的可溶性蛋白含量显著高于L1和L4品系;第4 d时,L1、L2和L3品系的可溶性蛋白含量分别比CK高30.7%、32.4%和61.6%;第7和12 d时,L2和L3品系分别比CK高53.0%、64.2%和88.3%、84.8%,差异均达显著水平。
2. 3. 3 MDA含量变化 如图5所示,4个转基因品系与CK甘蔗叶片的MDA含量均呈先降低后升高再降低的变化趋势,均在第7 d时达最高值。低温胁迫7~12 d,除L2品系外,其余3个转基因品系叶片的MDA含量均低于CK,且L4品系在第7和12 d时比CK低23.3%和36.3%,差异达显著水平;L1、L2和L3与CK差异不显著(P>0.05,下同)。
2. 3. 4 POD活性变化 如图6所示,L1和L3品系与CK甘蔗叶片中POD活性呈先升高后降低的变化趋势,L2和L4品系的POD活性则整体呈降低趋势。在低温胁迫过程中,L1、L3和L4品系的POD活性与CK无显著差异,而L2品系的POD活性在第0和12 d时分别比CK高86.8%和68.4%,差异达显著水平。
2. 3. 5 脯氨酸含量变化 如图7所示,4个转基因品系与CK叶片的脯氨酸含量在低温胁迫过程中的变化趋势存在差异,但均在胁迫第4 d时较0 d出现降低趋势,此时各处理间差异不显著;胁迫至第7 d时,L1、L2和L3品系的脯氨酸含量大幅回升,高于CK,而L4品系和CK的脯氨酸含量仍保持较低水平;胁迫延长至第12 d时,除L3品系的脯氨酸含量有所上升外,其余品系均较第7 d时有所下降。在0 d时L3品系的脯氨酸含量比CK高34.8%,第7 d时L1和L2品系的脯氨酸含量分别比CK高160.3%和182.2%,第12 d时L1和L3品系的脯氨酸含量分别比CK高154.6%和270.8%,差异均达显著水平。
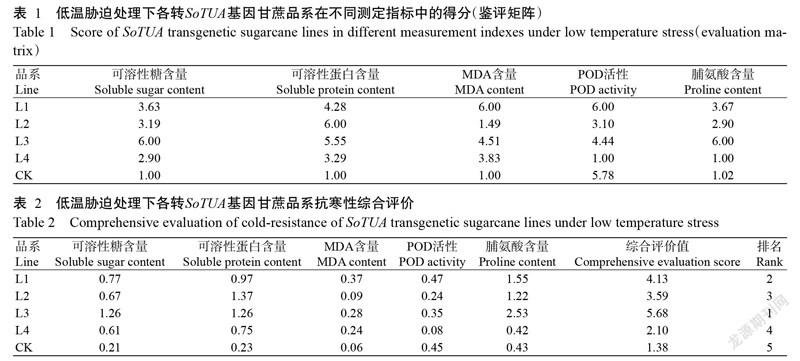
2. 4 不同转SoTUA基因甘蔗品系的抗寒性评价
植物抗寒性是一种复杂的遗传特性,受多种环境因素的影响,为更全面评估各品系的抗寒性,采用改进的极点排序法进行评分,结果如表1和表2所示。可溶性糖含量、可溶性蛋白含量、MDA含量、POD活性和脯氨酸含量的权重系数分别为:0.21、0.23、0.06、0.08和0.42。各品系各指标的对应得分如表1所示,该得分与各指标权重系数的乘积详见表2。综合得分越高,说明该品系的抗寒性越好。由表2综合评价值排名可看出,低温胁迫下各品系抗寒性强弱排序为:L3>L1>L2>L4>CK。
3 讨论
甘蔗在经历一段非冰冻低温后可增强其植株抗冻性,即冷驯化(Selvarajan et al.,2018)。为有效激活冷驯化,植株必须感知低温并进行信号转导。低温下,抗性品种微管快速瞬时解聚并形成冷穩定性微管,其低温敏感性被认为是决定植株抗寒性的因素之一,在信号感知及信号转导方面发挥重要作用(Wang and Nick,2017)。微管在冷驯化中的作用已有相关研究报道(Abdrakhamanova et al.,2003;Wang and Nick,2017)。在此基础上,本研究通过测定转SoTUA基因甘蔗在低温胁迫过程中生理生化指标的变化,探究其在提高抗寒性方面的功能,为甘蔗抗寒品种选育提供依据。
冷驯化过程中,甘蔗体内发生一系列生理生化变化来提高植株抗寒性,以适应低温环境(Selvarajan et al.,2018)。可溶性糖、可溶性蛋白及脯氨酸等物质的合成可使植株免受冰冻损伤。可溶性糖能去除羟自由基,间接诱导蛋白合成;可溶性蛋白是细胞内重要的渗透调节物质;脯氨酸不仅可降低细胞的水电位,还可促进蛋白的水合作用,从而在细胞保护中发挥一定作用(Liu et al.,2003;Kaplan et al.,2010;Perea-Resa et al.,2017;Selvarajan et al.,2018)。有研究表明,低温胁迫下可溶性糖合成的相关基因发生上调(Selvarajan et al.,2018;Wang et al.,2018),同时多种蛋白质富集,如防御蛋白、保护蛋白(Kazemi-Shahandashti and Maali-Amiri,2018)。严寒静和谈锋(2005)研究表明,可溶性糖、可溶性蛋白含量与植物抗寒能力呈正相关;杨德光等(2018)研究表明,在非生物胁迫下,脯氨酸含量在一定程度上反映植物的抗逆性强弱。本研究中,在低温胁迫下,各转SoTUA基因甘蔗品系的可溶性糖和可溶性蛋白含量普遍高于对照,说明转基因甘蔗品系的抗寒性相对较强。各甘蔗品系的可溶性糖含量以不同规律变化,可能与其对低温的敏感度及应激能力差异有关;可溶性蛋白含量在冷驯化前中期强烈诱导以响应低温,总体变化趋势为先升高后降低,脯氨酸含量的变化趋势无明显规律,与邹凯茜等(2018)对低温胁迫下苦瓜幼苗渗透调节物质含量的变化趋势不完全一致,可能与低温处理时间及温度高低等胁迫条件有关。
在低温胁迫下,植物体内的活性氧(ROS)会产生积累,膜脂是ROS的主要靶物质,产生氧化反应产物,其中包括MDA,MDA与蛋白结合使膜蛋白变性,降低膜流动性(Peng et al.,2007;Kazemi-Shahandashti et al.,2013;Wang and Nick,2017)。因此,MDA含量可作为膜脂损伤程度的判断指标。罗明珠等(2005)报道,低温胁迫后MDA含量的增幅与甘蔗植株抗寒能力呈负相关。本研究中,在低温胁迫第4 d时,各甘蔗品系的MDA含量有所下降,可能是因为MDA与细胞膜蛋白结合,使细胞膜受到损伤,细胞内物质发生渗透,致使MDA含量降低。但低温胁迫后各甘蔗品系的MDA含量均有所上升,其中对照的增幅最大,说明对照对低温相对较敏感,与吴佳溶等(2018)报道的不同品种烤烟在低温胁迫后MDA含量均增加的结果一致。
ROS是有毒化合物,对蛋白质、DNA、脂质和其他细胞成分造成氧化损伤,而POD等保护酶活性增加有利于ROS的清除,减轻植株寒害损伤(Apel and Hirt,2004;Wang et al.,2018)。本研究中,除L2品系外,POD活性总体上呈先升高后下降的变化趋势,与孙波等(2016)报道的POD活性先升高后下降的变化趋势一致,活性下降可能是因为在低温胁迫7 d时,ROS大量累积,而POD不足以将其清除,导致POD活性下降。低温还诱导了脯氨酸的积累,增幅的大小与植株抗寒性呈正相关(丁灿等,2006)。
本研究采用极点排序法对甘蔗抗寒性进行全面评价,该分析方法目前已运用于披碱草(贾亚雄等,2008)、辣椒(刘雪梅等,2010)、高羊茅(张远兵等,2010)和甘蔗(唐仕云等,2012)等作物的抗逆性评价,具有综合性和可靠性。但本研究仅从生理生化角度鉴定各甘蔗品系抗寒性的强弱,今后还应结合大田表现对各品系进行综合评价。此外,低温胁迫后植株移至常温下的恢复能力也有待进一步检测。
4 结论
低温胁迫下4个转SoTUA基因甘蔗品系在生理生化指标上的表现均优于对照,即SoTUA基因在甘蔗体内的过量表达有利于甘蔗抗寒性能的提高。
参考文献:
丁灿,杨青辉,李富生,林位夫. 2006. 低温胁迫对割手密和斑茅游离脯氨酸含量的影响(Ⅱ)[J]. 安徽农业科学,34(5):846-849. [Ding C,Yang Q H,Li F S,Lin W F. 2006. Effect of cold stress on the content of free-proline in leaf of Saccharum spontaneum L. and Sclerostachya[J]. Journal of Anhui Agricultural Science,34(5):846-849.]
高俊凤. 2006. 植物生理学实验指导[M]. 北京:高等教育出版社. [Gao J F. 2006. Plant Physiology Experimental Gui-dance[M]. Beijing:Higher Education Press.]
郝再彬,苍晶. 2004. 植物生理实验[M]. 哈尔滨:哈尔滨工业大学出版社. [Hao Z B,Cang J. 2004. Plant Physiology Experiment[M]. Harbin:Harbin Institute of Technology Press.]
贾亚雄,李向林,袁庆华,万里强,孟芳. 2008. 披碱草属野生种质资源苗期耐盐性评价及相关生理机制研究[J]. 中国农业科学,41(10):2999-3007. [Jia Y X,Li X L,Yuan Q H,Wan L Q,Meng F. 2008. Evaluation of salt-tolerance and the related physiological characteristics of wild Elymus spp.[J]. Scientia Agricultura Sinica,41(10):2999-3007.]
李合生. 2000. 植物生理生化試验原理和技术[M]. 北京:高等教育出版社. [Li H S. 2000. Principles and Techniques of Plant Physiological and Biochemical Experiments[M]. Beijing:Higher Education Press.]
李杨瑞. 2010. 现代甘蔗学[M]. 北京:中国农业出版社. [Li Y R. 2010. Modern Sugarcane Science[M]. Beijing:China Agriculture Press.]
刘雪梅,尚庆茂,张志刚. 2010. 辣椒不同品种种子萌芽期耐低温性及评价方法研究[J]. 中国生态农业学报,18(3):521-527. [Liu X M,Shang Q M,Zhang Z G. 2010. Low-temperature tolerance of pepper at germination stage and its evaluation method[J]. Chinese Journal of Eco-Agriculture,18(3):521-527.]
罗明珠,刘子凡,梁计南,魏延明. 2005. 甘蔗抗旱性与叶片某些生理、生化性状的关系[J]. 亚热带农业研究,1(1):14-16. [Luo M Z,Liu Z F,Liang J N,Wei Y M. 2005. The relationship between drought resistance of sugarcane and some physiological biochemical properties of leaves[J]. Subtropical Agricultural Research,1(1):14-16.]
欧钊荣,谭宗琨,何艳,匡昭敏,陈汇林,莫小华,黄中艳. 2008. 影响我国甘蔗主产区甘蔗产量的关键气象因子及其丰欠指标[J]. 安徽农业科学,36(24):10407-10410. [Ou Z R,Tan Z K,He Y,Kuang Z M,Chen H L,Mo X H,Huang Z Y. 2008. The key meteorological factors affecting the sugarcane yield in major production areas in China and their high-low yield indices[J]. Journal of Anhui Agricultural Science,36(24):10407-10410.]
邵敏. 2015. 甘蔗宿根矮化病病原菌膜蛋白Lxx18460基因的特性研究[D]. 南寧:广西大学. [Shao M. 2015. Study on the characteristics of membrane protein Lxx18460 gene of sugarcane root dwarfing disease pathogens[D]. Nanning:Guangxi University.]
孙波. 2016. 低温胁迫对甘蔗幼苗根系生长代谢的影响和相关基因α-tubulin的功能研究[D]. 南宁:广西大学. [Sun B. 2016. Effect of low temperature stress on root growth and metabolism in sugarcane seedlings and the function analysis of α-tubulin gene[D]. Nanning:Guangxi University.]
孙波,刘光玲,杨丽涛,李杨瑞. 2016. 甘蔗幼苗根系形态结构及保护系统对低温胁迫的响应[J]. 中国农业大学学报,19(6):71-81. [Sun B,Liu G L,Yang L T,Li Y R. 2016. Response of chilling stress on root morphology and protection systems of sugarcane seedlings[J]. Journal of China Agricultural University,19(6):71-81.]
汤章城. 1999. 现代植物生理学实验指南[M]. 北京:科学出版社. [Tang Z C. 1999. Guidelines for Modern Plant Phy-siology Experiments[M]. Beijing:Science Press.]
唐仕云,杨丽涛,李杨瑞. 2012. 不同甘蔗基因型对低温胁迫的响应及其耐寒性评价[J]. 热带作物学报,33(4):635-641. [Tang S Y,Yang L T,Li Y R. 2012. Response of different sugarcane genotypes to low temperature and evaluation for cold tolerance of sugarcane[J]. Chinese Journal of Tropical Crops,33(4):635-641.]
吴佳溶,陈志厚,徐茜,徐辰生. 2018. 南平烟区抗寒优质烤烟新品种选育研究[J]. 江西农业学报,30(6):63-66. [Wu J R,Chen Z H,Xu Q,Xu C S. 2018. Research on breeding of cold-resistance and high-quality flue-cured tobacco new varieties in Nanpin garea[J]. Acta Agriculturae Jiangxi, 30(6):63-66.]
严寒静,谈锋. 2005. 桅子叶片生理特性与抗寒性的关系[J]. 植物资源与环境学报,14(4):21-24. [Yan H J,Tan F. 2005. Relationship between physiological characteristics of gardenia leaf and cold resistance[J]. Journal of Plant Resources and Environment,14(4):21-24.]
杨德光,孙玉珺,Ali Raza Irfan,刘昕萌,吕金莹,尉菊萍,宫磊,刘哲,白冰. 2018. 低温胁迫对玉米发芽及幼苗生理特性的影响[J]. 东北农业大学学报,49(5):1-8. [Yang D G,Sun Y J,Irfan A R,Liu X M,Lü J Y,Wei J P,Gong L,Liu Z,Bai B. 2018. Effect of low temperature stress on germination and physiological of maize seedling[J]. Journal of Northeast Agricultural University,49(5):1-8.]
张保青. 2013. 低温胁迫下甘蔗后期生理特性及差异蛋白质组学研究[D]. 南宁:广西大学. [Zhang B Q. 2013. Physio-logical characteristics and differential proteomics of su-garcane under low temperature stress[D]. Nanning:Guang-xi University.]
张远兵,刘爱荣,王兵,李根. 2010. 铜胁迫下7个高羊茅品种耐性和铜积累能力的比较[J]. 热带作物学报,31(5):750-757. [Zhang Y B,Liu A R,Wang B,Li G. 2010. The comparison of copper tolerance and copper accumulation activity of seven festuca arundinacea varieties under copper stress[J]. Chinese Journal of Tropical Crops,31(5):750-757.]
張云. 2015. 华南忍冬ARF1、TUA3以及AP4-μ基因克隆与功能验证[D]. 武汉:华中科技大学. [Zhang Y. 2015. Clo-ning and functional verification of ARF1,TUA3 and AP4-μ genes from Lonicerajaponicain south China[D]. Wuhan:Huazhong University of Science and Technology.]
邹凯茜,商桑,田丽波,朱国鹏,周萌萌,潘琼玉,曾丽萍. 2018. 低温胁迫对嫁接苦瓜幼苗渗透调节物质的影响[J]. 热带作物学报,39(8):1533-1539. [Zou K X,Shang S,Tian L B,Zhu G P,Zhou M M,Pan Q Y,Zeng L P. 2018. Effects of low temperature stress on osmotic so-lutes of grafted bitter gourd seedlings[J]. Chinese Journal of Tropical Crops,39(8):1533-1539.]
Abdrakhamanova A,Wang Q Y,Khokhlova L,Nick P. 2003. Is microtubule disassembly a trigger for cold acclimation?[J]. Plant and Cell Physiology,44(7):676-686.
Apel K,Hirt H. 2004. Reactive oxygen species:Metabolism,oxidative stress,and signal transduction[J]. Annual Review of Plant Biology,55:373-399.
Gilroy S,Trewavas A. 2001. Signal processing and transduction in plant cells:The end of the beginning?[J]. Nature Reviews Molecular Cell Biology,2(4):307-314.
Kaplan F,Sung D Y,Guy C L. 2010. Roles of β-amylase and starch breakdown during temperature stress[J]. Physiologia Plantarum,126(1):120-128.
Kazemi-Shahandashti S S,Maali-Amiri R,Zeinali H,Ramezanpour S S. 2013. Change in membrane fatty acid compositions and cold-induced responses in chickpea[J]. Molecu-lar Biology Reports,40:893-903.
Kerr G P,Carter J V. 1990. Relationship between freezing to-lerance of root-tip cells and cold stability of microtubules in rye(Secale cereal L. cv Puma)[J]. Plant Physiology,93(1):77-82.
Liu H M,Wen Y H,Wang S K,You Y. 2003. A review of plant cold resistance[J]. Northern Horticulture,6:14-5.
Peng X N,Yi Z L,Jiang J X. 2007. Progress in the study of cold resistance in plant[J]. Biotechnology Bulletin,4:15-8.
Perea-Resa C,Rodríguez-Milla M A,Iniesto E,Rubio V,Salinas J. 2017. Prefoldins negatively regulate cold acclimation in Arabidopsis thaliana by promoting nuclear proteasome-mediated HY5 degradation[J]. Molecular Plant,10(6):791-804.
Pihakaski-Maunsbach K,Puhakainen T. 1995. Effect of cold exposure on cortical microtubules of rye(Secalecereale)as observed by immunocytochemistry[J]. Physiologia Plantarum,93(3):563-571.
Farajalla M R,Gulick P J. 2007. The alpha-tubulin gene family in wheat(Triticum aestivum L.) and differential gene expression during cold acclimation[J]. Genome,50(5):502-510.
Sanghera G S,Wani S H,Hussain W,Singh N B. 2011. Engineering cold stress tolerance in crop plants[J]. Current Genomics,12(1):30-43.
Selvarajan D,Mohan C,Dhandapani V,Nerkar G,Jayanara-yanan A N,Mohanan M V,Murugan N,Kaur L,Chennappa M,Kumar R,Meena M,Ram B,Chinnaswamy A. 2018. Differential gene expression profiling through transcriptome approach of Saccharum spontaneum L. under low temperature stress reveals genes potentially involved in cold acclimation[J]. 3 Biotech,8:195.
Kazemi-Shahandashti S S,Maali-Amiri R. 2018. Global insights of protein responses to cold stress in plants:Signa-ling,defence,and degradation[J]. Journal of Plant Physio-logy,226:123-135.
Wang K,Bai Z Y,Liang Q Y,Liu Q L,Zhang L,Pan Y Z,Liu G L,Jiang B B,Zhang F,Jia Y. 2018. Transcriptome analysis of chrysanthemum(Dendranthema grandiflorum)in response to low temperature stress[J]. BMC Genomics,19(1):1-20.
Wang L X,Nick P. 2017. Cold sensing in grapevine-which signals are upstream of the microtubular “thermometer” [J]. Plant,Cell and Environment,40(11):2844-2857.
Wasteneys G O,Galway M E. 2003. Remodeling the cytoske-leton for growth and form:An overview with some new views[J]. Annual Review of Plant Biology,54:691-722.
(責任编辑 王 晖)

