基于DNA模板合成的银簇建立“点亮型”荧光法检测卡那霉素
林碧霞,蒙佩怡,陈梦玲,吴峻宇,冷江东,黄月梅,杨诗意,俞 英
(华南师范大学 广州市生物医药分析化学重点实验室,广东 广州 510006)
卡那霉素是一种氨基糖苷类抗生素,被应用于畜牧业中抗菌杀菌[1]。残留在农畜产品的卡那霉素有可能通过食物链进入人体,从而对人体健康造成危害[2]。因此,建立卡那霉素的灵敏检测方法具有重要意义。目前,卡那霉素的检测方法包括色谱法[3]、酶联免疫分析法[4]、电化学法[5]、拉曼光谱法[6]等。但上述方法大多存在操作繁琐、检测时间长等缺点。荧光分析法因为具有优良的选择性和灵敏度,且操作简单,被广泛应用于各种目标物的分析检测[7-9]。

图1 银纳米簇检测卡那霉素的原理图Fig.1 Detection principle of kanamycin by silver nanoclusters
银纳米簇(AgNCs)作为一种新型荧光纳米材料吸引了广泛关注[10-11],尤其是以DNA为模板合成的银纳米簇,可以同时具备发光功能和识别功能,避免了以往荧光探针制备中复杂的荧光分子标记过程和识别分子修饰过程[12-13]。目前以DNA为模板合成银簇主要用于检测目标DNA[14-15]和大分子[16],较少用于小分子的检测,如Yang[17]等以miRNA的互补DNA为模板合成银纳米簇,并用于miRNA的检测;Cao[18]等以银纳米簇为荧光探针,建立了对人类免疫缺陷病毒(HIV)基因、乙型肝炎病毒(HBV)基因和人类T淋巴细胞病毒Ⅰ型(HTLV-Ⅰ)基因的检测。
本文基于DNA模板合成的银纳米簇建立了检测卡那霉素的荧光方法,检测原理如图1所示:以DNA模板合成的银簇荧光很弱,当加入目标物卡那霉素时,由于DNA模板上的适配体序列识别卡那霉素,适配体形成了发夹结构,并使其G、C碱基靠近银簇序列,同时DNA二级结构的改变使大颗粒的银纳米粒子分散为小颗粒的银簇,导致银簇荧光增强,根据该原理建立了“点亮型”荧光法检测卡那霉素。
1 实验部分
1.1 试剂与仪器
卡那霉素(纯度94%)、链霉素(99%)、四环素(96%)、金霉素(99%)、多西环素(99%)、土霉素(95%)、环丙沙星(99%),均购于上海阿拉丁试剂公司;硝酸银、硼氢化钠、柠檬酸、柠檬酸钠(分析纯,天津致远化学试剂公司);各种序列的DNA由上海生工合成,并经高效液相色谱纯化,其具体序列见表1,其中合成银簇的DNA有5种不同序列(下划线碱基序列),分别命名为AgDNA1、AgDNA2、AgDNA3、AgDNA4、AgDNA5,无下划线碱基序列为卡那霉素的适配体序列,命名为kan1;实验所用水均为超纯水;牛奶和蜂蜜样品购自当地市场。
荧光光谱用日本日立F-4600型荧光光谱仪测定,激发和发射狭缝宽度均为10 nm,激发电压为700 V,扫描速度为300 nm/min。紫外光谱(UV-Vis)用日本岛津2700型紫外-可见分光光度计测定。透射电镜谱图(TEM)用日本电子JEM-2100HR 透射电子显微镜测定。

表1 本实验使用的DNA序列Table 1 DNA sequences used in the experiment
1.2 银纳米簇的合成
银纳米簇的合成参考文献[12]改进:用20 mmol/L柠檬酸缓冲溶液(pH 7.5)配制15 μmol/L的DNA溶液。将DNA溶液在95 ℃水浴中加热5 min,再迅速放至冰水浴中保持1 h。取新制的90 μmol/L 硝酸银溶液逐滴滴至上述配制的DNA溶液中,涡旋振荡2 min后,于冰水浴中保持15 min。随后,迅速加入90 μmol/L新鲜配制的硼氢化钠溶液,涡旋振荡4 min。此时,反应体系中DNA、硝酸银和硼氢化钠的浓度比为1∶6∶6。将混合溶液放置在4 ℃下避光反应12 h,得到5 μmol/L的银纳米簇(以加入DNA的浓度计算)。
1.3 卡那霉素检测方法的建立
在一系列比色管中依次加入30 μL 5 μmol/L的银纳米簇溶液、40 μL 20 mmol/L的柠檬酸缓冲液(pH 7.5)和30 μL不同浓度的卡那霉素标准溶液。涡旋混合均匀后于16 ℃摇床中反应80 min。测定各反应溶液的荧光强度,并以卡那霉素的浓度为横坐标,荧光增强倍数(F/F0,F0、F分别为银簇加入卡那霉素前后的荧光强度)为纵坐标,绘制银簇测定卡那霉素的工作曲线。
1.4 实际样品的检测
取1 mL牛奶或蜂蜜,加入4 mL冰浴冷冻后的甲醇溶液,涡旋混合30 s后,置于冰水浴中静置15 min,然后以10 000 r/min的转速离心15 min。收集上清液并用0.22 μm 滤膜过滤,蒸干,重溶残渣并用0.22 μm 滤膜再次过滤,最后稀释定容至10 mL。
取30 μL上述牛奶或蜂蜜样品代替卡那霉素标准溶液,按“1.3”实验方法处理并进行荧光强度测定,根据建立的工作曲线计算得到待测样品溶液中卡那霉素的浓度。为了评价方法的准确度,两种样品溶液分别加2.5、5.0、7.5 μmol/L卡那霉素标准溶液,测定加标样品溶液中卡那霉素的浓度,计算回收率与相对标准偏差(RSD)。
2 结果与讨论
2.1 DNA模板的优化
DNA模板包括两部分的碱基序列,一部分用于合成银纳米簇,命名为AgDNA序列,另一部分用于识别目标物卡那霉素,命名为kan1序列。对AgDNA序列进行优化,并探讨其位置变化对荧光的影响。
2.1.1 合成银簇的优化由于AgDNA序列不同时,合成银簇的荧光性能会不同,造成对目标物检测灵敏度也不同,因此很有必要对合成银簇序列进行优化。目前文献报道的常用于合成银簇的序列包括CCC TTT AAC CCC、CCT CCT TCC TCC、CCC TAA CTC CCC、CCC TTA ATC CCC、ACC CAC CCA,分别命名为AgDNA1、AgDNA2、AgDNA3、AgDNA4、AgDNA5序列。保持DNA模板中卡那霉素适配体序列相同,均为kan1序列,且在DNA模板的3′端,改变合成银簇的序列分别为上述5种序列,得到AgDNA1-kan1,AgDNA2-kan1,AgDNA3-kan1,AgDNA4-kan1,AgDNA5-kan1 5种不同的DNA模板(具体序列见表1)。用该5种模板按相同合成方法分别合成银簇,然后加入卡那霉素,测定5种DNA模板合成的银簇加入卡那霉素前后的荧光变化情况。如图2所示,合成银簇的激发峰和发射峰位置和强度均会随银簇序列的改变而改变。此外,5种DNA模板合成的银簇加入卡那霉素后荧光均能发生不同程度的增强,荧光增强倍数从大到小依次是AgDNA4-kan1> AgDNA2-kan1>AgDNA1-kan1 >AgDNA5-kan1 >AgDNA3-kan1。由于用AgDNA4-kan1作为模板合成的银簇加入卡那霉素时荧光增强最明显,灵敏度最高,因此实验选取AgDNA4序列为最佳合成银簇序列。



图3 DNA模板中合成银簇序列位置的优化Fig.3 Optimization of sequences position for silver nanoclusters in DNA templates
2.1.2 合成银簇序列位置的优化为了探究DNA模板中合成银簇序列的位置是否会影响合成银簇检测目标物的灵敏度,设计3种银簇序列位置不同的DNA模板:AgDNA4-kan1,kan1-AgDNA4,AgDNA4-kan1-AgDNA4(具体序列见表1)。该3种DNA模板中,卡那霉素适配体序列部分相同,均为kan1序列,合成银簇序列均为AgDNA4序列,其分别在DNA模板的5′端、3′端以及同时存在于5′端和3′端。用该3种模板按相同方法分别合成银簇,然后加入卡那霉素,测定3种DNA模板合成的银簇加入卡那霉素前后的荧光变化情况。如图3所示,当合成银簇序列在DNA模板的5′端时,合成银簇加入卡那霉素后荧光增强最为明显,因此,选取DNA模板中合成银簇序列在5′端为最优。
2.2 银簇合成条件的优化
对合成银纳米簇时缓冲溶液的pH值、反应物浓度、反应温度和反应时间进行考察,以增加加入目标物卡那霉素后荧光的增强程度,提高检测灵敏度。结果显示,当pH值在7.5~8.5时,荧光增强程度最大,实验选取pH 7.5为最佳pH值(图4A)。当DNA、硝酸银和硼氢化钠三者的浓度比为1∶6∶6时(图4B),合成温度为4 ℃,合成时间为12 h时,荧光增强程度达到最大。因此实验选取银簇合成的最佳条件为pH 7.5,DNA、硝酸银、硼氢化钠三者浓度比为1∶6∶6,在4 ℃反应12 h。

2.3 银簇的表征
通过紫外吸收光谱、荧光光谱、透射电镜等方法,考察了合成银簇的光学性能和形貌特征。图5A紫外吸收光谱图中,DNA在260 nm处有明显吸收,合成后的银簇保持了DNA在260 nm处的吸收,但在420 nm多了银纳米粒子(AgNPs)的表面等离子体共振峰。400~650 nm的放大图则显示,在555 nm处增加了银纳米簇的吸收峰。图5B荧光光谱图中,合成前的DNA无特征激发和发射峰,合成后银簇在565 nm处有明显的激发峰,这与合成银簇在555 nm有紫外吸收相符。在该波长激发下,可观察到624 nm处呈现发射峰。为了表征合成银簇的形貌和粒径情况,对其进行了透射电镜分析(图5C),结果显示,合成银簇的分散性良好、大小均一。用高分辨透射电子显微镜对其进行表征,可看到银簇尺寸约为5 nm,并呈现明显的晶格条纹。为了探讨银簇的稳定性能,对银簇的抗光漂白性能进行考察,结果显示,银簇在565 nm激发波长的持续照射下,1 h后荧光强度仍保持90%以上,表明合成的银簇稳定性较好。
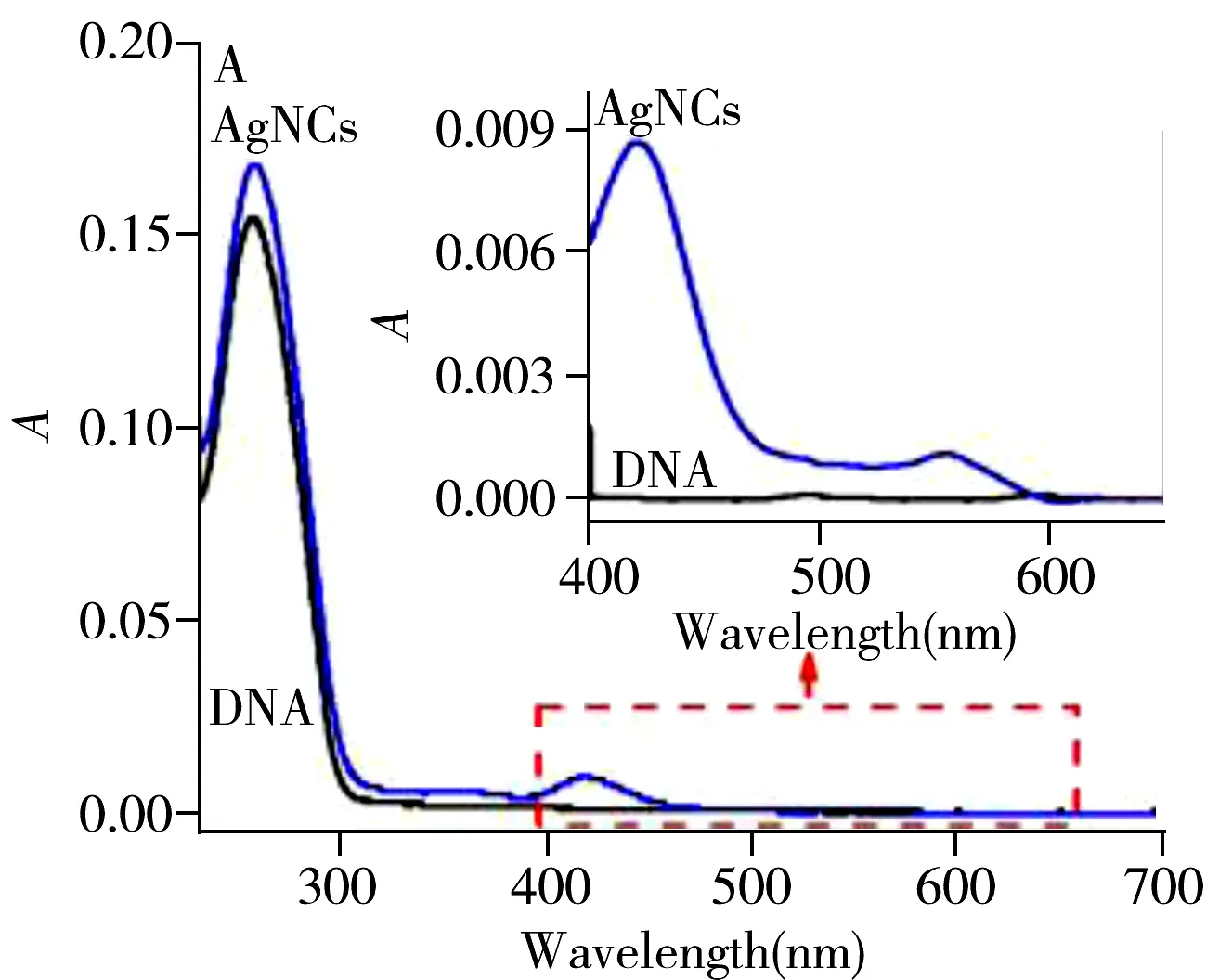


图5 银纳米簇的表征Fig.5 Characterization of silver nanoclustersA.UV absorption spectra;B.fluorescence spectra;C.TEM image;insert:HRTEM image of silver nanoclusters
2.4 银簇检测卡那霉素的机理
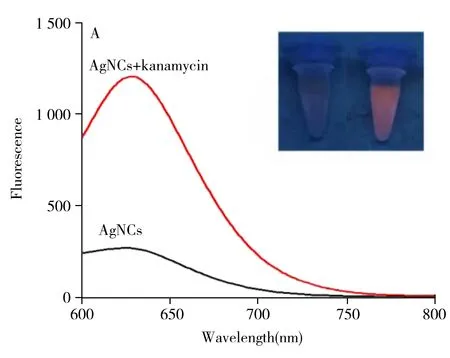
对银簇加入卡那霉素前后的荧光及紫外吸收光谱图进行扫描(图6),以考察银簇检测卡那霉素的机理。结果显示,银簇中加入卡那霉素时,银簇在565 nm的荧光峰位置未改变,但荧光强度明显增强(图6A)。在365 nm的紫外灯下观察加入卡那霉素前后的荧光颜色变化(图6插图),可以清晰看到加入卡那霉素前几乎无荧光,而加入卡那霉素后溶液呈现明显的橙色荧光。这与加入卡那霉素前银簇的荧光很弱,而加入卡那霉素后荧光增强的荧光光谱相符合。同时,由于合成的银簇荧光很弱,有利于降低背景干扰,提高检测灵敏度。
图6B显示,加入卡那霉素前,银簇在420 nm和555 nm有吸收峰,分别对应银纳米粒子和银簇的吸收。随着卡那霉素加入浓度的增加,420 nm处吸收峰的强度逐渐下降并向银簇的吸收波长移动,同时555 nm处吸收峰的强度逐渐增强,这与加入卡那霉素后荧光增强一致。由于卡那霉素适配体序列的3′端有部分G碱基和C碱基(见表1),有文献报道G碱基和C碱基可以增强银簇的荧光[19-21],因此可推断加入卡那霉素后,DNA模板上的适配体序列识别卡那霉素,构型由原来的松散状态转为发夹型,使适配体上更多G碱基和C碱基靠近银簇,从而导致银簇的荧光增强[12,22]。同时由于卡那霉素引起DNA的二级结构变化可能使银纳米粒子分散,形成小粒径的银簇[23],导致银纳米粒子的数量减少,其在420 nm处的吸收下降,同时银簇增多,其紫外吸收和荧光强度均增强。综上,卡那霉素对银簇的荧光增强可以归为两个原因:一是更多G碱基和C碱基靠近银簇,提高银簇荧光;二是银纳米粒子分散成小粒径的银簇,导致银簇数量增多。
2.5 银簇检测卡那霉素的条件优化与工作曲线
由于卡那霉素可以增强银簇的荧光,因此可将银簇作为荧光探针建立“点亮型”荧光法检测卡那霉素的含量。首先对检测过程中银簇与卡那霉素的反应温度与时间进行优化。图7A和B显示最佳反应温度和时间分别为16 ℃和80 min。在优化最佳反应温度和反应时间下,考察银簇检测不同浓度(0、0.075、0.1、0.5、1.0、2.0、3.0、4.0、5.0、7.0、8.0、9.0 μmol/L)卡那霉素的响应信号。图7C显示,随着卡那霉素加入浓度的增加,银簇的荧光逐渐增强,且在0.075~8.0 μmol/L浓度范围内,银簇荧光增强比值(F/F0)与卡那霉素的浓度(C,μmol/L)呈线性关系,其线性方程为F/F0=0.616 8C+ 0.927 6,相关系数为0.995 8,检出限(LOQ,S/N=3)为36 nmol/L。卡那霉素在一些食品如牛奶、蜂蜜样品的限量标准为150 μg/L[24],换算约为258 nmol/L,而本方法的检出限明显小于卡那霉素在这些样品中的限量标准,说明本方法能满足限量标准的需求。



图7 银簇检测卡那霉素Fig.7 Detection of kanamycin by silver nanoclustersA.optimization of temperature;B.optimization of time;C.fluorescence spectra of silver nanoclusters with kanamycin at various concentrations
2.6 银簇检测卡那霉素的稳定性与选择性

图8 银簇检测卡那霉素方法的选择性Fig.8 Selectivity of the detection method for kanamycin by silver nanoclusterconcentration of antibiotics:8 μmol/L
为了探究银簇检测卡那霉素方法的稳定性,选取加入卡那霉素的浓度分别为0.75、5.0、7.0 μmol/L,对日内、日间相对标准偏差(RSD)进行分析。每个浓度测定5 d,每天测定3次,计算得到的日内RSD小于6.0%,日间RSD小于6.9%,说明该方法检测卡那霉素具有较好的稳定性。
为了考察银簇检测卡那霉素的选择性,分别选取金霉素、四环素、多西环素、土霉素、环丙沙星、链霉素6种常见抗生素,按检测卡那霉素的方法加入银簇中,并测定加入前后银簇荧光强度的比值,结果显示,当加入8 μmol/L各种抗生素时,卡那霉素的加入使荧光明显增加约6.3倍,链霉素增加约2倍,而其他抗生素对银簇荧光强度的影响很小。链霉素能增加荧光强度是因为链霉素与卡那霉素均为氨基糖苷类抗生素,分子结构非常接近,对卡那霉素适配体的识别会有干扰。但与卡那霉素对银簇荧光的增强程度相比,链霉素的荧光增强小很多。该方法对卡那霉素具有很好的选择性。
2.7 实际样品的检测
选取牛奶和蜂蜜作为实际样品,对实际样品进行加标处理并检测卡那霉素的含量,以评价该“点亮型”荧光方法在实际样品测定中的效果。结果如表2所示,牛奶和蜂蜜样品均未检出,分别进行0.2、2.5、5.0、7.5 μmol·L-1浓度水平的加标,测得回收率为92.4%~112%,相对标准偏差(RSD)为3.6%~8.0%。结果表明该方法具有良好的检测准确度和精密度,适用于实际样品中卡那霉素的检测。
2.8 与其他检测方法的比较
将本方法与近年报道的卡那霉素荧光检测方法进行比较(见表3)。从表中可看出,有机荧光分子、半导体无机量子点、碳族量子点均可作为发光元件来建立卡那霉素的荧光分析方法。本方法的灵敏度比用噻唑橙、荧光素二聚体、铂复合物、碳点作为发光元件所建立的荧光方法的灵敏度好。此外,本方法虽比用罗丹明B、荧光素、CdTe作为发光元件所建立的方法的检出限高,但本方法的线性范围更宽,且毒性更低。

表2 实际样品中卡那霉素的测定(n=3)Table 2 Determination of kanamycin in actual samples (n=3)
*no detected

表3 卡那霉素荧光检测方法的比较Table 3 Comparison of fluorescent methods for kanamycin

图9 可视化半定量检测卡那霉素Fig.9 Visual semi-quantitative determination of kanamycinconcentrations of kanamycin( from left to right):0,1.5,3.0,6.0,9.0,12,15,18,21 μmol/L
2.9 可视化半定量检测卡那霉素
对银簇中加入卡那霉素后体系的荧光颜色进行探讨。从图9中可看出,在紫外灯下,随着卡那霉素浓度的增加,检测体系的颜色由几乎无荧光逐渐变为橙色荧光,且颜色不断加深。因此可以根据检测体系在紫外灯下的荧光深浅对卡那霉素进行可视化半定量检测。该方法无需专业仪器,只需便携式的紫外灯即可完成,从而为卡那霉素的现场检测提供了有效方法。
3 结 论
本文对DNA模板中银簇序列和位置进行设计,并优化了合成银簇的pH值、温度、时间等条件。当加入卡那霉素时,DNA模板上的适配体序列识别卡那霉素形成发夹结构,使更多的G、C碱基靠近银簇序列,同时由于卡那霉素引起DNA二级结构的变化使银纳米粒子粒径变小,导致银簇荧光增强。增强的荧光比值与卡那霉素浓度呈良好的线性关系,据此建立“点亮型”荧光方法检测卡那霉素。对牛奶和蜂蜜样品进行检测,检测效果良好。此外,随着卡那霉素加入浓度的增加,银簇的橙色荧光不断加深,据此可对卡那霉素进行可视化半定量检测,从而为卡那霉素的现场检测提供了新方法。

