紧穗野生稻组培苗的快繁与利用研究
王玲仙 王波 钟巧芳 殷富有 柯学 付坚 雷涌涛 陈玲 邢佳鑫 程在全


摘要:获得优质愈伤组织和高分化率的组培苗是离体保存和遗传转化的基础。本试验以紧穗野生稻的根为外植体,以MS和N6为基本培养基,通过添加不同浓度激素,组配不同的愈伤诱导和分化培养基,以建立适合紧穗野生稻的快繁体系。结果表明,以MS为基本培养基,2,4-D添加量少,稻根的出愈率不高,但添加量过高又抑制出愈率,以MS+11 mg/L 2,4-D的出愈率最高,MS+5 mg/L 2,4-D的愈伤增殖较好;以N6为基本培养基的愈伤诱导效果不如MS培养基。愈伤在MS+5 mg/L 6-BA+ 0.4 mg/L NAA培养基中分化率最高,丛生芽多;6-BA+IAA组合的分化效果远不如6-BA+NAA好。以MS+2 mg/L 6-BA+ 0.2 mg/L NAA+3 mg/L TDZ作为壮苗培养基效果较理想,苗粗壮、油绿。生根培养以MS+NAA组合根露白早、主根多,MS+IAA组合远不如MS+NAA组合生根效果好;最佳生根培养基为MS+0.5 mg/L NAA。利用紧穗野生稻组培苗与栽培稻配组进行远缘杂交,获得F1代杂交种子,并调查了其农艺性状表现,表明紧穗野生稻与栽培稻间具有较强的杂交优势。
关键词:紧穗野生稻;稻根快繁苗;远缘杂交
中图分类号:S511.903.53 文献标识号:A 文章编号:1001-4942(2019)08-0010-06
Abstract Obtaining high-quality callus and high-differentiation-rate tissue culture seedlings are the base of in vitro preservation and genetic transformation. In the experiment, roots of Oryza eichingeri were used as explants. By adding different concentrations of hormones in MS and N6 medium, different callus induction and differentiation media were prepared to establish the fast propagation system suitable for Oryza eichingeri. The results showed that adding a small amount of 2,4-D in MS medium led to low callus rate of rice root, but high addition amount inhibited callus rate. When the addition amount of 2,4-D was 11 mg/L , the callus rate was the highest, and the callus proliferation was better when adding 5 mg/L 2,4-D. The callus induction effect of N6 medium was not as good as that of MS. The differentiation rate of callus in MS medium with 5 mg/L 6-BA and 0.4 mg/L NAA was the highest, which had more multiple shoots. The differentiation effect of 6-BA and IAA combination was far less than 6-BA and NAA combination. MS medium with 2 mg/L 6-BA, 0.2 mg/L NAA and 3 mg/L TDZ was the better seedling culture medium with ideal effect of thick stems and green leaves. MS and NAA combination as rooting culture medium showed white early and more taproot, so the rooting effect was far better than that of MS and IAA combination. Therefore, the best rooting medium was MS with 0.5 mg/L NAA. Distant hybridization experiment was conducted by the combination of tissue culture seedlings of Oryza eichingeri and cultivated rice in field. Then the F1 hybrid seeds were obtained and their agronomic characters were investigated, showing strong hybridization advantage.
Keywords Oryza eichingeri; Rapid propagation seedlings from rice roots; Distant hybridization
野生稻是水稻育種中获得有利外源基因的一个重要来源。国内外育种实践证明,含有AA染色体组的野生稻在水稻育种中发挥了巨大作用,其野败不育系的发现,实现了杂交稻的育成[1]。而要获得水稻育种的新突破,利用野生稻作亲本势在必行[2]。
紧穗野生稻(Oryza eichingeri)与栽培稻亲缘关系较远,且具有许多优良特性,如抗虫、抗病、抗旱、植株高大、功能叶片耐衰老、生长优势良好等。但其结实率低,种子落粒性强,收获的种子品质较差、严重畸形且萌发率低,靠自身繁殖很难。目前主要通过茎秆扦插和分根移栽进行繁殖,但繁殖率低、繁殖时间长,严重妨碍了实验进程的推进和资源的保存。因此,建立紧穗野生稻的快繁体系,实现其快速繁殖,是其应用于水稻育种要解决的首要问题。
本研究即在传统繁殖方法基础上,利用细胞全能性,采用活力强的紧穗野生稻根作为外植体,设置不同基本培养基与不同种类、不同浓度植物激素配比,成功诱导出愈伤组织并进行分化、生根得到组培苗;利用组培苗与栽培稻进行杂交,成功获得F1种子且植株农艺性状良好,表现出较强的杂交优势。该组培苗可用于资源保存和杂交育种实践中。
1 材料与方法
1.1 试验材料
紧穗野生稻种质材料来源于斯里兰卡。杂交试验以紧穗野生稻为父本,选用栽培稻楚粳1号、楚粳2号、云资粳41号、云资粳43号、云资籼42号、云资籼44号为母本。
1.2 试验方法
1.2.1 稻根采集 每年3—4月份从田间采集紧穗野生稻的根系,剔掉腐烂老根,留下刚发出的幼嫩新根,洗掉淤泥,用湿纸巾包好,装入自封袋中备用。
1.2.2 稻根的无菌处理 将湿纸巾包裹的幼嫩稻根用洗洁精清洗一遍,自来水冲洗15 min,用蒸馏水冲洗干净后,用75%的乙醇表面灭菌1 min,加入0.1%的氯化汞和20%的吐温灭菌处理20 min,再用0.1%的氯化汞灭菌15 min,无菌水清洗5~6遍后取出,吸干多余水分,待用。
1.2.3 愈伤诱导和愈伤增殖培养 取灭菌处理后的稻根,切成长度为0.8~1.0 cm的小段,分别置于添加不同浓度(0、1、3、5、7、9、11、13、15 mg/L,见表1)2,4-D的MS和N6培养基上诱导愈伤组织。置于人工气候箱28℃暗培养,培养83 d,长出透明白点愈伤,愈伤长至0.5 cm时,挑选质量好的愈伤组织进行增殖培养,增殖培养基为MS +5 mg/L 2,4-D,每30 d换一次,增殖愈伤逐渐出现淡绿、白色和深绿。培养基中均加入琼脂粉9 g/L、蔗糖30 g/L,pH值为5.8,下同。
1.2.4 分化培养和壮苗培养 增殖培养愈伤长至1.1~1.3 cm时,挑选优质愈伤接入 MS+0~10 mg/L 6-BA+0.4 mg/L NAA和N6+0~10 mg/L 6-BA+0.5 mg/L IAA分化培养基(pH= 6.0)中进行分化培养,培养30 d后,长出小苗。将小苗接入 MS+2 mg/L 6-BA+0.2 mg/L NAA+3 mg/L TDZ的壮苗培养基(pH=6.0)上进行壮苗培养。培养条件为28℃,光照强度2 000~4 000 lx,光照时间12 h/d。
1.2.5 生根培养 将培养至4.5~5.0 cm高的健壮苗接入装有MS+0.1~1.0 mg/L NAA和MS+ 0.1~1.0 mg/L IAA培养基(见表3)的试管中进行生根培养,每根试管接入6~8株,培养20~30 d待主根长至6~7 cm,苗长至11~13 cm,且长出次生须根时,进行炼苗培养,其它培养条件不变,光照强度2 000 lx。
1.2.6 炼苗与栽种 将11~13 cm的组培苗从试管中取出,用自来水将苗根部的培养基冲洗干净,放入新的试管中,加水淹没根部,管口敞开,置于28℃、2 000 lx的光照培养箱中进行炼苗。3 d后,将苗从光照培养箱中取出,移入含有1∶ 1珍珠岩和蛭石的营养基质中,置于温室常规培养25 d,至叶片展开、新根长出,移栽到大田中,苗返青后需注意水、肥、病害的防治和管理,后期追施尿素一次,直至种子成熟。
1.3 田间杂交试验
将得到的紧穗野生稻根快繁组培苗分两组种植,一组收种保存,另一组进行杂交试验。采用有性杂交方法:以栽培稻为母本,于每日上午用父本紧穗野生稻对处于盛花期的花朵进行授粉,连续授粉2 d,授粉后的稻穗套袋。
收获F1杂交种后再继续种植,进行植株农艺性状观察,并进行连续回交、自交试验。
2 结果与分析
2.1 不同愈伤诱导培养基对紧穗野生稻根愈伤诱导的影响
由图1可见,在未添加2,4-D的MS和N6培养基上无愈伤产生;随2,4-D添加浓度的升高,两种培养基上的出愈率均先升高后下降,且MS培养基的出愈率明显高于N6培养基。MS培养基以添加11 mg/L 2,4-D的出愈率最高,达到100%;其次为添加13 mg/L 2,4-D,出愈率仍达到91.3%。N6培养基则以添加9 mg/L 2,4-D的出愈率最高,为63.5%;其次为添加7 mg/L 2,4-D的处理;当2,4-D添加浓度达到11 mg/L及以上,紧密野生稻根的出愈率明显下降。
综合来看,MS培养基比N6培养基更适合紧穗野生稻根愈伤组织的诱导。其中MS+11 mg/L 2,4-D可诱导稻根全部出愈,且愈伤颗粒紧实,深绿,愈伤最好(图2、表1)。以N6为基本培养基的出愈率普遍偏低,且愈伤有粘性,水分多,透明,不适合用于紧穗野生稻根的愈伤诱导培养。
2.2 不同激素浓度对紧穗野生稻再生苗分化的影响
以MS为基本培养基,以野生稻组织培养中NAA和IAA常用浓度(0.4 mg/L NAA、0.5 mg/L IAA)为基础[3,4], 设置10个含不同浓度6-BA的分化培养基,筛选最适合紧穗野生稻再生苗分化的培养基。结果(表2)表明,在添加0.4 mg/L NAA的MS培养基中,随着6-BA浓度的升高,分化率为7.0%~91.2%,其中当6-BA浓度为5 mg/L 时最高,为91.2%;在添加0.5 mg/L IAA的培養基中,6-BA浓度升高到6 mg/L 时,分化率达到最高为75.0%,之后呈下降趋势。在MS+5 mg/L 6-BA+0.4 mg/L NAA培养基上,丛生苗多,再生苗呈油绿色,茎秆粗壮(图3)。可见,在紧穗野生稻再生苗分化过程中,6-BA起着关键作用。与IAA相比,NAA与6-BA组合更适合紧穗野生稻再生苗的分化,并且最佳培养基配方为MS+5 mg/L 6-BA+0.4 mg/L NAA。
2.3 不同激素配比培养基对紧穗野生稻生根情况的影响
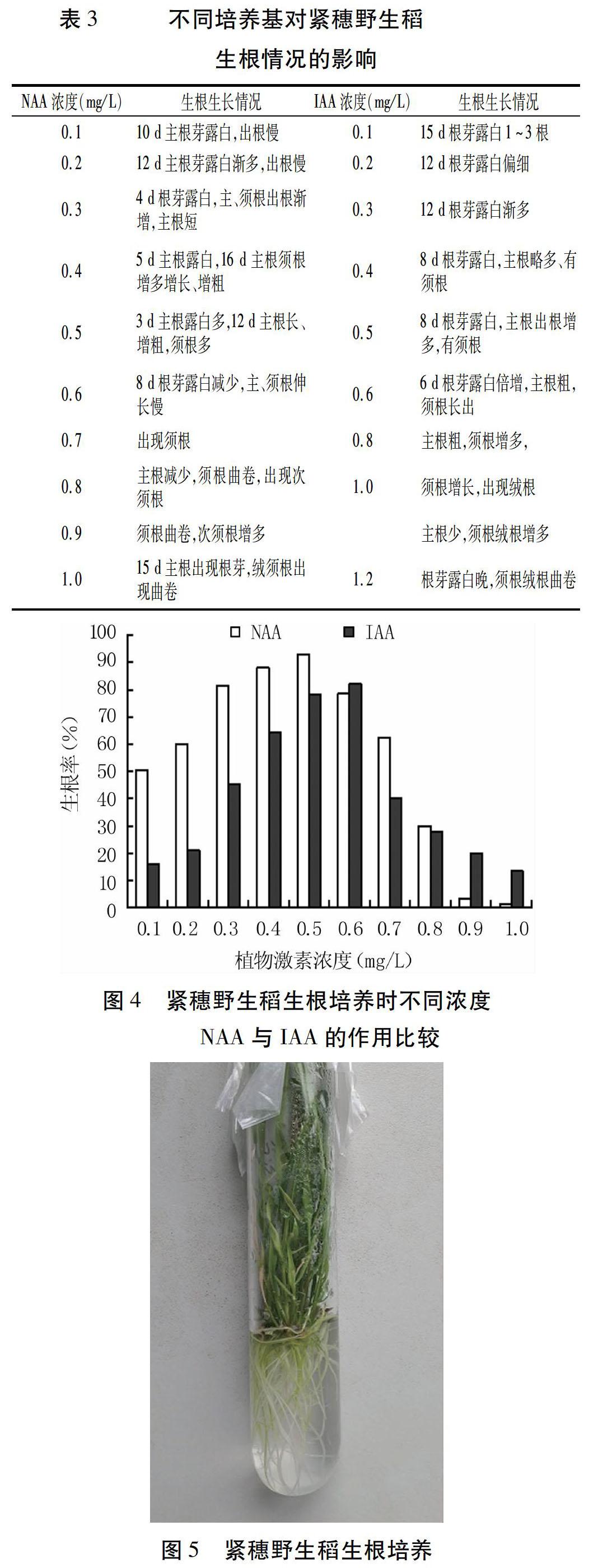
以MS为基本培养基,添加不同浓度NAA或IAA,均能使分化苗生根,生根率随NAA或IAA浓度的升高先升高后降低,且分别以0.5 mg/L NAA和0.6 mg/L IAA时生根率最高,分别为93%和82%(图4)。
综合来看,相比IAA,MS基本培养基中添加NAA更适合紧穗野生稻的生根培养,且以MS+0.5 mg/L NAA的生根率最高,3 d时根芽即露白,根芽露白越早,主根吸收养分就越早越充足,主根生长粗壮,长出的主根、须根多(图5、表3),用作紧穗野生稻生根培养最好。但当NAA浓度达到1.0 mg/L时,需培养15 d后根芽才露白,主根生根减少,须根绒根曲卷很难长出根芽,生根最差。说明NAA浓度过高,对根苗生根会产生严重的抑制作用。
2.4 炼苗与移栽
组培苗和自然生长苗的生长环境存在很多差异,要由室内环境逐渐过度到室外,生长环境由无菌状态变成有菌状态,培养温度和光照条件发生了改变。因此,需先进行炼苗处理,才能将组培苗移栽到田间。本试验结果表明,紧穗野生稻生根苗从揭膜、适应常温、温室定植到叶片展开、新根长出,再到田间移栽,需经历28 d,苗的成活率可达到93%。
2.5 紧穗野生稻与栽培稻的田间杂交试验
利用紧穗野生稻为父本,分别以栽培稻楚粳1号、楚粳2号、云资粳41号、云资粳43号、云资籼42号、云资籼44号为母本,组配成6个杂交组合,其中,与楚粳1号、楚粳2号的杂交组合未获得F1种子,其余4个组合均得到F1种子。
F1植株主要表现为四种类型:①母本型,植株矮小;②父本型,植株高,株型散;③中间型,表现在谷粒外形,父本长籽粒,母本圆籽粒,而后代籽粒尖头,尾圆;④超亲型,主要表现为分蘖力强。说明栽培稻与紧穗野生稻杂交具有较强的杂交优势。继续回交、自交后得到的种子存在畸形现象。
3 讨论与结论
3.1 培养基选择对紧穗野生稻愈伤组织诱导的影响
培养基是诱导细胞分裂、控制愈伤组织生长和分化的,选择合适的培养基是组织培养中最主要的因素。目前各种培养基中,无机盐的含量一般都比较高,对植物组织和细胞的离体培养适用性更好,由Murashige和Skoog设计的MS培养基各元素比例合理,对双子叶、单子叶、木本和草本的器官、组织、细胞及原生质体培养均有良好效果[3] 。本研究通过对MS和N6两种培养基的筛选,确定了适合紧穗野生稻根外植体愈伤诱导的基础培养基为MS,出愈率高且愈伤颗粒紧实。
3.2 激素对紧穗野生稻诱导愈伤产生的影响
植物生长调节剂是影响愈伤组织诱导形成的关键因素之一,2,4-D是诱导水稻组织不可缺少的关键激素成分[4]。不同植物外植体对2,4-D的浓度要求不同。
通过对9组不同浓度梯度2,4-D诱导效果的比对,确定11 mg/L 2,4-D诱导紧穗野生稻愈伤形成的效果最佳;其次为9 mg/L 2,4-D,诱导效果也较好。
3.3 激素对紧穗野生稻分化成苗的影响
植物生长调节剂是影响愈伤组织再分化的关键性因素之一[5-7]。细胞分裂素可促进植物细胞分裂和不定芽的形成,打破顶端优势形成丛生芽,有利于芽的增殖和继代培养[8]。6-BA是诱导水稻愈伤组织再生植株时常用的细胞分裂素[9],周玲艳等[10]认为,6-BA有利于水稻愈伤组织分化,加5 mg/L 6-BA的愈伤组织分化率较高,这与Kavikishor等[11]的结果一致,也与生长素NAA与一定比例的细胞分裂素诱导腋芽及不定芽产生的研究结果[12]相符。本试验结果表明,利用MS+5 mg/L 6-BA+0.4 mg/L NAA培养基,成功将紧穗野生稻根愈伤组织分化出健壮油绿的再生苗和丛生苗,并使分化率得到很大提高。
3.4 激素对紧穗野生稻组培苗生根的影响
众所周知,作为生长素的NAA和IAA,其主要作用是诱导愈伤的形成和胚状体的产生以及试管苗的生根。本试验通过对NAA和IAA各浓度梯度的生根效果进行比较发现,0.4 mg/L NAA对根芽启动效果最好,0.5 mg/L NAA生根率最高,可促进主根增粗和伸长,提高须根出根率,促进须根生长。而发达的根系能够保证组培苗吸收足够养分和水分以满足苗期生长的需要。
3.5 紧穗野生稻与栽培稻杂交后代的获得
由于野生稻属染色体的特殊性,与栽培稻杂交很困难,结实率非常低,要得到正常结实植株更难,严重影响对该类种质资源的利用,这也是困扰世界各国育种专家的最大难题[13,14]。本试验通过选择不同栽培稻亲本与紧穗野生稻进行杂交,发现不同亲本对后代结实影响较大,获得的F1种子外观改变也较大,并且种子发芽率较低。表明,紧穗野生稻与栽培稻进行远缘杂交是可行的,但在选育中不仅要注重农艺性状的选择,更要尝试与多个品种组配杂交组合,并加强回交和自交的选育,以选育出优异种质。
参 考 文 献:
[1] 李容柏,秦学毅,韦素美,等. 普通野生稻抗源94-42-5-1对稻褐飞虱的抗性评价及其遗传研究 [J]. 中国水稻科学,2002,16(2):115-118.
[2] 秦学毅,冯锐,郭辉,等. 非AA染色体药用野生稻的利用研究[J]. 广西农业科学,2009,40(10):1284-1288.
[3] 孙敬三,朱至清.植物细胞工程实验技术 [M]. 北京:化工工业出版社,2006:3,16-17.
[4] 王芳,原文霞,鲍根良,等. 药用野生稻胚拯救后代YF2快繁技术[J]. 浙江农业科学,2017,58(4):642-647.
[5] 葛台明. 小麦花药培养的基因型和培养基效应研究[J]. 华中农业大学学报,1996,15(5):400-413.
[6] 叶兴国,王连铮. 大豆花药愈伤组织的分化及内源激素的分析[J]. 作物学报,1997,23(5):555-561.
[7] 梁云涛,潘英华,余建平,等. 高秆野生稻愈伤组织诱导分化研究[J]. 西南农业学报,2014,27(3):905-909.
[8] 李胜,李唯. 植物组织培养原理与技术[M]. 北京:化工工业出版社,2007.
[9] 杨跃生,简玉瑜. 影响水稻愈伤组织再生植株数量和质量的因素[J]. 农业生物技术学报,1996,4(2):124-128.
[10] 周玲艳,秦华明,谢俊平,等. 提高水稻愈伤组织再生频率的研究[J]. 种子,2006,25(7):28-35.
[11] Kavikishor P B. Energy and osmotic requirement for high frequency regeneration of rice plants from long-term cultures [J]. Plant Science,1987,48:189-194.
[12] 潘瑞熾,施和平,李玲,等. 植物细胞工程 [M]. 广州:广东高等教育出版社,2006.
[13] 秦学毅,朱汝才,韦素美,等. 药用野生稻抗褐飞虱鉴定与利用技术研究[J]. 中国水稻科学,2004,18(6):573-576.
[14] 颜辉煌,胡慧英,傅强,等. 栽培稻与药用野生稻杂交后代的形态学和细胞遗传学研究[J]. 中国水稻科学,1996,10(3):138-142.

