不同耐热三色堇材料HSP70基因克隆及热胁迫下的表达分析
牛杨莉,朱小佩,杨亚萍,葛晓敏,杜晓华,刘会超
(河南科技学院 园艺园林学院,河南 新乡 453003)
三色堇(Violatricolor),又名蝴蝶花、猫脸花,为堇菜科堇菜属多年生草本观赏花卉,作为重要的花坛花卉,在我国很多城市栽培应用,市场需求量很大。然而三色堇不耐高温,当气温超过30 ℃便不能进行花芽分化,且植株生长不良[1]。因此,高温是影响三色堇推广应用的一个限制因素。
热激蛋白(Heat shock protein,HSP)是细胞受到高温或其他胁迫条件诱导而表达提高的一类功能型蛋白,广泛分布于原核生物和真核生物中,作为分子伴侣协助蛋白质正确折叠,促使其他蛋白质的重新折叠、稳定、组装、胞内运输和降解,增强细胞抵抗胁迫环境的忍耐力,从而提高适应性[2]。其中,HSP70是热激蛋白家族中重要成员,在植物受到热胁迫时,能够被快速诱导并大量表达[3]。拟南芥在热胁迫中过表达HSP70-1基因,证明HSP70能有效提高转基因植株的耐热性[4]。HSP70基因家族成员庞大,目前,发现拟南芥有18个HSP70基因[5],水稻32个[6],芝麻21个[7],大豆61个[8],棉花30个[9],辣椒21个[10]。HSP70基因家族结构高度保守,且分布于细胞核、细胞质、内质网、线粒体和叶绿体等细胞的各个部分。
河南科技学院三色堇资源与育种课题组自2006年开始进行三色堇资源的收集评价工作,通过自交选育、生理指标分析及田间耐热性鉴定,从100多份三色堇材料中筛选出了3份耐高温三色堇材料HAR、DFM-16和DFM-17。在热胁迫下,这些耐热材料的热害指数和细胞膜受损程度都明显低于不耐热材料[11]。前期从耐高温材料HAR中分离到了1个HSP70基因[12]。但其他耐热材料的HSP70基因是否与其相同,热敏材料的HSP70是否存在差异,是值得探索的问题。为此,以耐热材料DFM-16和热敏材料08H为试材,测定其HSP70基因序列,并分析热胁迫条件下基因的表达模式,为进一步解析三色堇的耐高温分子机制提供基础,同时也为挖掘和鉴定重要的高温应答基因、培育耐高温三色堇新种质提供重要的基因资源。
1 材料和方法
1.1 试验材料
试材为本课题组选育的耐热三色堇资源DFM-16和热敏三色堇资源08H,其来源与表型见表1。试验所用幼苗经种子播种繁殖,在育苗室培育。培育条件:昼/夜温度20 ℃/15 ℃,光照16 h/d,2个月后植株真叶数达到6~7片时进行处理、取材。

表1 三色堇资源名称及表型Tab.1 The names and phenotypes of pansy resource
1.2 主要试剂
RNA提取试剂盒和DNA提取试剂盒购自天根生化科技有限公司。cDNA反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)、凝胶回收试剂盒、荧光定量试剂、TaqDNA聚合酶、pMD18-T载体以及DNA Marker购自TaKaRa生物公司。
1.3 cDNA合成及基因组DNA(gDNA)提取
cDNA合成:从培养的DFM-16和08H植株材料上分别剪取幼嫩叶片,迅速放入液氮中研磨,总RNA提取根据天根RNA提取试剂盒说明书进行,然后用NanoDrop 2000测定提取的RNA浓度和纯度,琼脂糖凝胶电泳检测RNA完整性,以质量检测合格(OD260/280为1.9~2.1,电泳显示2条清晰且无拖尾条带)的RNA为模板,参照TaKaRa PrimeScriptTMRT reagent Kit with gDNA Eraser说明书合成cDNA。
gDNA提取:从培养的DFM-16和08H植株材料上分别剪取幼嫩叶片,迅速放入液氮中研磨,DNA提取按照天根DNA提取试剂盒说明书进行,用NanoDrop 2000检测提取的DNA浓度和纯度,琼脂糖凝胶电泳检测DNA完整性,提取质量合格的DNA(OD260/280为1.8左右,电泳显示1条清晰条带)用作后续扩增基因序列的模板。
1.4 VtHSP70 cDNA序列及gDNA序列扩增
根据已测定的三色堇HAR材料中HSP70基因序列[12],利用Primer 5.0设计引物(表2)。PCR扩增体系(20 μL):cDNA或gDNA模板约为100 ng,10×PCR Buffer 2 μL,dNTP 1.6 μL,上、下游引物(10 μmol/L)各0.6 μL,TaqDNA聚合酶0.5 U,无菌水补足至20 μL。PCR反应程序:94 ℃预变性1 min,94 ℃变性30 s,48 ℃ 退火30 s,72 ℃延伸2 min,35个循环,72 ℃终延伸5 min。扩增产物用1%琼脂糖凝胶电泳进行检测,并利用TaKaRa凝胶回收试剂盒进行回收。将回收产物连接于pMD18-T载体上,经E.coil感受态细胞转化和蓝白斑筛选后,将重组载体菌液送至上海生工生物工程有限公司测序。

表2 VtHSP70基因克隆及qRT-PCR分析所用引物序列
1.5 VtHSP70 cDNA序列及gDNA序列分析
测序结果利用Seq Man软件进行拼接。采用NCBI的ORF finder预测开放阅读框(Open reading frame,ORF),BLAST进行序列同源性比对。从NCBI网站下载其他植物的HSP70序列,利用DNAMAN软件做系统进化树。
1.6 VtHSP70基因表达水平分析
选取DFM-16和08H生长一致且健壮的植株,放在光照培养箱中于42 ℃下分别热激处理0、1、2、6、12 h,每个处理包括5株植株,处理结束后取5株植株的新鲜叶片进行混样,用液氮迅速冷冻,提取样品RNA,反转录为cDNA序列。基于扩增的VtHSP70cDNA序列,设计qRT-PCR引物,选用三色堇β-Actin基因作为内参,引物序列见表2。qRT-PCR反应体系为:TB Green Premix ExTaqⅡ(2×)7.5 μL,上、下游引物(10 μmol/L)各0.6 μL,cDNA(10 ng/μL) 1 μL,补超纯水至15 μL。扩增程序为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。反应结束后分析产物的荧光值变化曲线和熔解曲线,采用2-ΔΔCT法计算每个样本中目标基因的相对表达水平(ΔΔCT=ΔCT.Gene-ΔCT.Control,其中,ΔCT.Gene为待测组目的基因与内参基因CT的差值,ΔCT.Control为对照组目的基因与内参基因CT的差值)。每个样本设3个技术重复,在同一批次完成目的基因和内参基因的PCR反应。
2 结果与分析
2.1 VtHSP70基因cDNA序列及gDNA序列扩增
以DFM-16和08H材料的cDNA为模板,扩增2个材料中VtHSP70cDNA序列。电泳结果显示,2个材料中VtHSP70cDNA序列大小相同,略大于2 000 bp(图1)。测序结果表明,2个VtHSP70cDNA序列均为2 042 bp,预测ORF都为1 950 bp,推测编码649个氨基酸,序列相似性为98.61%。
以DFM-16和08H材料的DNA为模板,扩增2个材料中VtHSP70gDNA序列。电泳结果显示,2个材料中VtHSP70gDNA序列大小也基本相同,在3 000 bp左右(图1)。测序结果表明,DFM-16中VtHSP70gDNA为2 514 bp,08H中为2 505 bp,序列相似性达到92.19%。cDNA和gDNA序列分析显示,2个基因都含有1个内含子,DFM-16材料中内含子长度为570 bp,位置在218—787 bp,08H材料中内含子长度为561 bp,位置在218—778 bp(图2)。
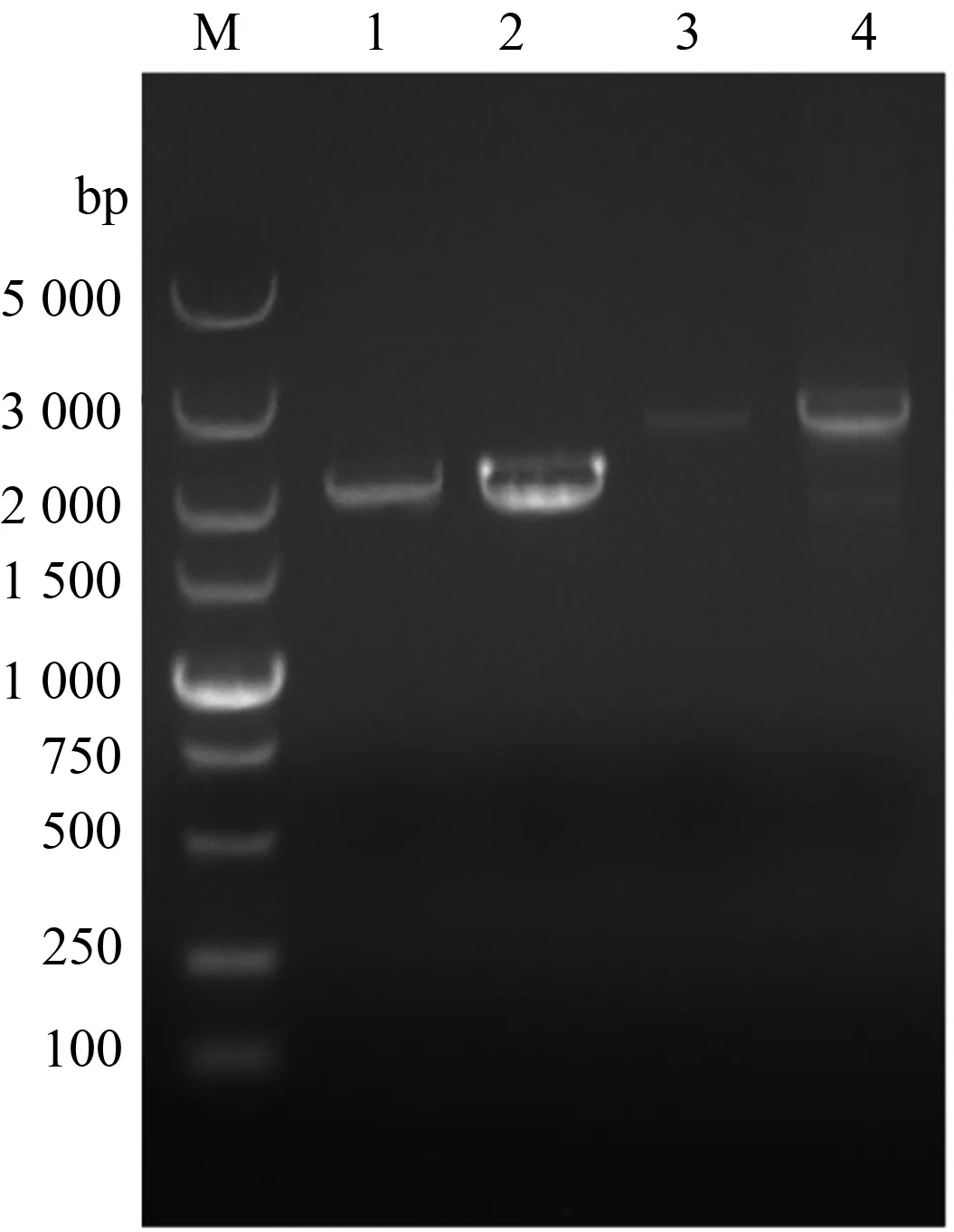
1.DFM-16 cDNA;2.08H cDNA;3.DFM-16 gDNA;4.08H gDNA

黄色区域为蛋白质编码区,黑色直线为内含子区域,蓝色区域为UTR区
2.2 VtHSP70基因同源比对及系统进化分析
根据预测出的VtHSP70基因编码的氨基酸序列,与拟南芥、水稻和芝麻中HSP70基因编码序列进行比对(图3),氨基酸相似度分别达到96.26%、95.85%、93.49%。结果表明,三色堇VtHSP70基因与拟南芥的同源性较高,与水稻和芝麻次之。其中,三色堇VtHSP70氨基酸序列C末端含有一段EEVD序列,该序列为胞质HSP70的特征序列,表明本研究分离的VtHSP70基因编码产物可能定位在细胞质中。
在同源比对的基础上,为分析三色堇中VtHSP70的进化关系和分类,选取拟南芥、水稻、芝麻中HSP70家族所有成员,共71个HSP70氨基酸序列构建系统进化树。从亲缘远近来看,2个三色堇材料首先聚类,其次与拟南芥聚类,接着是水稻,最后是芝麻,表明在所选的几种植物中,三色堇与拟南芥亲缘关系最近,与芝麻最远(图4)。并且2个三色堇材料所聚的这类HSP70都属于胞质HSP70,证明2个三色堇材料中的HSP70都定位在细胞质中。

红框内为细胞质中高度保守的HSP70 C末端标志序列EEVD; Vt:三色堇;At:拟南芥;Os:水稻;Si:芝麻
2.3 高温胁迫下VtHSP70基因的表达
42 ℃热激处理后,耐热材料DFM-16在12 h内生长状况良好,形态无明显变化。而热敏材料08H在2 h时叶片开始出现轻微皱缩萎蔫,随着热激时间延长,萎蔫症状加重,至12 h时,严重萎蔫并伴随植株倒伏(图5)。
采用qRT-PCR检测不同热激时间下2种材料中VtHSP70基因的表达水平,以未经热激(0 h)处理的08H材料的样本为对照,经42 ℃热激处理后,2个材料中VtHSP70基因的转录水平在4个处理时间都升高,且在2 h时有最高表达水平,6 h和12 h时表达水平相似,都有所回落,但仍然高于对照水平。比较2个材料中VtHSP70基因表达水平发现,耐热材料DFM-16中VtHSP70基因的表达量在室温和热激处理条件下都高于热敏材料08H,DFM-16材料中最高表达倍数为其0 h的524倍,而08H材料仅为其0 h的36倍(图5)。

星号标记为DFM-16和08H VtHSP70蛋白,弧线标记为定位在胞质的HSP70

图5 不同热激时间下三色堇的表观特征及VtHSP70基因的表达水平
3 结论与讨论
HSP70是HSP家族中非常保守的一类应激蛋白。本研究测定了耐热材料DFM-16和热敏材料08H中VtHSP70的cDNA序列,与拟南芥、水稻和芝麻中HSP70基因编码的氨基酸序列相似性均在90%以上,这与陈曦[13]的研究结果一致,说明VtHSP70基因高度保守。
编码细胞质HSP70的基因通常具有0个或1个内含子,而编码细胞器HSP70的基因具有多个内含子[14]。通过基因结构分析,2个材料中VtHSP70均含有1个内含子,由此推测DFM-16和08H材料中的VtHSP70编码细胞质的HSP70。根据HSP70亚细胞位置,可分成细胞核HSP70、细胞质HSP70、内质网HSP70、线粒体HSP70和叶绿体HSP70。本研究中2个三色堇VtHSP70 氨基酸序列均含有一段胞质HSP70的特征序列EEVD,依据蛋白质序列的结构和功能的相似性,通过系统进化树的聚类,可根据已知的蛋白质特性来推测同一类未知的蛋白质特性[15]。根据2个三色堇材料与拟南芥、水稻和芝麻的氨基酸聚类结果,发现2个材料中的VtHSP70首先与其他植物中的胞质HSP70聚类,进一步说明VtHSP70定位于细胞质中。
大量研究表明,HSP70基因在调控植物抗逆过程中发挥了重要作用,植物在受到不利条件,如高温逆境胁迫时,会上调HSP70的表达量,增强对高温胁迫的抵抗力[16-17]。大部分植物在37~45 ℃的环境下,HSP70基因都会在0.5~2 h后被大量诱导表达[18-19];拟南芥[20]和小麦幼苗[21]在40 ℃处理1 h时,HSP70基因的表达量均达到最高值,42 ℃处理蜡梅1 h时,CpHSP70基因表达量也达到最高,将近对照的10倍[22];本研究中,与其他植物相类似,42 ℃热胁迫处理下,DFM-16和08H材料中VtHSP70基因表达量都明显上升,且在1 h就能被诱导,表达模式为随着胁迫时间延长,基因表达水平先升高后降低。推测当高温胁迫时,HSP70基因激活并快速大量表达以维持功能蛋白稳态,但胁迫持续进行使植物体长时间处于亚健康状态时,超越了HSP70维持机体功能蛋白稳态的限度,各种生理功能开始受到影响,HSP70表达量出现下调。但与拟南芥、蜡梅和小麦中研究结果[20-22]不同,三色堇VtHSP70基因在2 h表达量最高,这可能是物种差异,也可能是由于HSP70基因成员不同而出现的差异。在42 ℃热胁迫处理下,08H材料较DFM-16材料对热胁迫的反应更敏感,比较其VtHSP70基因表达水平发现,耐热材料DFM-16中VtHSP70基因的表达量在室温条件和热激处理条件下都明显高于热敏材料08H,DFM-16材料中最高表达倍数达到对照的524倍,而08H材料仅为对照的36倍,表明VtHSP70基因的表达水平可能与三色堇的耐热性呈正相关。这种表达水平上的差异可能与基因的调控区域以及DNA甲基化等有关。

