基于高通量测序技术的中温大曲中微生物群落多样性解析
胡晓龙 王康丽 牛广杰 乔亚娟 张玉 何培新

摘要:采用高通量测序技术对河南省某酒企中温大曲曲皮和曲心两个部位的真菌群落和细菌群落的多样性及其组成进行了研究.结果表明:1)中温大曲曲皮样品中真菌群落多样性和丰度均高于曲心样品;子囊菌门是大曲曲皮和曲心样品中的唯一优势菌门;大曲样品中共检测到15种真菌,其中扣囊复膜孢酵母、雪黄散囊菌和毕赤酵母sp1为曲皮和曲心样品中的优势真菌,扣囊复膜孢酵母在曲皮和曲心样品中的含量基本一致,而雪黄散囊菌和毕赤酵母sp1在曲皮和曲心样品中的含量差异较大.2)中温大曲曲心样品中细菌群落多样性高于曲皮样品,但其丰度低于曲皮样品;在大曲样品中共检测到28个属,其中肠杆菌属、乳杆菌属、乳球菌属、布氏杆菌属、肠球菌属和欧文氏菌属为大曲样品中的优势细菌属,除布氏杆菌属外,其他优势细菌属在曲皮和曲心样品中的含量差异较大.
Abstract:The diversity and structure of fungal and bacterial communities in Qupi and Quxin of medium temperature Daqu from one wine corporation located in He′nan were analyzed based on the high|throughput sequencingtechnology.The results showed that:1) The diversity and abundance of fungal community in Qupi were higher than those in Quxin samples,and Ascomycetes was the only dominant fungi detected both in Qupi and Quxin.A total of 15 species of fungi was detected in Daqu,of which Saccharomycopsis fibuligera,Eurotium niveoglaucum,Pichia sp1 were the dominant fungi in Qupi and Quxin samples.Among them,the content of Saccharomvcopsis fibuligera in Qupi was similar to that in Quxin,however,the contents of Eurotium niveoglaucum and Pichia sp1 in Qupi and Quxin samples were quite different.2) The diversity of bacterial community in Quxin of medium temperature Daqu was higher than that of Qupi,but its abundance was lower than that of Qupi.A total of 28 genera was detected in the Qupi and Quxin samples,of which Enterobacter,Lactobacillus,Lactococcus,Brucella,Enterococcus and Erwinia were dominant bacteria of Daqu samples.Expect for Brucella,the content of other dominant bacteria had a large difference in Qupi and Quxin.
關键词:白酒;中温大曲;微生物群落;高通量测序技术
Key words:Chinese liquor;medium temperature Daqu;microbial community;high|throughput sequencing technology
中图分类号:TS261.1文献标识码:ADOI:10.3969/j.issn.2096-1553.2019.04.004
文章编号:2096-1553(2019)04-0021-09
0 引言
曲作为一种糖化剂、发酵剂、产香剂和原料,在制酒、制醋、制酱油等传统酿造行业的应用已有几千年的历史.其中,大曲主要用于白酒固态发酵[1],其品质的优劣在很大程度上决定了白酒的品质和风格.大曲主要是以大麦、小麦、豌豆等单一或多种谷物为原料,经破碎、加水混合再压成块状曲醅[2],经自然或人工接种并在适宜的温度和湿度条件下进行固态发酵,经成型、控温、贮存等十几个环节而制成块曲或砖曲.制曲过程中,纯种或环境中的微生物在适宜的条件下经过长时间的富集和培养,可在曲醅表面和内部形成有益的酿酒微生物群系[3].大曲微生物菌群复杂,主要集中在酵母菌、霉菌和细菌三类菌中,三者在酿酒过程中的糖化、产香、产酒方面可以协同作用,但各自侧重不同[4]:酵母菌有酒化和酯化的作用;霉菌助产一些生物酶,如红曲霉和米根霉产酯化酶,黑曲霉助产淀粉酶、蛋白酶和糖化酶[5-6];细菌助产一些呈香物质,如吡嗪类化合物、愈创木酚、苯甲醛、乳酸、芳香族化合物等多种香气成分.此外,大曲中还有少量的放线菌,其功能虽然尚不明确,但其可以产生蛋白酶,使蛋白质分解成氨基酸,进而与淀粉分解生成的糖反应会产生醛、酮、吡嗪类化合物等香味物质.
目前,关于大曲群落信息研究的报道很多[7-8],其所采用的方法包括传统可培养方法[9]、传统分子生态学方法(16s rDNA克隆文库法[10]、PCR|DGGE[11],扩增核糖体DNA限制性分析[12]和PLFA[13]等)和高通量测序技术[14].尤其是高通量测序技术的应用,使得大曲中痕量微生物和不可培养微生物得以被发现,极大地丰富了人们对大曲中微生物群落多样性的认识.目前对产自四川、贵州等地区的大曲微生物的研究较多,但对产自河南地区的大曲微生物群落的研究相对较少,且对产自河南地区的大曲曲皮和曲心微生物群落差异尚不明晰.基于此,本文拟采用高通量测序技术研究河南地区中温大曲曲皮和曲心两个部位的微生物群落多样性及其组成,以期拓展对河南地区中高温大曲中微生物种类的研究,在一定程度上丰富对我国不同地区中温大曲微生物多样性的认识.
1 材料与方法
1.1 材料和仪器
1.1.1 样品采集 中温大曲样品,取自河南某知名酒厂,取曲块表面厚度约为1 cm的大曲作为曲皮样品,粉碎后备用; 在曲块中心,取长、宽、厚均为5 cm的正方体作为曲心样品,粉碎后备用.
1.1.2 主要试剂 2×Taq PCR MasterMix,上海天根生物公司产;引物ITS1/ITS4和515F/806R,
氯化钠、苯酚、氯仿,生工生物上海股份有限公司产;无水乙醇,上海联硕生物技术有限公司产;Triton X-100,上海碧云天生物技术有限公司产;SDS,美国Amresco公司产;Tris,北京索莱宝科技有限公司产;EDTA,上海国药集团化学试剂有限公司产;醋酸铵,天津市科密欧化学试剂有限公司产.以上试剂均为分析纯.
1.1.3 主要仪器 MP200A型精密电子天平,上海良丰仪器仪表有限公司产; TG16-WS型台式高速离心机,安徽中佳科学仪器有限公司产;DKY-Ⅱ型恒温调速回转式摇床,倍辉北京产品部产;ZDX-35B型灭菌锅,上海三申医疗器械厂产;SW-CJ-1F型超净工作台,苏州净化设备有限公司产;JY92-Ⅲ型PCR仪,宁波新芝生物科技股份有限公司产;DYY-8C型琼脂糖电泳仪,北京市六一仪器厂产.
1.2 实验方法
1.2.1 基因组提取
1.2.1.1 样品预处理 分别称取7 g大曲曲皮和曲心样品,用20 mL灭菌后的0.1 mol/L PBS缓冲液悬浮,加入3—5颗玻璃珠,漩涡振荡5 min后在300 r/min转速下离心5 min,取上清液,沉淀用PBS缓冲液重复洗涤3次,离心后合并上清液.将上清液于9000 r/min转速下离心3 min,弃去上清液,收集细胞沉淀.再用 5 mLPBS缓冲液重复洗涤3次,每次于9000 r/min转速下离心3 min,收集细胞沉淀.最后将细胞沉淀用1.5 mL PBS缓冲液重新悬浮,该悬浮液用于基因组提取.
1.2.1.2 DNA的提取 上述悬浮液中DNA的提取参照H.Y.Wang等[15]的方法.
1.2.2 PCR扩增与高通量测序 采用原核微生物16S rRNA基因序列V4可变区设计的通用引物515F/806R[16]和真核生物通用引物ITS1/ITS4分别对上述基因组进行PCR扩增,两种引物的PCR扩增和高通量测序方法分别参照胡晓龙[17]和朱文優[18]的方法进行.
1.2.3 数据处理
1.2.3.1 序列质量控制 采用Cutadapt(v1.9.1),Vsearch(1.9.6),Qiime(1.9.1)分析软件对所测原始序列进行质量控制:首先,将每对双向测序的序列进行比对,根据比对的末端重叠区进行拼接,拼接时保证至少有20 bp的重叠区,去除拼接结果中含有N的序列;接着,去除引物和接头序列,去除两端质量值低于 20 bp的碱基,去除长度小于200 bp的序列;最后,将上面拼接过滤后的序列与数据库进行比对,去除其中的嵌合体序列,得到最终的有效数据.
1.2.3.2 操作分类单元(OTU)分析 采用Qiime′s uclust程序将相似度为97%的有效序列归为一个OTU,并确定每个OTU的代表序列[17].将获得的每个OTU的代表序列与RibosomalDatabase Project(RDP)在线数据库进行比对,选取置信度为80%的阈值对上述序列进行分类,进而确定每个OTU的分类水平,即门、纲、目、科、属、种水平.
2 结果与讨论
2.1 大曲样品中真菌群落多样性及其组成分析
2.1.1 大曲真菌群落多样性
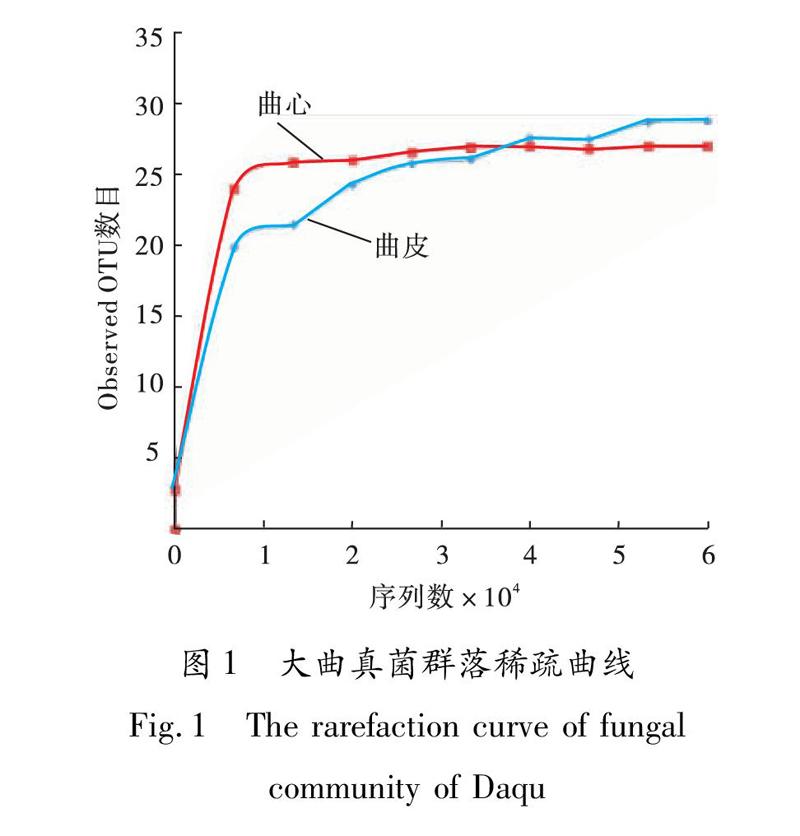
大曲真菌群落稀疏曲线如图1所示.由图1可知,当测序深度超过10 000序列时,曲皮和曲心样品中真菌群落Observed OTU数目基本不再增加,稀疏曲线趋于平缓.由于本实验所测序列深度远高于10 000条,因此,本文所选取样品有效测序数量能够较全面地反映待测大曲样品的真菌群落多样性信息.
大曲真菌群落多样性指数见表1.由表1可知,经过Illumina Miseq高通量测序和序列质量控制,曲皮和曲心样品中真菌菌群中所得有效序列分别为66 850条和 70 954条.曲皮样品中真菌群落的Shannon和 Chao1指数均略高于曲心样品,表明曲皮样品中真菌群落多样性和丰度高于曲心样品.这可能是由于在制曲和存放过程中曲皮和空气或地面直接接触,氧气充足,而曲心温度高于曲皮且氧含量低于曲皮,进而导致曲皮真菌群落多样性和丰度高于曲心,这与李燕荣等[19]的研究结果一致.
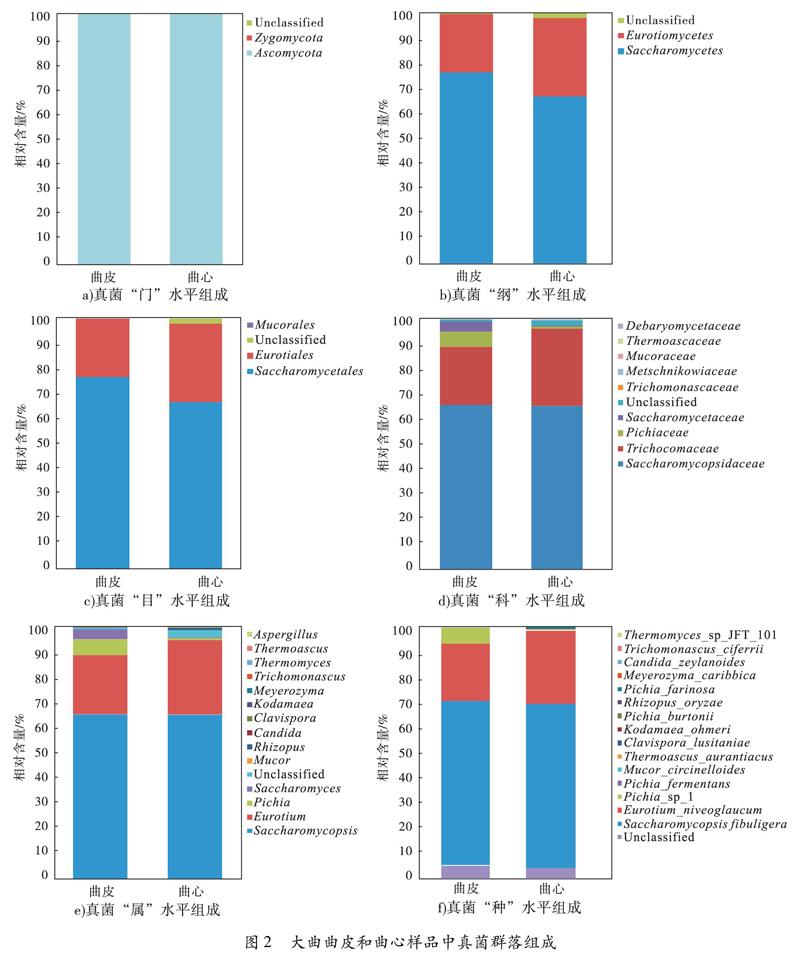
2.1.2 大曲真菌群落组成 大曲曲皮和曲心样品中真菌群落组成如图2所示.由图2可知,代表性OTU序列的物种注释结果表明,除“门”水平外,大曲曲皮和曲心样品在不同分类水平上存在一定的差异.
在“门”水平(图2a)),子囊菌门(Ascomycota)是曲皮和曲心样品中的唯一优势(相对含量≥1%)菌门,相对含量均大于99%,同时也是四川和安徽等地区中温大曲中的优势真菌菌门[18,20].
在“纲”水平(图2b)),酵母纲(Saccharomycetes)和散囊菌纲(Eurotiomycetes)为大曲样品中的优势真菌,且其中酵母纲的相对含量远高于散囊菌纲的相对含量;较之于曲心,曲皮样品中酵母纲相对含量较高,散囊菌纲相对含量较低.
在“目”水平(图2c)),酵母菌目(Saccharomycetales)和散囊菌目(Eurotiales)为大曲样品中的优势微生物,同时也含有少量的毛霉目(Mucorales).
在“科”水平(图2d)),共检测到9个科,其中复膜孢酵母科(Saccharomycopsidaceae)、发菌科(Trichocomaceae)、毕赤酵母科(Pichiaceae)和酵母科(Saccharomycetaceae)为大曲样品中的优势菌科,其在曲皮和曲心样品中的平均相对含量分别为65.3%,27.2%,3.5%和2.2%.较之于曲心样品,曲皮中毕赤酵母科(6.3%)和酵母科(4.1%)的相对含量较高;复膜孢酵母科在曲皮(65.4%)和曲心(65.2%)中的相对含量差别不大;发菌科(23.3%)的相对含量较低.
在“属”水平(图2e)),共检测到14个属,其中复膜孢酵母属(Saccharomycopsis)、散囊菌属(Eurotium)、毕赤酵母属(Pichia)和酵母属(Saccharomyces)为大曲样品中的4个优势菌属,其在曲皮和曲心样品中的平均相对含量分别为65.3%,26.3%,3.5%和2.2%.尽管复膜孢酵母属和毕赤酵母属是不同地域中温大曲样品共有的优势微生物,但不同地域中温大曲样品整体的优势微生物组成存在明显的差异,如安徽某酒厂中温大曲中有7种优势真菌,四川某酒厂中温大曲中则有10多种优势真菌[18,20],这主要是由于地理环境、水源、气候、工艺等的不同所造成的微生物群落的区域差异.此外,复膜孢酵母属在曲皮样品(65.4%)中和曲心样品(65.2%)中的相对含量基本相同;而散囊菌属在曲皮样品(23.2%)中的相对含量低于曲心样品(29.3%);毕赤酵母属和酵母属在曲皮样品(6.3%和4.1%)中的相对含量均远高于曲心样品(0.8%和0.3%).
在“种”水平(图2f)),共检测到15个种,其中扣囊复膜孢酵母(Saccharomycopsis fibuligera)、雪黄散囊菌(Eurotium niveoglaucum)和毕赤酵母sp1(Pichia sp1)为曲皮和曲心樣品中的优势真菌,其在曲皮和曲心样品中的平均相对含量分别为 65.3%,26.1%和3.4%.在优势真菌组成上,曲皮和曲心样品中扣囊复膜孢酵母含量基本一致,分别为 65.4%和65.2%;雪黄散囊菌在曲皮样品(23.0%)中的含量低于曲心样品(29.2%);毕赤酵母sp1在曲皮样品(6.1%)中含量远高于曲心样品(0.7%).
2.2 大曲样品中细菌群落多样性及其组成分析
2.2.1 大曲细菌群落多样性 经过Illumina Miseq高通量测序和序列质量控制,曲皮和曲心样品中细菌菌群中所得有效序列分别为42 590条和 50 323条,其平均长度大小分别为459 bp和462 bp.通过图3所示大曲细菌群落稀疏曲线可以看出,测序深度大于10 000条时,稀疏曲线趋于平缓,由于本实验所测序列深度远高于10 000条,因此,本文所选取样品有效测序数量能够充分反映待测大曲样品的细菌群落多样性信息.
由表1可知,曲心样品中细菌群落的Shannon指数高于曲皮样品,表明曲心样品中细菌群落多样性高于曲皮样品.但是,曲皮样品中细菌群落Chao1指数高于曲心样品,表明曲皮样品中细菌群落丰度略高于曲心样品,这一研究结果与李登勇等[21]发现的高温大曲细菌群落分布规律相近.
2.2.2 大曲细菌群落组成 大曲曲皮和曲心样品中细菌群落组成如图4所示.由图4可知,曲皮和曲心部位细菌群落组成在门、纲、目、科、属、种水平上均存在一定的差异.
在“门”水平(图4a)),共检测到5个门.其中变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)为曲皮和曲心样品中的优势菌门,其在曲皮和曲心样品中的平均含量分别为79.6%和17.1%.较之于曲心样品,曲皮中的变形菌门相对含量较高,厚壁菌门相对含量较低,而酸杆菌门仅在曲皮样品中可以检测到.
在“纲”水平(图4b)),共检测到10个纲,其中γ-变形菌纲(Gammaproteobacteria)、芽孢杆菌纲(Bacilli)和α-变形菌纲(Alphaproteobacteria)为大曲样品中的优势菌纲.较之于曲心样品,曲皮中的γ-变形菌纲相对含量较高,而芽孢杆菌纲相对含量(9.9%)明显低于曲心(24.2%).此外,Deltaproteobacteria,Holophagae,vadinHA17和鞘脂杆菌纲(Sphingobacteriia)4种纲仅在曲皮样品中可以检测到.
在“目”水平(图4c)),共检测到12个目,其中肠杆菌目(Enterobacteriales)、乳杆菌目(Lactobacillales)和根瘤菌目(Rhizobiales)为大曲样品中的优势菌目.肠杆菌目在曲皮样品中的相对含量(82.7%)高于在曲心样品中的相对含量(73.2%);乳酸杆菌目在曲皮中的相对含量(8.2%)远低于在曲心样品中的相对含量(24%);根瘤菌目在曲皮中的相对含量(1.3%)和在曲心中的相对含量(1.4%)基本相同.
在“科”水平(图4d)),共检测到19个科,其中肠杆菌科(Enterobacteriaceae)、链球菌科(Streptococcaceae)、肠球菌科(Enterococcaceae)、乳杆菌科(Lactobacillaceae)
和布鲁氏菌科(Brucellaceae)为大曲样品中的优势菌科.曲皮样品中肠杆菌科的相对含量(82.7%)和乳杆菌科的相对含量(2.5%)均高于其在曲心样品中的含量(分别为73.2%和0.6%);而曲皮样品中链球菌科的相对含量(4.9%)和肠球菌科的相对含量(0.4%)明显低于其在曲心样品中的相对含量(分别为18.6%和4.7%).
在“属”水平上(图4e)),共检测到28个属,其中肠杆菌属(Enterobacter)、乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、布氏杆菌属(Brucella)、肠球菌属(Enterococcus)和欧文氏菌属(Erwinia)为大曲样品中的优势菌属,其含量分别占曲皮和曲心细菌含量的90.0%和97.8%,且肠杆菌属含量明显高于其他优势菌属.肠杆菌属和肠球菌属也是四川和贵州某些高温大曲中的优势微生物,其主要代谢产物包括乳酸等,有助于香气物质乳酸乙酯的形成,并有效抑制杂菌的生长[21].上述优势细菌中除布氏杆菌属外,其余5个优势细菌属在曲皮和曲心样品中含量差异较大.
在“种”水平(图4f)),共检测到38个种,其中布鲁氏菌(Brucella microti)、肠杆菌(Enterobacter cloacae)、烟性肠杆菌(Enterobacter tabaci)、鹑鸡肠球菌(Enterococcus gallinarum)、Erwiniagerundensis和格氏乳球菌(Lactococcus garvieae)为大曲样品中的优势细菌,其在曲皮和曲心样品中平均含量分别为1.2%,62.8%,10.4%,2.5%,4.0%和11.7%.在优势细菌组成上,肠杆菌和烟性肠杆菌曲皮含量高于曲心样品;鹑鸡肠球菌、Erwinia gerundensis和格氏乳球菌在曲皮样品中的含量远低于曲心样品;布鲁氏菌在曲皮和曲心样品含量基本一致.
3 结论
本研究采用高通量测序技术对河南某酒企中温大曲样品中的真菌群落和细菌群落多样性及其组成进行了解析,主要结论如下:
1)中温大曲曲皮样品中真菌群落多样性和丰度均高于曲心样品;子囊菌门是大曲曲皮和曲心样品中的唯一优势菌门,其在曲皮和曲心样品中的相对含量均大于99%;大曲样品中共检测到15种真菌,其中扣囊复膜孢酵母、雪黄散囊菌、毕赤酵母sp1为曲皮和曲心样品中的优势真菌,
扣囊复膜孢酵母在曲皮和曲心样品中的含量基本一致,分别为65.4%和 65.2%,而雪黄散囊菌和毕赤酵母sp1在曲皮和曲心樣品中的含量差异较大.
2)中温大曲曲心样品中细菌群落多样性高于曲皮样品,但其丰度低于曲皮样品;在曲皮和曲心样品中共检测到28个属,其中肠杆菌属、乳杆菌属、乳球菌属、布氏杆菌属、肠球菌属和欧文氏菌属为大曲样品中的6个优势细菌属,除布氏杆菌属外,其他优势细菌属在曲皮和曲心样品中的含量差异较大.
该结果在一定程度上丰富了对我国不同地区中温大曲微生物群落多样性的认识,同时为今后科学设计或选用多种培养方法定向分离大曲功能微生物,以及在实际生产过程中合理配比曲皮和曲心样品提供了一定的理论依据.
参考文献:
[1] 刘超.地衣芽孢杆菌产酱香的发酵工艺与转座子突变体库的构建[D].武汉:湖北工业大学,2013.
[2] 潘明,侯华,王世宽,等.浓香型大曲中细菌的分类统计分析[J].酿酒科技,2012(11):28.
[3] 王彩虹.基于克隆文库法研究不同香型大曲微生物群落结构[D].成都:四川理工学院,2014.
[4] 申孟林,张超,王玉霞,等.白酒大曲微生物酶系研究进展[J].中国酿造,2018,37(4):7.
[5] 李幼筠,周逦.科学利用微生物推动中国酱油工艺大变革[J].中国酿造,2011,30(1):1.
[6] 包启安.酱油科学与酿造技术[M].北京:中国轻工业出版社,2011.
[7] WANG C L,SHI D J,GONG G L.Microorganisms in Daqu:a starter culture of Chinese Maotai|flavor liquor[J].World Journal of Microbiology & Biotechnology,2005,24(10):2183.
[8] 杨代永,范光先,汪地强,等.高温大曲中的微生物研究[J].酿酒科技,2007(5):37.
[9] 侯小歌,杜小波,李学思,等.中温大曲中乳酸菌的分离鉴定及产酸特性[J].酿酒科技,2010(9):17.
[10]张会敏,束莹,周庆伍,等.利用非培养技术研究古井贡酒大曲中的细菌群落结构[J].现代食品科技,2014,30(4):44.
[11]高亦豹,王海燕,徐岩.利用PCR|DGGE未培养技术对中国白酒高温和中温大曲细菌群落结构的分析[J].微生物学通报,2010,37(7):999.
[12]LI H.Bacterial diversity in the central black component of Maotai Daqu and its flavor analysis[J].Ann Microbiol,2014,64(4):1659.
[13]赵金松,郑佳,沈才洪,等.基于磷脂脂肪酸分析技术的大曲微生物群落结构多样性研究[J].食品工业科技,2017(1):154.
[14]沈毅,程伟,邓小波,等.酱香高温大曲、酒醅和窖泥的真菌多样性分析[J].酿酒科技,2019(3):17.
[15]WANG H Y,ZHANG X J,ZHAO L P,et al.Analysisand comparison of the bacterial community in fermented grains during the fermentation for two different styles of Chinese liquor[J].Journal of Industrial Microbiology and Biotechnology,2008,35(6):603.
[16]CAVALEIRO A J,SOUSA D Z,ALVES M M.Methane production from oleate:assessingthe bioaugmentation potential of Syntrophomonas zehnderi[J].Water Res,2010,44:4940.
[17]胡晓龙.浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D].无锡:江南大学,2015.
[18]朱文优.大曲中赭曲霉毒素A及其产生微生物的分布特征研究[D].无锡:江南大学,2017.
[19]李燕荣,杨勇,张龙云,等.中高温大曲发酵过程微生物消长规律探析[J].酿酒科技,2019(5):89.
[20]李静心,王艳丽,何宏魁,等.基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构[J].食品与发酵工业,2018,44(12):56.
[21]李登勇,黄钧,丁晓菲,等.酱香大曲间微生物群落结构时空特征的表征[J].食品工业科技,2018,39(23):145.

