抗生素环丙沙星胁迫植物乳杆菌ZLC-18应激反应的研究
,*
(1.东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030;2.黑龙江省绿色食品科学研究院,黑龙江哈尔滨 150028)
氟喹诺酮类药物主要有诺氟沙星、环丙沙星、培氟沙星、依诺沙星和氧氟沙星等。环丙沙星人类、牲畜使用最广泛的第三代氟喹诺酮类药物,抗菌谱广,对革兰氏阴性和阳性细菌作用极强[1],Machuca等[2]发现在1.0 μg/mL的环丙沙星胁迫下,大肠杆菌会受到中度DNA损伤。不适当的剂量、不良的依从性和低质量浓度抗生素的频繁使用,导致在人类、牲畜体内和环境中均出现了抗生素残留的问题[3-4]。当人体摄入有抗生素残留的食物或长期不当地服用抗生素时,其肠道菌群微生态会遭到破坏。Carman等[5]研究表明当环丙沙星剂量水平低于1.5 mg/人/d的传统阈值ADI(每日允许摄入量)时,都会改变体外模型系统中人肠道菌群的生态学。而益生菌能够调节人体肠道微生物群的代谢活动,改善宿主的健康,因此可以开发一类具有抵御抗生素胁迫能力、保持肠道菌群微生态平衡的益生菌制剂。
植物乳杆菌(Lactobacillusplantarum)为革兰氏阳性菌,与动物性乳酸菌相比,具有更强的耐酸和耐胆盐能力,且能在缺乏营养的恶劣环境下生存,所以在人体肠道存活率更高,定植能力更强[6]。植物乳杆菌的潜在益处包括保持肠道菌群、平衡调节免疫系统等[7]。靳志敏等[8]通过动物模型试验证实了植物乳杆菌对肠道内致病菌有一定的抑制作用,能在一定程度上调节肠道内菌群平衡。鉴于其自身的益生和生物学特性,植物乳杆菌被广泛应用于酸奶等发酵食品中,是食品工业中最通用的菌种之一,同时也存在于人体胃肠道中。抗生素残留、极端温度、pH、渗透压等外界环境的胁迫,均可能影响植物乳杆菌菌体细胞的生理状态和性质[9-10]。
近年来,国内外学者主要致力于研究致病菌在环丙沙星作用下的生理特性、抑菌特性、耐药机制等[11-14],而对于乳酸菌则主要围绕其耐环丙沙星的机制及耐药基因的水平转移进行研究[15-16]。除了陈霞等[17]探究了环丙沙星对嗜热链球菌生理特性的影响之外,国内外在环丙沙星对乳酸菌胁迫应激方面的研究未见报道。
本实验选用一株来源于人体肠道的植物乳杆菌作为目的菌株,使用一种氟喹诺酮类药物环丙沙星对其进行主动胁迫。实验组环丙沙星浓度的设置参照其药代动力学性质及我国规定的环丙沙星的ADI[18],设置实验组环丙沙星质量浓度为0.1、0.5、2.0 μg/mL,以不含环丙沙星作为空白对照,探究植物乳杆菌在环丙沙星胁迫下的应激反应,并考虑在适当剂量的环丙沙星胁迫下是否具有诱导其产品主动响应不良胁迫的能力,为开发有效肠道益生菌的制剂产品提供技术手段。
1 材料与方法
1.1 材料与仪器
植物乳杆菌(Lactobacillusplantarum)ZLC-18 保藏于东北农业大学教育部乳品科学重点实验室;MRS液体培养基 配制方法参照《乳品微生物学实验技术》;环丙沙星化学对照品 含量≥88.5%,购自北京博奥拓达科技有限公司;嵌二萘 纯度≥99%,广州伟伯科技有限公司;LIVE/DEAD®BacLightTM细菌活性检测试剂盒 美国赛默飞世尔科技公司;丙酮酸激酶(PK)、己糖激酶(HK)、乳酸脱氢酶(LDH)试剂盒 北京索莱宝科技有限公司;无水乙醇及其他试剂 均为国产分析纯。
SPX-150B Ⅲ生化培养箱 天津市泰斯特仪器有限公司;Smart SpecTM plus分光光度计 美国Bio-Rad公司;5804R低温冷冻离心机 德国Eppendorf公司;LDZX-50KBS型立式压力蒸汽灭菌器 上海申安医疗器械厂;XH-T型涡旋振荡器 金坛市医疗仪器厂;JY98-IIIN超声破碎仪 宁波新芝生物科技股份有限公司;EVOS FL Auto 2智能全自动荧光显微成像系统 美国赛默飞世尔科技公司;RF-5301PC荧光分光光度计 日本岛津公司;SU-8010场发射扫描电子显微镜 日本日立公司。
1.2 实验方法
1.2.1 菌种的活化与培养 将保存于-20 ℃的植物乳杆菌甘油冻存管取出,在室温中融化后按2%的接种量接入MRS液体培养基中,37 ℃培养12 h,传代2~3次,保证菌液中活菌数达1×109CFU/mL。
1.2.2 环丙沙胁迫下植物乳杆菌的存活率测定 收集对数生长末期的植物乳杆菌菌体,细胞经无菌PBS(0.2 moL/L,pH7.2~7.4)洗涤两次后,分别重悬于等体积且含不同质量浓度环丙沙星(0.1、0.5、2.0 μg/mL,以不含环丙沙星作对照)的MRS培养基中,胁迫处理0~4 h。胁迫后的菌悬液经生理盐水洗涤两次后重悬于等体积生理盐水中,稀释不同梯度后于MRS固体培养基上进行涂布。37 ℃培养48 h后计数。进行三次重复试验,每次试验三个平行样品。存活率按以下公式计算[19]。
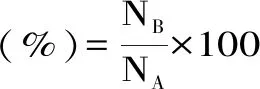
式中:NA为t小时未添加环丙沙星的活菌数;NB为环丙沙星胁迫处理t小时下的活菌数。
1.2.3 环丙沙星胁迫处理实验 离心(4000 r/min,10 min)收集生长至对数末期的植物乳杆菌菌体,用PBS清洗两次并重悬于等体积且含不同质量浓度环丙沙星(0.1、0.5、2.0 μg/mL,以不含环丙沙星作对照)的MRS液体培养基中,胁迫处理4 h,调至OD600=0.8,PBS清洗两次后,重悬于等体积PBS溶液中,混匀后得到菌悬液,作为待测样。
1.2.4 环丙沙星胁迫下植物乳杆菌细胞膜完整性的测定 使用The LIVE/DEAD BacLight Bacterial Viability Kits测定菌体细胞膜完整性。将一个A组份移液管(SYTO 9染料)和一个B组份移液管(PI染料)的内容物共同溶解于5 mL灭菌的去离子水中,即为LIVE/DEAD BacLight染色试剂混合物的2×储备溶液。将2×储备溶液的样品与等体积1.2.3制备得到的待测样混合。室温下充分混合并在黑暗条件下孵育15 min。在载玻片和18 mm方盖玻片之间滴加5 μL染色的细菌悬浮液,于荧光显微镜下观察[20]。
1.2.5 环丙沙星胁迫下植物乳杆菌细胞膜流动性的测定 细胞膜侧向扩散速率按照Aricha等[21]的方法进行,1.2.3制备得到的待测样取20 mL,用0.25%(V/V)的甲醛在37 ℃下固定30 min,菌体用0.2 mol/L的磷酸缓冲液(pH7.4,含0.25%甲醛)离心洗涤两次。菌体细胞于37 ℃下,用0.1~0.5 μmol/L嵌二萘标记40 min后,用荧光分光光度计测定其荧光强度。激发波长为335 nm,发射波长为373 nm(单体)和470 nm(二聚体),狭缝均为5 nm。根据荧光探针浓度和470 nm波长处荧光强度和373 nm波长处荧光强度的比值作图,斜率即为侧向扩散速率Ka。
1.2.6 环丙沙星胁迫对植物乳杆菌菌体形态的扫描电镜观察 将不同浓度环丙沙星胁迫处理4 h后的菌液,于4 ℃条件下、4000 r/min离心10 min,弃去上清液,收集菌体沉淀。将收集好的菌体沉淀置于4 ℃冰箱中并用2.5%的戊二醛(pH6.8)固定1.5 h以上,经0.1 moL/L磷酸盐缓冲液(pH6.8)冲洗三次后,分别用浓度为50%、70%、90%的乙醇脱水处理10 min,再用100%乙醇和叔丁醇混合液(1∶1)、纯叔丁醇分别置换15 min,然后将样品放入-20 ℃冰箱冷冻30 min,接着放入ES-2030(HITACHI)型冷冻干燥仪干燥4 h。最后经粘样、镀膜后,将处理好的样品放入样品盒中待检,在场发射扫描电镜下,观察环丙沙星胁迫前后菌体形态的变化[22]。
1.2.7 环丙沙星胁迫对丙酮酸激酶(PK)、己糖激酶(HK)、乳酸脱氢酶(LDH)活性的影响研究
1.2.7.1 环丙沙星反复胁迫处理实验 用0.5 μg/mL环丙沙星反复胁迫植物乳杆菌三次,胁迫方法同1.2.3。之后收集生长至对数末期的植物乳杆菌菌体,用PBS清洗两次后,重悬于含0.5 μg/mL环丙沙星的MRS液体培养基中,胁迫处理4 h,调至OD600=0.8,PBS清洗两次后重悬于等体积PBS溶液,混匀后得到菌悬液,作为待测样。
1.2.7.2 相关酶活性的测定 将1.2.3及1.2.7.1制备得到的待测样收集至离心管内,4 ℃、8000 r/min离心10 min后弃上清,调整细胞浓度为5×106CFU/mL,加入1 mL提取液,在冰浴条件下超声波破碎细胞(功率20%,超声3 s,间隔10 s,重复30次),4 ℃、8000 r/min离心10 min,取上清,置冰上用于相关酶活的测定,其中从1.2.3制备的待测样中提取的上清液用于丙酮酸激酶(PK)、己糖激酶(HK)、乳酸脱氢酶(LDH)的测定,从1.2.7.1制备的待测样中提取的上清液仅用于乳酸脱氢酶(LDH)的测定。参照考马斯亮蓝染色法测定蛋白质浓度[23]。丙酮酸激酶(PK)、己糖激酶(HK)、乳酸脱氢酶(LDH)的测定均使用北京索莱宝科技有限公司提供的相应试剂盒测定。
1.3 数据统计分析
采用Origin 8.0软件作图。所有试验重复三次,在SPSS 21.0里用One Way ANOVA进行数据方差的显著性差异分析,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 环丙沙星胁迫下植物乳杆菌的存活率
根据环丙沙星的药代动力学性质及我国规定的环丙沙星的ADI,本文实验组设置环丙沙星的质量浓度为0.1、0.5、2.0 μg/mL,这三个浓度涵盖了我国规定的环丙沙星的ADI可能到达人体结肠的量[24],所以选择上述浓度进行植物乳杆菌存活率测定实验。结果如图1所示,植物乳杆菌在不同浓度环丙沙星胁迫处理0~4 h期间,存活率整体呈下降趋势。0.1 μg/mL环丙沙星胁迫下,在0~2 h期间,菌体存活率下降幅度较大,而2~4 h间菌体存活率下降趋势逐渐趋于缓和,4 h时菌体存活率为62.14%;经0.5 μg/mL环丙沙星胁迫处理2 h时,与0.1 μg/mL环丙沙星胁迫相比,菌体存活率大幅度下降,2 h时其存活率下降了42.76%,2~4 h间菌体存活率下降幅度不大,4 h时菌体存活率为50.65%;经2.0 μg/mL环丙沙星胁迫1 h时,菌体存活率就下降了45.21%,表明高剂量组环丙沙星胁迫下,能迅速启动菌体细胞死亡,菌体生长受到了明显的抑制作用,在1~4 h间,菌体存活率小幅度下降后最终趋于平缓,4 h时菌体存活率仅为40.21%。同时可以看出,环丙沙星浓度增大,菌体存活率降低,即环丙沙星浓度越大,其对菌体的抑制作用越明显。
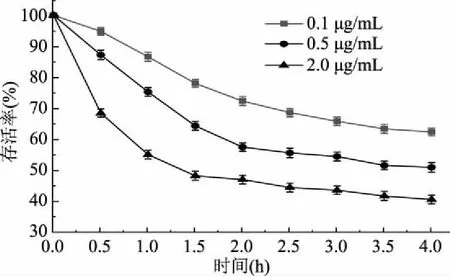
图1 环丙沙星胁迫下植物乳杆菌的存活率Fig.1 Survival rate of Lactobacillus plantarumin the presence of ciprofloxacin
环丙沙星胁迫植物乳杆菌期间表现出对菌体高效的抑制作用。环丙沙星在细菌细胞中具有2种酶靶标—DNA促旋酶和拓扑异构酶IV,其通过细胞膜进入菌体细胞后,通过干扰促旋酶和拓扑异构酶,诱导双链断裂,抑制DNA的再连接,诱导DNA损伤,最终启动了菌体细胞的死亡[25]。尽管环丙沙星是有效的杀菌抗生素,但它达不到完全灭菌作用。一部分植物乳杆菌因环丙沙星迅速死亡,但仍有一部分未死亡[26]。Smith等[27]研究了0~2.0 μg/mL环丙沙星对金黄色葡萄球菌的杀菌作用,发现随着环丙沙星浓度增大,金黄色葡萄球菌活菌数下降。这与本文中植物乳杆菌在不同浓度环丙沙星胁迫下存活率的变化基本吻合。
2.2 环丙沙星胁迫对植物乳杆菌细胞膜完整性的影响
细胞膜在细胞生长、代谢、能量传导和维持恒定的细胞内环境中发挥着重要作用。然而,它也是环境胁迫引起损害的主要目标。尽管胁迫条件导致膜脂质的组织、动态结构和功能发生变化,但是细胞质膜的完整性和有效性是维持细胞活力及其代谢活动的关键因素[28]。环丙沙星胁迫会改变菌体细胞壁结构中的脂质层和肽聚糖的含量,并破坏其结构,从而使环丙沙星进入细胞壁,进一步作用于菌体细胞膜[29]。
The LIVE/DEAD BacLight Bacterial Viability Kits可用于监测以细胞膜完整性为基础的菌群活性。被认为已死或将死的、细胞膜受损的细胞会染成红色,而细胞膜完好的细胞会染成绿色。环丙沙星胁迫处理对植物乳杆菌细胞膜完整性的影响结果如图2所示。结果表明:对照组(图2A)在观察视野里几乎全表现为绿色荧光,即对照组的细胞膜均保持完整,几乎未受到破坏;经质量浓度为0.1 μg/mL的环丙沙星处理4 h后的植物乳杆菌(图2B)在观察视野里有少数表现为红色荧光,大部分表现为绿色荧光,说明0.1 μg/mL的环丙沙星处理4 h时,对植物乳杆菌细胞膜有一定的破坏,但是破坏程度较小;经质量浓度为0.5 μg/mL的环丙沙星处理4 h后的植物乳杆菌(图2C)在观察视野里几乎一半呈现红色荧光,而另一半呈现绿色荧光,说明0.5 μg/mL的环丙沙星处理4 h时,对植物乳杆菌细胞膜的破坏程度较大;而经2.0 μg/mL的环丙沙星处理4 h后的植物乳杆菌(图2D)在观察视野里大部分表现为红色荧光,而仅有少部分表现为绿色荧光,说明2.0 μg/mL的环丙沙星处理4 h时对菌体细胞膜的完整性影响程度较其它浓度而言更为严重,即菌体细胞膜在2.0 μg/mL的环丙沙星处理4 h时受到了程度比较大的破坏。这一结果与胁迫处理后菌体的存活率结果基本一致。环丙沙星的杀菌机理之一就是能够破坏细菌细胞膜,使细胞内容物流失,因此,不论细菌处于增殖期还是静止期,都能迅速降低细菌活力[30]。所以随着环丙沙星浓度的增加,植物乳杆菌的细胞膜完整性受到的破坏程度随之增大。

图2 环丙沙星胁迫处理对植物乳杆菌细胞膜完整性的影响Fig.2 Effects of ciprofloxacin stress treatment on cell membrane integrity of Lactobacillus plantarum注:在EVOS FL Auto 2成像系统上使用彩色照相机和10×物镜采集图像;A表示未经环丙沙星处理;B表示经质量浓度为0.1 μg/mL的环丙沙星处理;C表示经质量浓度为0.5 μg/mL的环丙沙星处理;D表示经质量浓度为2.0 μg/mL的环丙沙星处理。
2.3 环丙沙星胁迫对植物乳杆菌细胞膜流动性的影响
不同浓度环丙沙星胁迫处理4 h时对植物乳杆菌细胞膜流动性的影响结果如图3所示。膜蛋白的运动方式主要分为侧向及旋转运动,本试验以嵌二萘为荧光探针,根据嵌二萘单体和激发态二聚体的荧光强度的比值来测定细胞膜的侧向扩散速率。由图3可以看出,当环丙沙星质量浓度为2.0 μg/mL时,菌体细胞侧向扩散速率极显著降低(P<0.01),与对照组相比降低了39.93%,细胞膜流动性极显著性降低;而0.1、0.5 μg/mL两组的细胞膜侧向扩散速率与对照组相比,下降不显著(P>0.05),表明细胞膜流动性下降不显著。由于环丙沙星胁迫处理植物乳杆菌时,菌体会改变细菌细胞膜流动性来调节膜脂质的组成,从而控制膜的稳态[31-32]。Bessa等[33]研究发现,亚抑制浓度的抗生素的存在不会显著改变金黄色葡萄球菌的膜流动性,但会略微影响大肠杆菌的膜流动性。实验结果表明,环丙沙星能够显著降低植物乳杆菌细胞膜流动性,环丙沙星作为环境应激物,诱导膜流动性发生变化。细胞膜的流动性对于细胞膜功能的正常行使是至关重要的,膜流动性的改变将会引起细胞膜功能的改变,例如细胞的物质运输、细胞识别、细胞免疫、细胞分化与信息转导等。膜流动性下降会引起黏度增加,导致运输功能下降,严重者可破坏膜结构,增大膜通透性,使内容物大量排出,引起细胞死亡。细胞膜上的酶活性与流动性也有很大关系,在一定范围内,膜的流动性降低不利于酶分子侧向扩散和旋转运动,使酶活性降低[34]。所以,研究环丙沙星对植物乳杆菌细胞膜流动性的影响,有利于了解环丙沙星对乳杆菌细胞膜功能或细胞功能的影响。

图3 环丙沙星胁迫处理对植物乳杆菌细胞膜流动性的影响Fig.3 Effects of ciprofloxacin stress treatment on cell membrane fluidity of Lactobacillus plantarum注:与对照组相比较,*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
2.4 环丙沙星胁迫下植物乳杆菌菌体形态的场发射扫描电镜结果
将处理好的样品放置于SU-8010场发射扫描电镜下观察(工作电压10 kV),放大倍数为30000×,选取有代表性的视野,观察结果如图4所示。由图4可以看出,不同浓度的环丙沙星胁迫下菌体形态差异明显。未经环丙沙星处理过的植物乳杆菌外观呈典型的杆状直线型,两端以圆弧形收尾,相互交替排列,菌体饱满无缺陷。经质量浓度为0.1 μg/mL环丙沙星处理4 h后,菌体出现凹陷、干扁、塌缩的现象,排列杂乱,少数菌体细胞表面出现破裂,细胞内容物泄露。经0.5 μg/mL环丙沙星处理4 h后,菌体长度缩短,排列无序,细胞表面破裂的菌体数量增加。经2.0 μg/mL环丙沙星处理4 h后,植物乳杆菌细胞形态受损程度最大。菌体长度的缩短程度最大,大部分菌体表面破裂,菌体内容物外泄。试验结果表明,环丙沙星胁迫明显改变了植物乳杆菌的菌体形态,严重时可造成细胞质外泄,最终导致细胞死亡;且菌体改变和受损的程度与环丙沙星浓度呈正相关。

表1 环丙沙星胁迫对植物乳杆菌糖代谢关键酶活力的影响(U/mg prot)Table 1 Effect of ciprofloxacin stress on key enzyme activity of glucose metabolism of Lactobacillus plantarum(U/mg prot)
注:与对照组相比较,*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。

图4 环丙沙星胁迫处理下植物乳杆菌的扫描电镜图Fig.4 Scanning electron micrograph ofLactobacillus plantarum treated with ciprofloxacin stress注:放大倍数:30000×;图A表示未经环丙沙星处理;图B表示经质量浓度为0.1 μg/mL 环丙沙星处理4 h;图C表示经质量浓度为0.5 μg/mL环丙沙星处理4 h;图D表示经质量浓度为2.0 μg/mL环丙沙星处理4 h。
环丙沙星通过抑制细菌DNA的合成发挥其抑菌作用。环丙沙星作用下,菌体内形成旋转酶-DNA-环丙沙星复合物,菌体复制系统受到抑制,此时细胞会触发应激反应机制,也被称为SOS反应[35]。Ysern等[36]已经指出,一些抗生素,例如氟喹诺酮类,可作为SOS反应的有效诱导剂,诱导细菌中的SOS反应增加菌体突变的频率,而菌体发生突变将有利于其生存。另外,环丙沙星诱导的SOS反应可能造成细胞内物质的渗漏。有研究表明,即使环丙沙星作用的主要目标位于不影响细胞壁合成的位点,也会破坏细菌表面、改变菌体形态[37]。Elliott等[38]研究发现,大肠杆菌暴露于浓度为1~50 μg/mL的环丙沙星或诺氟沙星后,细胞壁在30 min内发生丝状化,随后细菌的细胞壁发生破裂。借助场发射扫描电镜真实形象地表达植物乳杆菌在环丙沙星胁迫下菌体形态的变化,能够为环丙沙星胁迫下植物乳杆菌的应激机理的研究提供一定的依据。
2.5 环丙沙星胁迫对植物乳杆菌糖代谢关键酶活性的影响
氟喹诺酮类抗生素胁迫会对微生物产生不利影响,了解菌体通过改变葡萄糖代谢酶活性对环丙沙星胁迫条件作出的应激反应是有必要的。由表1可以看出,就己糖激酶而言,2.0 μg/mL环丙沙星处理4 h后,酶活极显著下降(P<0.01),为(3.29±0.63) U,而0.1、0.5 μg/mL两组处理后,其酶活与对照组相比下降程度不显著(P>0.05),这一结果表明己糖激酶不是环丙沙星胁迫引起菌体应激的主要代谢酶。
与对照组相比,植物乳杆菌在0.1、0.5、2.0 μg/mL的环丙沙星胁迫4 h后,丙酮酸激酶活力均极显著下降P<0.01),表明环丙沙星胁迫4 h后对丙酮酸激酶活力影响效果极显著(P<0.01),且酶活力下降程度与环丙沙星浓度呈正相关,活力分别下降了24.78%、36.56%、48.46%,这一结果说明丙酮酸激酶是环丙沙星胁迫下菌体产生应激的关键代谢酶。己糖激酶和丙酮酸激酶作为菌体糖酵解中催化不可逆反应的关键酶,其活性受细胞能荷调节。环丙沙星胁迫下会使菌体细胞内产生应激反应,可能使得胞内能荷升高,从而抑制己糖激酶和丙酮酸激酶的活性[39];环丙沙星胁迫可能造成的胞内丙酮酸激酶磷酸化也可能是丙酮酸激酶活性下降的另一种原因[40]。
对照组中乳酸脱氢酶酶活约为(0.069±0.002) U,在0.1 μg/mL环丙沙星处理4 h后,酶活下降不显著(P>0.05),说明低剂量组环丙沙星对菌体乳酸脱氢酶影响不大,该酶在低剂量环丙沙星胁迫下处于稳定状态;在2.0 μg/mL环丙沙星处理4 h后,酶活下降极显著(P<0.01),降低了约53.62%,说明高剂量组环丙沙星对植物乳杆菌乳糖代谢具有抑制作用;而加入0.5 μg/mL环丙沙星胁迫4 h后,乳酸脱氢酶活力反而增加,酶活为(0.081±0.006) U/mg prot(P<0.01),说明中剂量组环丙沙星会对菌体产生相应的胁迫应激。进一步用0.5 μg/mL环丙沙星反复胁迫菌体,菌体乳酸脱氢酶的酶活为(0.126±0.004) U/mg prot(表2),影响极显著(P<0.01)。在环丙沙星胁迫下,菌体可能通过调节自身中mRNA降解、基因表达、葡萄糖转运和代谢水平来影响参与葡萄糖代谢的酶[41-42],诱导植物乳杆菌乳酸脱氢酶酶活力增大。

表2 0.5 μg/mL环丙沙星反复胁迫对植物乳杆菌乳酸脱氢酶活力的影响(U/mg prot)Table 2 Effects of repeated stress of 0.5 μg/mL ciprofloxacin on the activity of lactate dehydrogenase in Lactobacillus plantarum(U/mg prot)
注:与未经反复胁迫组相比较,*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
环丙沙星胁迫下菌体糖代谢关键酶活力下降,使得菌体对葡萄糖利用率降低,造成菌体有氧代谢受到抑制,进而改变糖代谢和能量通量,同时改变菌体的生长速率,使碳源代谢适应新环境[43];从另一个角度而言,环丙沙星胁迫造成细胞膜完整性受损,可能造成位于胞液中的己糖激酶、丙酮酸激酶及乳酸脱氢酶泄露,导致其酶活力发生变化[44]。上述结果为深入研究环丙沙星胁迫下菌体糖代谢关键酶的变化情况提供了重要参考,也为乳酸菌在环丙沙星胁迫下的代谢机制的研究提供了思路。
3 结论
氟喹诺酮类药物环丙沙星会严重破坏菌体生长,随着其质量浓度增大,菌体存活率依次降低,经质量浓度为2.0 μg/mL的环丙沙星胁迫后乳杆菌存活率仅为40.21%,活菌数量剧减将使菌体群体反应效应减弱,直接影响菌体定植以及发挥相应的益生功能;环丙沙星胁迫可改变植物乳杆菌细胞结构,破坏细胞膜完整性,降低细胞膜流动性,阻滞细胞代谢;通过测定不同质量浓度环丙沙星胁迫后菌体葡萄糖代谢关键酶活,发现菌体主能量代谢路径中的己糖激酶、丙酮酸激酶均出现不同程度的下降,而只有乳酸脱氢酶在质量浓度为0.5 μg/mL的环丙沙星胁迫下酶活力升高,反复用质量浓度为0.5 μg/mL的环丙沙星胁迫植物乳杆菌后,发现菌体乳酸脱氢酶酶活不降反升,究其原因为植物乳杆菌经该浓度环丙沙星主动胁迫后,为增加能量代谢维持菌体存活,会产生应激,通过自身调节,诱导植物乳杆菌乳酸脱氢酶酶活力增大以保护菌体。本研究选取的氟喹诺酮类药物环丙沙星浓度涵盖了我国规定的环丙沙星的ADI可能到达人体结肠的量,同时实验菌株为来源于人肠道的植物乳杆菌,因此,本文研究结果有助于肠道益生菌制剂的研发,在缓解抗生素胁迫引起的肠道应激方面具有实践及应用价值。

