杨柳田头菇YAAS711菌株F1子代胞外酶活性分析
周会明,赵永昌,柴红梅,张焱珍
杨柳田头菇YAAS711菌株F1子代胞外酶活性分析
周会明1,2,赵永昌2,柴红梅2,张焱珍1,2
(1滇西科技师范学院生物技术与工程学院,云南临沧 677000;2云南省农业科学院生物技术与种质资源研究所,昆明 650205)
【】探究杨柳田头菇YAAS711菌株的单孢菌株及其自交个体的胞外酶活性变化规律,为其遗传育种提供理论依据。以杨柳田头菇YAAS711的18个单核体与22个自交双核体为试验材料,分别采用3, 5-二硝基水杨酸(DNS)法、福林法、愈创木酚法等测定羧甲基纤维素酶、滤纸纤维素酶、β-葡萄糖苷酶、半纤维素酶、淀粉酶、蛋白酶、漆酶、多酚氧化酶、过氧化物酶9种胞外酶活性,并对这9种胞外酶与子代生长速度、极性和交配因子进行相关性分析。单核体和双核体绝大多数都具有较高的淀粉酶、滤纸纤维素酶、半纤维素酶、β-葡萄糖苷酶、羧甲基纤维素酶及蛋白酶活性,过氧化物酶、多酚氧化酶及漆酶活性却较低。9种胞外酶平均活力与单核体和双核体的菌丝生长速度均存在一定程度的相关性,除部分类型Ⅱ单核体外,菌丝生长速度较快的单核体具有较高的胞外酶活性;反之,胞外酶活性较低。相比单核体菌丝生长速度“快-快”的组合,单核体菌丝生长速度“快-慢”的组合除半纤维素酶、蛋白酶和多酚氧化酶外,其他胞外酶活性都较高。具有类型Ⅱ单核体参与形成的双合体胞外酶活性却各不相同且无规律。多酚氧化酶对单核体菌丝生长速度的间接影响大于漆酶,但漆酶对单核体菌丝生长速度的综合作用最大;胞外酶之间的协同作用对双核体菌丝生长速度影响较小,其中漆酶对其菌丝生长速度直接作用最大。多重比较结果显示,在显著水平为0.05上,极性对胞外酶平均活力的影响大于交配因子。单核体菌丝生长速度与本极性异常和杨柳田头菇YAAS711子代个体胞外酶活性差异存在显著相关性,除部分类型Ⅱ单核体和双核体外,类型Ⅰ菌株胞外酶活性具有相同的规律。单核体菌丝生长速度、极性、胞外酶三者之间具有一定的相关性,但交配因子与胞外酶没有直接相关性。
杨柳田头菇;自交后代;胞外酶活性;单核体;双核体
0 引言
【研究意义】杨柳田头菇()隶属于真菌界、担子菌亚门、伞菌纲、伞菌亚纲、伞菌目、球盖菇科、田头菇属[1-2],其生长于亚热带地区柳树上,具有外观美、肉质嫩、味道鲜、口感佳等优点,为中国云南省特有的珍稀食用菌。虽然该菌人工栽培出菇,但农艺性状较差,由于资源的稀缺性及遗传育种相关的基础研究不多,开展杨柳田头菇YAAS711菌株F1子代胞外酶活性分析研究对杂交亲本选择具有指导意义。【前人研究进展】目前,对杨柳田头菇的一些研究主要集中在形态观察[3-4]、分子生物学鉴定[5]、菌株驯化[6]、生物活性物质分离[7-9]、转录组比较[10]、交配基因分析[11]、交配型测定[12]、品种选育[13]等方面,但缺少必要的生理生化基础研究。杨柳田头菇市场需求较大,人工种植比较容易,但从野生子实体中分离出来的菌株,因其农艺性状不稳定,无法应用于商业化生产用种,选育杂交品种成为其推广的当务之急。亲本的生理特性对杂交后代的影响极为重要,该研究为品种的驯化和优良菌株的选择提供足够的理论支持。胞外酶是一类产生于细胞内而在细胞外发挥作用的酶,其活性大小与食用菌种类和培养基质密切相关[14]。食用菌在整个生长发育阶段可向培养基质中分泌多种胞外酶,这些酶可将培养基中的大分子物质(纤维素、半纤维素、木质素、淀粉、果胶、蛋白质等)水解成小分子物质供菌丝吸收和利用[15]。通过对食用菌胞外酶活性的研究,可以了解各种食用菌在不同发育阶段的胞外酶分泌特点、活性大小及动态变化趋势[16],推测不同食用菌对培养基质中木质纤维素、淀粉等大分子营养成分的降解动态,对提高其栽培技术具有重要意义。目前在榆黄蘑()[17]、黄孢原毛平革菌()[18]、雅致栓孔菌()[19]、平菇(spp.)[20]、巴尔喀什蘑菇()[21]、蜜环菌(spp.)[22]、玉木耳()[23]、红托竹荪()[24]、茶树菇()[25]、白灵侧耳()[26]等大型真菌的胞外酶活性已开展了研究,上述食用菌胞外酶与其生长发育密切相关。【本研究切入点】杂交育种的难点是亲本选择,多数的杂交育种研究都是随机选择,不仅工作量大,也具有较大的盲目性。在前期的研究中发现单孢菌株群体在生长速度上有较大的差异,组合配对的双核体生长与单核体存在某种关系,一般而言,菌丝的生长速度与基质利用(即分泌胞外酶降解基质)相关。有关双核体胞外酶与两单核体亲本之间的关系研究未见报道,探索单核体交配极性、交配因子和胞外酶活性对形成的双核体胞外酶活性的影响,将为杂交育种的亲本定向选择奠定基础。杨柳田头菇不同极性单核菌株的胞外酶活性至今尚未报道,笔者对该菇的前期研究工作表明,菌株YAAS711分离的单核体在直径为90 mm的培养皿YPD培养基上培养,根据其生长速度分为生长快型(F:2.2—3.5 mm∙d-1)和生长慢型(S:1.2—1.4 mm∙d-1)两类,单孢菌株群体中每种极性都有生长速度快慢之分,生长速度极慢的单核菌株几乎集中在一种交配型AyBy中[12]。按生长速度将每种极性中的单孢菌株分为两类,数量多的为I型菌株(包括生长速度快(F)的AxBx、AxBy、AyBx和生长速度慢(S)的AyBy),数量少的为II型菌株(包括生长速度慢()的AxBx、AxBy、AyBx和生长速度快()的AyBy)。【拟解决的关键问题】以I型菌株中F×F和F×S组合为对照,对II型中或单孢菌株进行组合,共形成6种双核体组合,对18个单核体与22个双核体的9种胞外酶活性进行测定与分析,找出杨柳田头菇单核体与双核体胞外酶活性变化规律。
1 材料与方法
1.1 单核体与双核体
杨柳田头菇菌株YAAS711由采集于云南省香格里拉市的野生子实体分离得到,试验用的成熟子实体在云南省农业科学院生物技术与种质资源研究所实验室通过袋栽法获得。无菌条件下,将新鲜子实体置于灭过菌的带有硫酸纸的培养皿内收集担孢子,稀释涂布法制备单孢菌株,单核体配对获得双核菌丝体(表1)[12,27]。不同菌株的9种胞外酶活性研究于2018年9月在滇西科技师范学院生物技术与工程学院实验室开展。
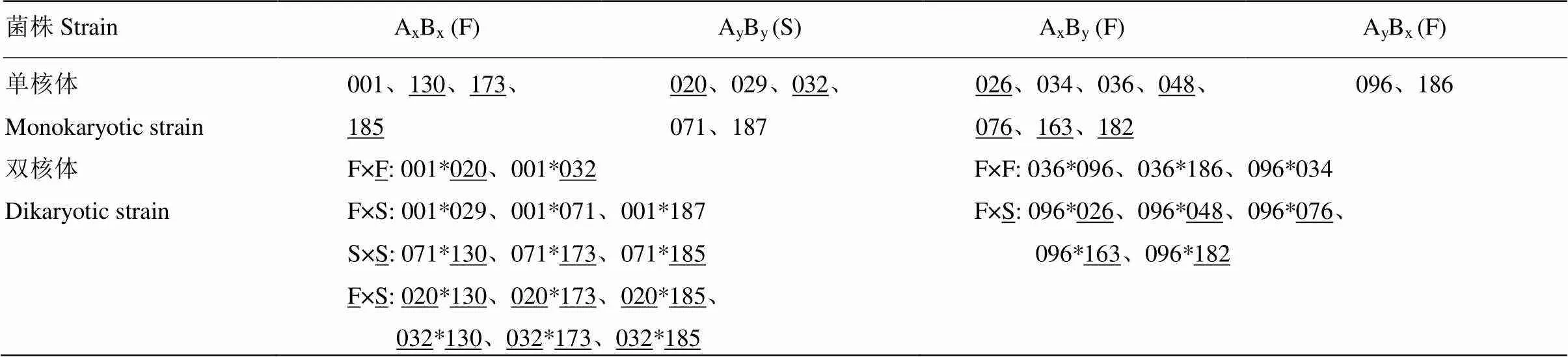
表1 试验菌株
“F”代表单孢生长速度较快的极性,“S”代表单孢生长速度较慢的极性,“_”代表类型Ⅱ单核体,其他的为类型Ⅰ单核体,“×”代表杂交;“*”代表两个不同菌株单核体形成杂合体的连接符,*前后分别为杂交配对亲本单孢编号
“F” represents the polarity with a faster growth rate of single spore, “S” represents the polarity with a slower growth rate of single spore, “_” represents the type II monokaryons, others are type I monokaryons, “×” represents hybridization, “*” represents connectors of monokaryons formation of a hybrid for two different strains, * before and after is strain No. of single spore of hybrid pairing parents
1.2 菌株培养与粗酶液制备
将已活化的单核体与双核体菌株接种于YPD(0.2%蛋白胨、0.2%酵母膏、2%葡萄糖、1.5%琼脂)固体培养基,在25℃条件下培养,平皿生长速率法测定生长速度[12]。将单核体与双核体菌株接种于YPD固体培养基,在(24±1)℃下黑暗培养15 d,用直径7 mm打孔器处理培养菌株边缘打孔,挑取1块接种于含120 mL YPD液体培养液(除不含琼脂外,成分同固体)的250 mL三角瓶中,3次重复,置于旋转式摇床,100 r/min、(25±1)℃下黑暗培养10 d。过滤(200目三层尼龙纱布),取滤液,离心(4℃、4 000 r/min、20 min),上清液即为粗酶液,置于-20℃下保存,用于胞外酶测定[28]。
1.3 酶活测定
40个子代个体是单独一个处理下的酶活测试,羧甲基纤维素酶、滤纸纤维素酶、β-葡糖糖苷酶、半纤维素酶以及淀粉酶的测定采用二硝基水杨酸(DNS)法[29],所有酶活单位用U表示。
1.3.1 羧甲基纤维素酶 以羧甲基纤维素钠为底物,用pH 4.6、0.1 mol∙L-1柠檬酸缓冲液配制0.5%羧甲基纤维素(CMC)溶液。向试管(3支样品、3支对照)中加入0.5%的CMC-Na溶液0.75 mL,样品管加粗酶液0.125 mL,50℃恒温水浴保温30 min,取出后立即加入DNS试剂0.75 mL(对照管加入DNS后再加入0.125 mL酶液),沸水浴10 min,取出立即冷却,加蒸馏水25 mL,混匀,于520 nm测OD值,依据葡萄糖标准曲线(图1-A)求得还原糖量[30]。1 U=1 mg葡萄糖∙(30 min)-1∙mL-1发酵液(即1 mL发酵液中的酶量与底物作用30 min释放出l mg葡萄糖为一个活力单位)。
1.3.2 滤纸纤维素酶 以一层滤纸(规格:1 cm×6 cm,新华1号)为底物,向试管(3支样品、3支对照)中加入一条新华1号滤纸,而后加入0.1 mol∙ L-1柠檬酸缓冲液(pH 4.6)0.5 mL,再往样品管中加入粗酶液0.125 mL,置于50℃保温60 min,取出后,立即加入DNS试剂1.5 mL(对照管加入DNS后再加入0.125 mL酶液),沸水浴10 min,取出冷却后加蒸馏水至25 mL,混匀,然后于520 nm处测OD值,依据葡萄糖标准曲线求得还原糖量[31]。1 U=1 mg葡萄糖∙(60 min)-1∙mL-1发酵液(即1 mL发酵液中的酶量与底物作用60 min释放出l mg葡萄糖为一个活力单位)。
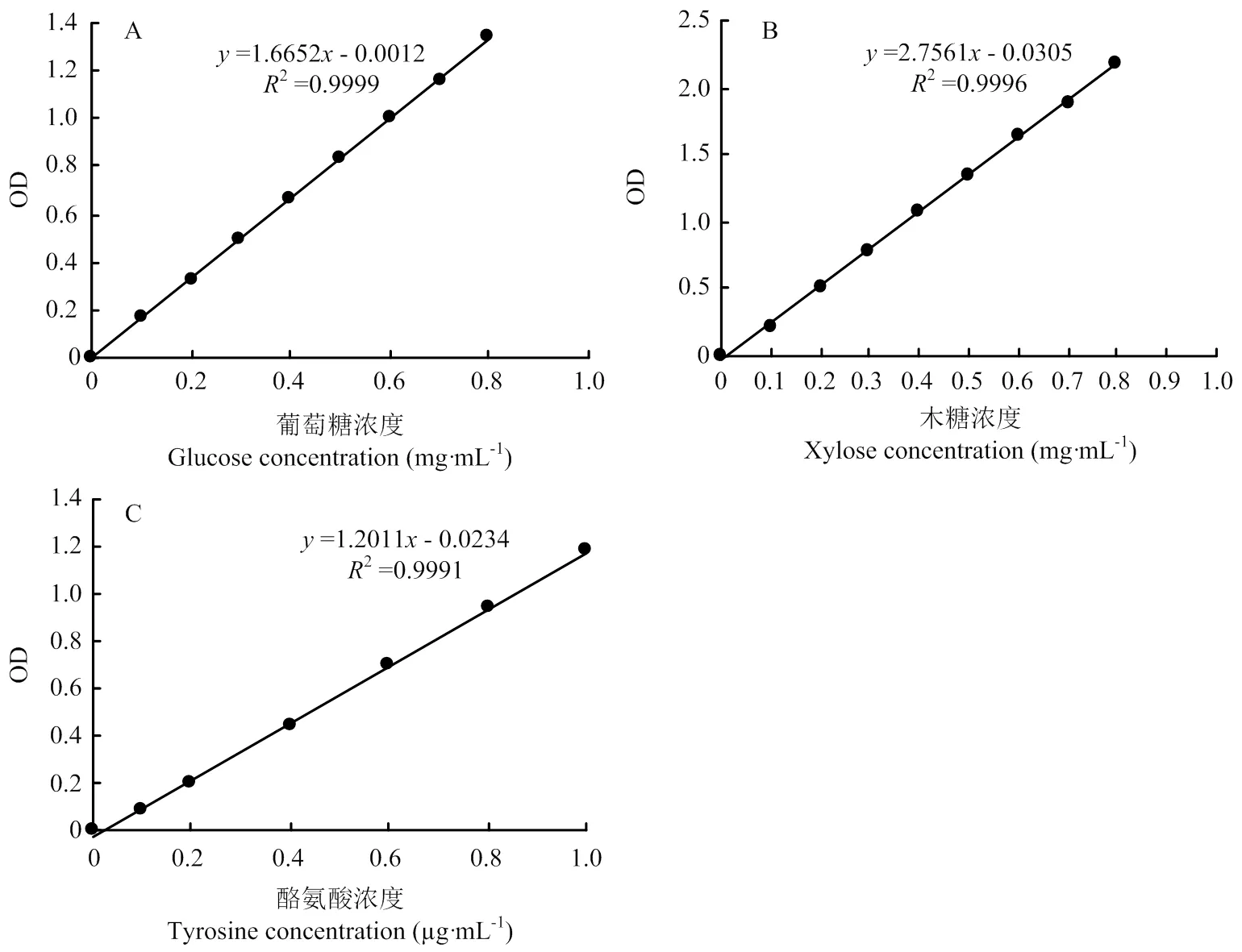
A:葡萄糖标准曲线;B:木糖标准曲线;C:酪氨酸标准曲线A: Glucose standard curve; B: Xylose standard curve; C: Tyrosine standard curve
1.3.3 β-葡糖糖苷酶 以纤维二糖为底物,向试管(3支样品、3支对照)中加入0.2%的纤维二糖0.5 mL,样品管加入粗酶液0.075 mL,50℃恒温水浴保温30 min,取出后立即加入DNS试剂0.75 mL(对照管加入DNS后再加入0.075 mL酶液),沸水浴10 min,取出立即冷却,加蒸馏水15 mL,摇匀,于520 nm测OD值,依据葡萄糖标准曲线求得还原糖量[32]。1 U=1 mg葡萄糖∙(30 min)-1∙mL-1发酵液(即1 mL发酵液中的酶量与底物作用30 min释放出l mg葡萄糖为一个活力单位)。
1.3.4 半纤维素酶 以木聚糖为底物,用pH 4.6、0.2 mol∙L-1的乙酸缓冲液配制0.5%木聚糖溶液。向试管中(3支样品、3支对照)加入0.5%的木聚糖0.75 mL,样品管加粗酶液0.05 mL,50℃恒温水浴保温30 min,取出立即加入DNS试剂0.75 mL(对照管加入DNS后再加0.05 mL酶液),沸水浴10 min,取出立即冷却,加蒸馏水10 mL,摇匀,于520 nm测OD值。依据木糖标准曲线(图1-B)求还原糖量[33]。1 U=1 mg木糖∙(30 min)-1∙mL-1发酵液(即1 mL发酵液中的酶量与底物作用30 min释放出l mg木糖为一个活力单位)。
1.3.5 淀粉酶 以可溶性淀粉为底物,向试管(3支样品、3支对照)中加入0.5%的可溶性淀粉溶液0.5 mL,样品管加入粗酶液0.05 mL,混匀,38℃恒温水浴保温30 min,取出立即加入DNS试剂0.75 mL(对照管加入DNS后再加入0.05 mL酶液),沸水浴10 min,取出立即冷却,加蒸馏水10 mL,摇匀,于520 nm测OD值,依据葡萄糖标准曲线求得还原糖量[34]。1 U=1 mg葡萄糖∙(30 min)-1∙mL-1发酵液(即1 mL发酵液中的酶量与底物作用30 min释放出l mg葡萄糖为一个活力单位)。
1.3.6 蛋白酶 以酪蛋白为底物,向试管中(3支样品、3支对照)加入2%酪蛋白(预热至30℃)1 mL,样品管加入稀释10倍的粗酶液0.5 mL摇匀,30℃保温10 min,加入10%三氯乙酸l mL中止反应,再吸取粗酶液0.5 mL加入对照管中,摇匀,25℃静置30 min,离心(4℃、3 000 r/min)2 min。另取试管(3支样品,3支对照),然后分别加入0.5 mL上清测定液、对照液,分别加入2.5 mL的0.4 mol∙L-1碳酸钠溶液,最后加入0.5 mL福林-酚试剂,摇匀,30℃水浴保温30 min,取出后置于分光光度计650 nm处测OD值,依酪氨酸标准曲线(图1-C)求值[35]。1 U=1 µg酪氨酸∙(30 min)-1∙mL-1发酵液(即1 mL发酵液中的酶量与底物作用30 min释放出l µg酪氨酸为一个活力单位)。
1.3.7 木质素酶 木质素酶主要包括漆酶、多酚氧化酶及过氧化物酶,参考Egger[36]、Pointing[37]、Sık[38]等的方法测定。酶活性定义:1 U=ΔOD∙(30 min)-1∙mL-1发酵液,即1 mL发酵液中的酶量每分钟使OD值改变0.01为一个活力单位。
1.3.7.1 漆酶 向试管中(3支样品、3支对照)加入3.36 mmol∙L-1邻联甲苯胺0.5 mL作为底物,加入0.2 mol∙L-1乙酸缓冲液(pH 4.6)3 mL,样品管再加入0.4 mL酶液,对照管中加入煮沸10 min的粗酶液0.4 mL,置28℃恒温水浴下反应30 min,取出后立即于600 nm处测OD值。
1.3.7.2 多酚氧化酶 向试管中(3支样品、3支对照)加入0.1 mmol∙L-1的邻苯二酚2.0 mL和0.05 mol∙L-1磷酸缓冲液(pH=6.0)2.0 mL,样品管再加入粗酶液0.4 mL,对照管中加入煮沸10 min的粗酶液0.4 mL,28℃恒温水浴保温30 min,取出后立即于400 nm处测0D值。
1.3.7.3 过氧化物酶 向3支样品管加入粗酶液0.4 mL,3支对照管中加入煮沸10 min的粗酶液0.4 mL,再分别加入过氧化物反应混合物(取愈创木酚0.019 mL,过氧化氢0.028 mL,pH 6.0的0.2 mol∙L-1磷酸缓冲液100 mL混合)3.0 mL,倒入比色皿立即计时30 min,测定470 nm的OD值。
1.4 统计分析
活性值的测定均为3次重复,采用SPSS 19.0 统计软件对所有数据进行分析[39]。
2 结果
2.1 杨柳田头菇不同单核体的菌丝生长速度及其9种胞外酶活性分析
通过上述方法测定杨柳田头菇不同单核体的菌丝生长速度和胞外酶活性。多重比较(Duncan法)结果表明,不同的单核体其菌丝生长速度与9种胞外酶活性均存在较大的差异,在显著水平为0.05上各自均表现出不同程度的显著差异(表2)。大部分菌丝生长速度较快的单核体的胞外酶活性也较高,反之,胞外酶活性较低;但少数类型Ⅱ单核体如、及等却出现菌丝生长速度与大部分胞外酶活性成反比的现象。同时,除类型Ⅱ的单核体和的羧甲基纤维素酶外,所有单核体的淀粉酶、滤纸纤维素酶、半纤维素酶、β-葡糖糖苷酶、羧甲基纤维素酶及蛋白酶比过氧化物酶、多酚氧化酶、漆酶的活性高。因此,单核体生长发育阶段,淀粉、纤维素、半纤维素及蛋白质是其菌丝通过胞外酶降解并吸收利用的主要大分子物质,对木质素的要求较少。
2.2 杨柳田头菇不同双核体的菌丝生长速度及其9种胞外酶活性分析
双核体的菌丝生长速度和胞外酶活性多重比较(Duncan法)结果表明,不同类型的双核体其菌丝生长速度与9种胞外酶活性均存在较大的差异(<0.05)(表3)。对于类型Ⅰ单核体组合所形成的双核体来说,单核体菌丝生长速度“快-慢”组合与“快-快”组合相比,前者除半纤维素酶、蛋白酶和多酚氧化酶外,其他胞外酶活性都较高,具有类型Ⅱ单核体参与形成的双核体的胞外酶活性却各不相同且无规律,一部分双核体(如:*、096*)胞外酶活性表现较高,另一部分双核体(如:096*、*)胞外酶活性却较低。总之,在22个双核体中,组合编号为001*029、096*、*等的胞外酶活性较高,而组合编号为036*096、071*、071*等胞外酶活性较低。同时,除部分双核体蛋白酶(001*029、001*071、001*187、*和096*)、半纤维素酶(*和*)和-葡萄糖苷酶(071*和096*)外,所有双核体的淀粉酶、滤纸纤维素酶、半纤维素酶、β-葡糖糖苷酶、羧甲基纤维素酶及蛋白酶比过氧化物酶、多酚氧化酶、漆酶的活性高。因此,双核体生长发育阶段,对大分子物质的需求与单核体相似。
2.3 单核体菌丝生长速度与9种胞外酶活性之间的相关性分析及通径分析
为分析不同胞外酶活力大小与杨柳田头菇菌丝生长速度的关系,对18个单核体的菌丝生长速度及其9种胞外酶平均活力进行相关性分析及通径分析[40]。相关性分析结果表明(表4),所测定的胞外酶平均活力除滤纸纤维素酶、半纤维素酶、过氧化物酶外,其余与单核体菌丝生长速度呈正相关;其中单核体的菌丝生长速度与漆酶、多酚氧化酶、蛋白酶的平均酶活力呈极显著正相关(<0.01),与淀粉酶、β-葡萄糖苷酶的平均酶活力呈显著正相关(<0.05)。因此,单核体的菌丝生长速度与9种胞外酶平均活力存在着一定程度的相关性。
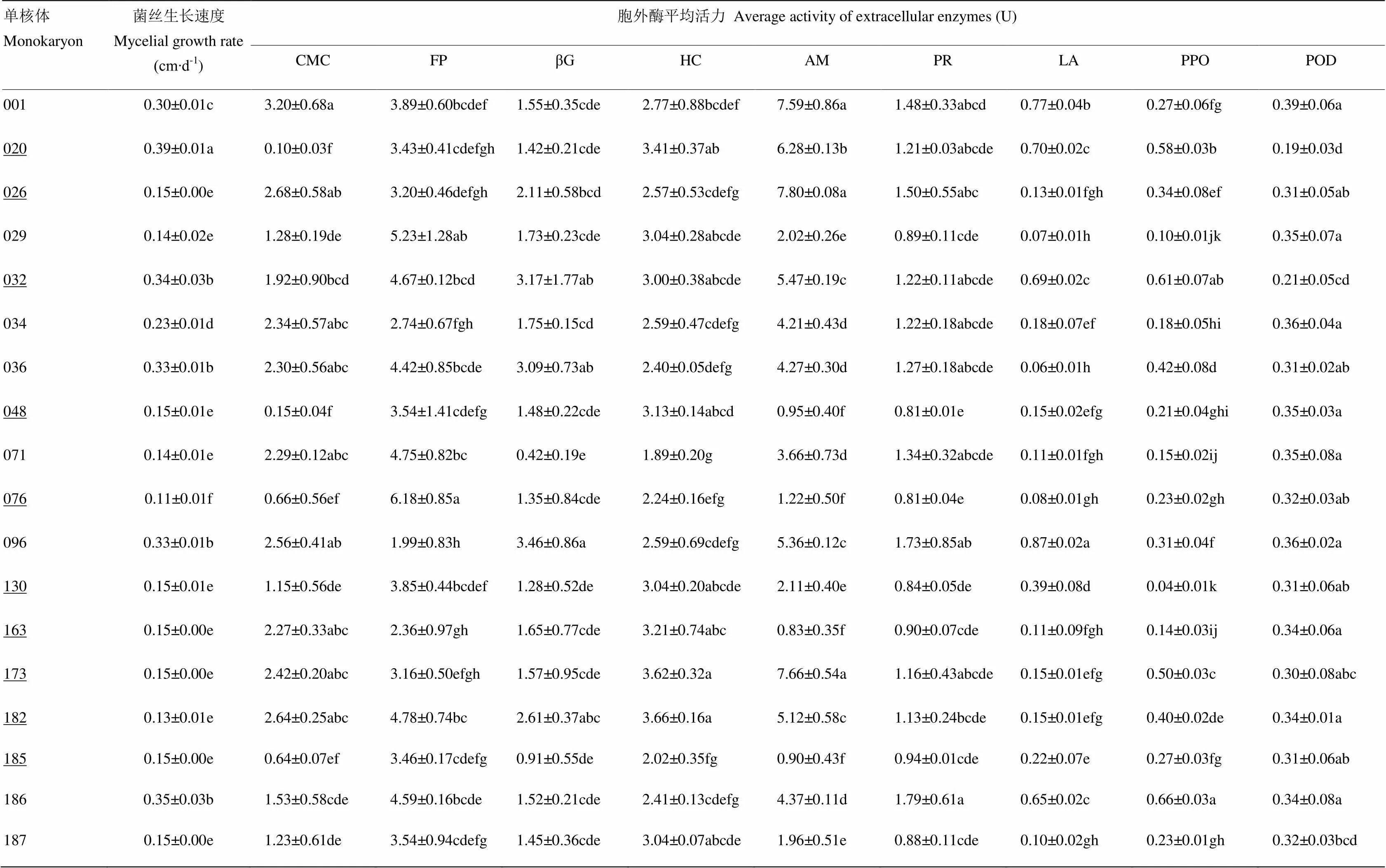
表2 杨柳田头菇不同单核体的菌丝生长速度与胞外酶平均活力的差异
CMC:羧甲基纤维素酶(CMCase);FP:滤纸纤维素酶(Filter paper cellulose);βG:-葡萄糖苷酶(-glucanase);HC:半纤维素酶(Hemieetlutase);AM:淀粉酶(Amylase);PR:蛋白酶(Protease);LA:漆酶(Laccase);PPO:多酚氧化酶(Polyphenolase);POD:过氧化物酶(Peroxidase)。同列数字后不同小写字母表示在0.05水平有显著差异。下同 Different small letters behind the data in the same column mean significant difference at 0.05 level. The same as below

表3 杨柳田头菇不同双核体的菌丝生长速度与胞外酶平均活力的差异

表4 菌丝生长速度及其胞外酶平均活力的相关系数
“*”代表显著相关(<0.05);“**”代表极显著相关(<0.01)。下同
“*” represents the significant correlation (<0.05), “**” represents the highly significant correlation (<0.01). The same as below
上述相关性分析只能表明胞外酶活力与单核体菌丝生长速度之间的直接关系,但不同胞外酶之间相互作用对其影响没有直观表现。因此,需在相关性分析的基础上进行通径分析,通过逐步回归分析法,把胞外酶活力与单核体菌丝生长速度之间的相关性分解为直接作用和间接作用,筛选出与单核体菌丝生长速度较为密切的胞外酶种类。
以单核体菌丝生长速度为因变量Y,羧甲基纤维素酶、滤纸纤维素酶、β-葡萄糖苷酶、HC、半纤维素酶、淀粉酶、蛋白酶、漆酶、多酚氧化酶和过氧化物酶分别为自变量X1、X2、X3、X4、X5、X6、X7、X8和X9。采取多元线性回归分析法,剔除偏回归系数不显著的自变量,建立Y的最优多元回归方程为:=0.086+0.2057+0.2028(=20.136,=0.000<0.01),多元线形回归方程的F检验达到极显著,进一步做通径分析。
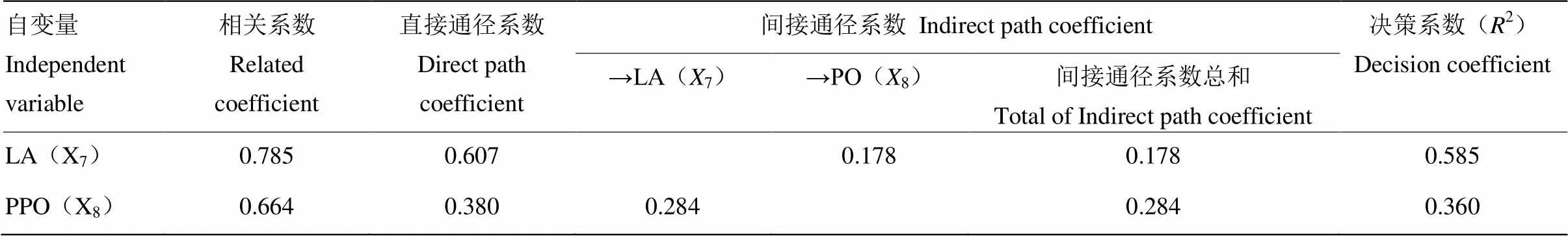
表5 以菌丝生长速度为因变量的通径分析
“→”表示通过该酶对Y产生间接作用。“→”means that the enzyme has an indirect effect on Y
通径分析结果表明(表5),在2个自变量与Y的多元线形回归方程中,直接通径作用的关联程度为X7>X8,间接通径的关联程度为X8>X7,决策系数的大小为X7>X8。因此,X8通过X7对Y的间接作用大于X7通过X8对Y的间接作用(0.284>0.178),说明多酚氧化酶对单核体的菌丝生长速度的间接影响大于漆酶,但漆酶对单核体的菌丝生长速度的综合作用(包括直接作用以及与其他胞外酶的协同作用)最大(2=0.585)。同时,多酚氧化酶与漆酶共同作用参与木质素的降解,因此,在杨柳田头菇单核体的生长发育过程中,木质素对其影响较大。
2.4 双核体菌丝生长速度与9种胞外酶活性之间的相关性分析及通径分析
双核体的菌丝生长速度与胞外酶的相关性分析表明(表6),所测定的胞外酶平均活力除多酚氧化酶与过氧化物酶外,其余与其菌丝生长速度呈正相关。其中双核体的菌丝生长速度与漆酶、淀粉酶、羧甲基纤维素酶的平均酶活力呈极显著正相关(<0.01),但与多酚氧化酶平均酶活力呈极显著负相关(<0.01)。因此,杨柳田头菇单核体菌丝的生长速度与9种胞外酶平均活力也存在着一定程度的相关性。
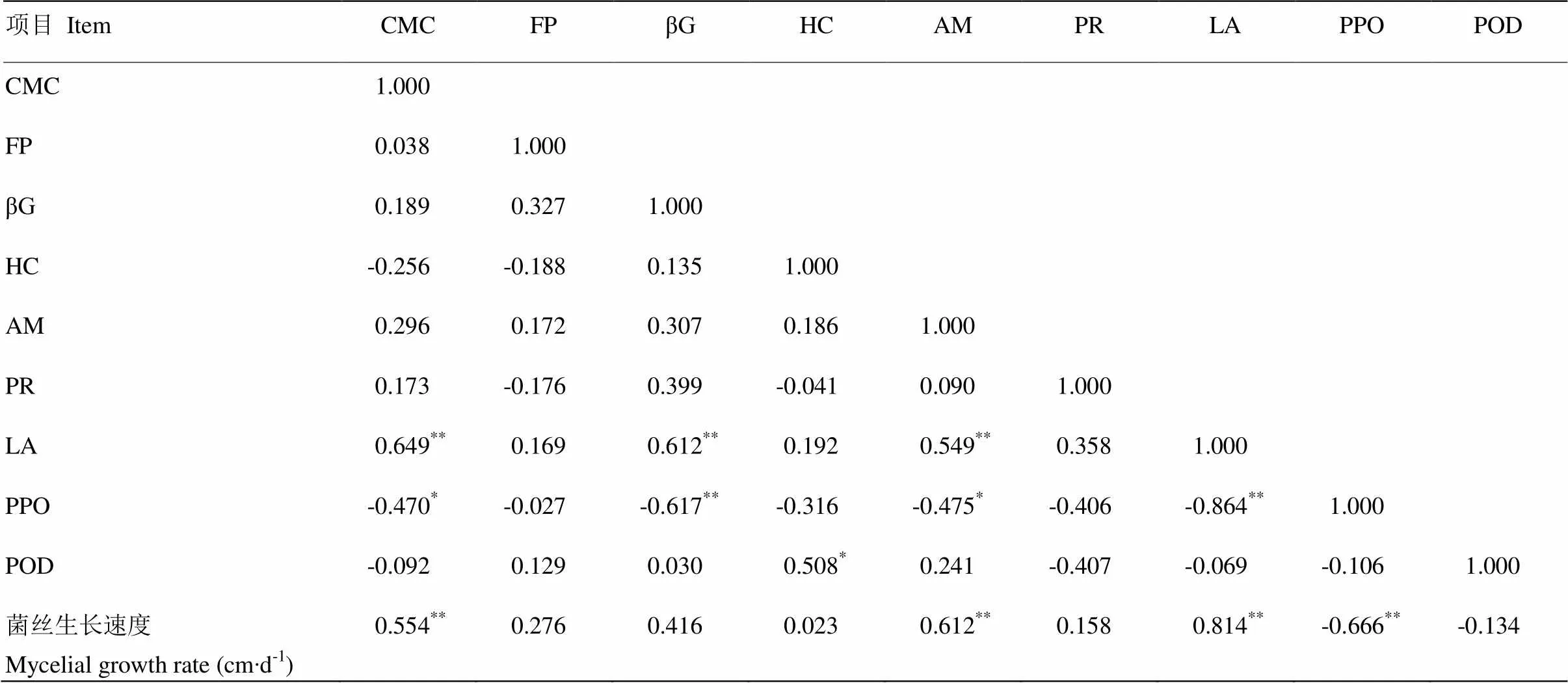
表6 菌丝生长速度及其胞外酶平均活力的相关系数
以相关性分析为基础,对胞外酶活力与双核体菌丝生长速度进行通径分析,剔除偏回归系数不显著的自变量,建立Y的最优线性方程为:=0.195+ 0.1047(=39.276,=0.000<0.01),线形回归方程的F检验达到极显著。总之,漆酶对双核体的菌丝生长速度的作用最大,不同胞外酶之间的协同作用对双核体菌丝的生长速度影响较小。
2.5 极性对9种胞外酶平均活力的影响分析
在单核体的基础上,根据极性不同将单核体分为AxBx、AyBy、AxBy和AyBx4类,分别计算每一类极性中单核体的9种胞外酶平均活力,通过多重比较(Duncan法)分析不同极性对9种胞外酶平均活力的影响。结果表明(表7),-葡萄糖苷酶、淀粉酶、漆酶、多酚氧化因极性不同而表现出一定的显著差异,其余胞外酶酶活的表现无差异。

表7 不同极性对胞外酶平均活力的影响
2.6 交配因子与9种胞外酶平均活力的影响分析
用上述同样的方法,在单核体的基础上,根据交配因子不同将单核体分为Ax、Ay、Bx和By4类,分别计算每一类交配因子中单核体的9种胞外酶平均活力,通过多重比较(Duncan法)分析不同交配因子对9种胞外酶平均活力的影响。结果表明(表8),大部分胞外酶因交配因子不同而未表现出差异性,只有漆酶、多酚氧化酶、过氧化物酶存在一定的显著差异。
3 讨论
据有关文献报道,大型真菌菌丝体的生长速率是由多个基因控制的数量性状位点[41-42]。大型真菌菌丝生长速度与酶类、激素分泌和耐温特性等[43-44]相关,并已经证实其单核体菌丝生长速度相关控制基因或数量基因座与交配因子[45]和自我识别系统连锁[46]。然而,直接说真菌胞外酶活性与菌丝生长速度相关的研究目前尚未见报道。本研究发现杨柳田头菇单核体中生长速度较快的也具有较高的胞外酶活性,生长速度较慢的其胞外酶活性低,因此,单核体胞外酶活性与菌丝生长速度之间可能存在一定的相关性。

表8 不同交配因子对胞外酶平均活力的影响
本研究发现,在显著水平为0.05上,极性对胞外酶的影响大于交配因子,目前的研究已证明交配因子A和B本身并不连锁且存在于不同的染色体上[47-48]。因此,杨柳田头菇单核体的胞外酶活性是与极性有相关性的多基因控制的数量性状,而不是与单独的交配因子相关。
高等真菌在人工驯化栽培过程中,其有性繁殖阶段交配型因子位点内出现重组的现象极其普遍,常常引发交配因子的偏分离,偏分离现象在[49]、[50]、[46]等中均有报道,可导致极性菌株不成比例,严重者还出现某一极性丢失的现象[51],与正常菌株相比,偏分离菌株会出现一些不同的特征,如菌丝生长速度和胞外酶活性异常。本研究发现,除一些单核体和双核体菌株外,类型Ⅰ菌株的胞外酶活性有一定的规律。因此,单核体的菌丝生长速度与本极性异常与其胞外酶活性相关。
4 结论
淀粉酶、滤纸纤维素酶、半纤维素酶、β-葡萄糖苷酶、羧甲基纤维素酶及蛋白酶活性在单核体和双核体的表达水平较高;单核体与双核体的胞外酶活性极有可能与菌丝生长速度、极性相关,其中漆酶对单核体和双核体菌丝生长速度的影响较大,极性对胞外酶平均活力的影响大于交配因子。单核体的菌丝生长速度与本极性异常是改变各菌株生长速度和胞外酶活性表达水平的根源。
[1] 杨祝良, 臧穆, 刘学系. 杨柳田头菇—无孔组的一个滇产新种. 云南植物研究, 1993, 15(1): 18-20.
Yang Z L, Zang M, Liu X X., a new species of sect. aporus from Yunnan,, 1993, 15(1): 18-20.(in Chinese)
[2] FAYOD V. Prodrome d'une histoire naturelle des Agaricines., 1889, 7(9): 181-411.
[3] 臧穆, 杨祝良, 刘学系. 一种滇产的美味新食菌杨柳田头菇. 中国食用菌, 1991, 13(6): 8.
ZANG M, YANG Z L, LIU X X., a delicious edible mushroom newly discove red from Yunnan., 1991, 13(6): 8. (in Chinese)
[4] 金鑫. 中国广义球盖菇科几个属的分类学研究[D]. 长春: 吉林农业大学, 2012.
JIN X. Studies on taxonomy of several genera of strophariaceae (s. l.) from China [D]. Changchun: Jilin Agricultural University, 2012. (in Chinese)
[5] 周会明. 杨柳田头菇生活史及分类地位研究[D]. 昆明: 昆明理工大学, 2011.
ZHOU H M. Studies on the life cycle and classification of[D]. Kunming: Kunming University of Science and Technology, 2011. (in Chinese)
[6] 汪欣, 刘平. 杨柳田头菇引种驯化试验研究. 中国食用菌, 2004, 23(2): 16-17.
WANG X, LIU P. Studies on domestication of., 2004, 23(2): 16-17. (in Chinese)
[7] Liu L Y, Li Z H, Dong Z J, Li X Y, Su J, Li Y, Liu J K. Two novel
fomannosane-type sesquiterpenoids from the culture of the basidiomycete., 2012, 2(3): 130-132.
[8] LIU L Y, ZHANG L, FENG T, LI Z H, DONG Z J, LI X Y, LIU J K. Unusual illudin-type sesquiterpenoids from cultures of., 2011, 1(2): 87-92.
[9] ZHU Y C, WANG G, YANG X L, LUO D Q, ZHU Q C, PENG T, LIUJ K. Agrocybone, a novel bis-sesquiterpene with a spirodienone structure from basidiomycete., 2010, 51(26): 3443-3445.
[10] CHEN W M, ZHANG X L, CHAI H M, CHEN L J, LIU W L, ZHAO Y C. Comparative analysis of aporulating and spore-deficient strains ofbased on the transcriptome sequences., 2015, 71(2): 204-213.
[11] CHEN W M, CHAI H M, YANG W X, ZHANG X L, CHEN Y H, ZHAO Y C. Characterization of non-coding regions in B mating loci ofgroups: target sites for B mating type identification., 2017, 74(6): 772-778.
[12] 周会明, 赵永昌, 陈卫民, 柴红梅, 李树红, 赵静. 杨柳田头菇交配型因子与菌丝生长速度关系. 云南植物研究, 2010, 32(4): 315-322.
ZHOU H M, ZHAO Y C, CHEN W M, CHAI H M, LI S H, ZHAO J. The relationship between mating factors with mycelia growth rate of(Bolbitiaceae)., 2010, 32(4): 315-322. (in Chinese)
[13] 周会明, 张小雷, 马美芳, 杨丽芬, 赵永昌. 田头菇属不同分离菌株杂交研究. 生物技术, 2011, 21(1): 69-73.
ZHOU H M, ZHANG X L, MA M F, YANG L F, ZHAO Y C. Study on the hybridization for different isolates of genus., 2011, 21(1): 69-73. (in Chinese)
[14] 曹春蕾, 崔宝凯, 秦问敏. 桑木层孔菌液体培养过程中几种胞外酶活性的变化. 菌物学报, 2011, 30(2): 275-280.
CAO C L, CUI B K, QIN W M. Activity changes of several extracellular enzymes in liquid culture of., 2011, 30(2): 275-280. (in Chinese)
[15] 方宏阳. 不同颜色的毛木耳菌株生长发育过程及胞外酶活性研究[D]. 长春: 吉林农业大学, 2017.
FANG H Y. Study on the growth and development and extracellular enzyme activity of different color strain of[D]. Changchun: Jilin Agricultural University, 2017. (in Chinese)
[16] 刘兵. γ-氨基丁酸和海藻糖对高温胁迫香菇菌丝胞外酶活性的影响[D]. 晋中: 山西农业大学, 2017.
LIU B. Effect of GABA and trehalose on the activity of exoenzyme induced by heat stress in mycelia of[D]. Jinzhong: Shanxi Agricultural University, 2017. (in Chinese)
[17] ZERVA A, ZERVAKIS G I, CHRISTAKOPOULOS P, TOPAKAS E. Degradation of olive mill wastewater by the induced extracellular ligninolytic enzymes of two wood-rot fungi., 2017, 203(2): 791-798.
[18] HU C J, HUANG D L, ZENG G M, CHENG M, GONG X M, WANG R Z, XUE W J, HU Z X, LIU Y N. The combination of Fenton process andfor the removal of bisphenol A in river sediments: Mechanism related to extracellular enzyme, organic acid and iron., 2018, 338: 432-439.
[19] PANDEYR K, TEWARIS, TEWARIL. Lignolytic mushroomWDP2: Laccase production, characterization, and bioremediation of synthetic dyes., 2018, 158: 50-58.
[20] ZHAIF H, HANJ R. Decomposition of asparagus old stalks byspp.under mushroom-growing conditions., 2018, 231: 11-14.
[21] 郝敬喆. 新疆野生巴尔喀什蘑菇驯化栽培与漆酶活性研究[D]. 北京: 中国农业大学, 2019.
HAOJ Z. Domesticated cultivation of Xinjiang wild mushroomand laccase activity [D]. Beijing: China Agricultural University, 2019. (in Chinese)
[22] 曾春函, 王传华. 我国主要蜜环菌生物种胞外酶活性对温度的种特异性响应. 菌物学报, 2019, 38(1): 1-15.
ZENGC H, WANGC H. Specificity response of extracellular enzyme activities to temperature of eightspecies in China., 2019, 38(1): 1-15. (in Chinese)
[23] 方宏阳, 任梓铭, 孟秀秀, 代俊杰, 李寿建, 黎志文, 李晓. 玉木耳胞外酶变化与农艺性状关系. 分子植物育种, 2018, 16(13): 4431-4435.
FANGH Y, RENZ M, MENG X X, DAI J J, LI S J, LI Z W, LI X. The relationship between extracellular enzymes changes and agronomic traits in., 2018, 16(13): 4431-4435. (in Chinese)
[24] 李利梅, 朱国胜, 黄万兵, 卢颖颖, 龚光禄, 张丽娜, 杨通静, 桂阳. 红托竹荪母种菌丝生长特性及胞外酶活性. 食用菌学报, 2018, 25(3): 30-35.
LIL M, ZHUG S, HUANGW B, LUY Y, GONGG L, ZHANGL N, YANGT J , GUIY. Mycelial growth characteristics and extracellular enzyme activity of., 2018, 25(3): 30-35. (in Chinese)
[25] 吴亚召, 张文隽, 雷萍, 杜芳. 茶树菇生长发育过程中几种胞外酶活性的变化. 西北农林科技大学学报(自然科学版), 2018, 46(11): 115-120.
WUY Z, ZHANGW J, LEI P, DU F. Changes of extracellular enzymes activities during development of., 2018, 46(11): 115-120. (in Chinese)
[26] 靖云阁. 白灵侧耳菌丝生理成熟期环境控制及生理指标测定[D]. 北京: 中国农业科学院, 2018.
JINGY G. Studies of environment control and physiological test duringin mycelium physiological maturity period [D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. (in Chinese)
[27] 柴红梅, 周会明, 赵静, 陈卫民, 赵永昌. 利用自交寻找食用菌发育缺陷型基因的研究. 农业科学与技术: 英文版, 2012, 13(10): 2037-2043.
CHAIH M, ZHOUH M, ZHAOJ, CHENW M, ZHAOY C. search development-deficient genes in edible mushroom by self-crossing., 2012, 13(10): 2037-2043. (in Chinese)
[28] JIC, NGUYENL N, HOUJ W, HAIF I, CHENV. Direct immobilization of laccase on titania nanoparticles from crude enzyme extracts ofculture for micro-pollutant degradation., 2017, 178: 215-223.
[29] MILLERG L. Use of dinitrosalicylic acid reagent for determination of reducing sugar., 1959, 31(3): 426-428.
[30] SEBNEMK, SAADETB. Yield performances and changes in enzyme activities of Pleurotus spp. () cultivated on different agricultural wastes., 2010, 101(9): 3164-3169 .
[31] DECKERS R, ADNEYW S, JENNINGSE, VINZANTT B, HIMMELM E. Automated filter paper assay for determination of cellulose activity., 2003, 107(1):689-704.
[32] LUY H, DENGX, CHENGZ, LIQ, LIUG. Enhanced production of hybrid extracellular β-glucanase by recombinantusing experimental design method., 2007, 15(2): 172-177.
[33] SHAMALAT R, SREEKANYIAHK R. Production of cellulases and D-xylanase by some selected fungal isolates., 1986, 8(3): 178-182.
[34] SIMONISJ L, RAJAH A, SHEARERC A. Extracellular enzymes and soft rot decay: Are ascomycetes important degraders in fresh water., 2008, 31(1): 135-146.
[35] LOWRYO H, ROSENBROUGHM J, FARRA L, RANDALLR J. Protein measurement with folin-phenol reagent., 1951, 193(1):265-275.
[36] EGGERK N. Substrate hydrolysis patterns of post-fire ascomycetes (Pezizales)., 1986, 78(5):771-780.
[37] POINTINGS B. Qualitative methods for the determination of lignocellulolytic enzyme production by tropical fungi., 1999, 2: 17-33.
[38] SIKS, UNYAYARA.andfort he degradation of cotton stalk and their laccase, peroxidase, ligninase and cellulose enzyme activities under semisolid state conditions., 1998, 22(3): 287-298.
[39] VAN DER KOOIJM A, HOLLISF, LOZANOL, ZALACHORASI, ABADS, ZANOLETTIO, SANDI C. Diazepam actions in the VTA enhance social dominance and mitochondrial function in the nucleus accumbens by activation of dopamine D1 receptors., 2018, 23(3): 569.
[40] 陈岗, 詹永, 杨勇, 吴振, 谢会川, 石文娟, 柴佳炎, 龚胡荣, 罗杨. 温度对银耳胞外酶活力及营养品质特性的影响. 食品科学, 2017, 38(23): 113-120.
CHENG, ZHAN Y, YANGY, WUZ, XIE H C, SHI W J, CHAI J Y, GONG H R, LUO Y. Effect of cultivation temperature on extracellular enzyme activities and nutritional quality characteristics of., 2017, 38(23): 113-120. (in Chinese)
[41] LARRAYA L M, IDARETAE, ARANAD, RITTERE, PISABARROA G, RAMIREZL. Quantitative trait loci controlling vegetative growth rate in the edible basidiomycete., 2002, 68(3): 1109-1114.
[42] LARRAYAL M, ALFONSOM, PISABRROA G, RAMIREZL. Mapping of genomic regions (Quantitative Trait Loci) controlling production and quality in industrial cultures of the edible basidiomycete., 2003, 69(6): 3617-3625.
[43] OLSONA. Genetic linkage between growth rate and the intersterility genes S and P in the basidiomycetes. lat.2006, 110(8): 979-984.
[44] SANTOYOF, GONZÁLEZA E, TERRÓNM C, RAMíREZL, PISABARROA G. Quantitative linkage mapping of lignin-degrading enzymatic activities in., 2008, 43(2): 137-143.
[45] LARRAYAL M, PEREZG, IRIBARRENI. Relationships between monokaryotic growth rate and mating type in the edible basidiomycete., 2001, 67(8): 3385-3390.
[46] VAN DER NESTM A, SLIPPERSB, STEENKAMP E T, DE VOSL, VAN ZYLK, STENLIDJ, WINGFIELDB J, WINGFIELDB D. Genetic linkage map forreveals an association between vegetative growth and sexual and self-recognition., 2009, 46(9): 632-641.
[47] TOKIMOTOK, KOMATSUM, TAKEMARUT. Incompatibility factors in the natural population ofin Japan., 1973, 10: 371-376.
[48] MURAKAMIS, TAKEMARUT. “Puff” mutation induced by UV irradiation in(Berk.) Sing., 1975, 12: 47-51.
[49] MURAGUCHIH, ITOY, KAMADAT, YANAGIS O. A linkage map of the basidiomycetebased on random amplified polymorphic DNAs and restriction fragment length polymorphisms., 2003, 40(2): 93-102.
[50] TERASHIMAK, MATSUMOTOT, HAYASHIE, FUKUMASA- NAKAIY. A genetic linkage map of(shiitake) based on AFLP markers., 2002, 106(8): 91l-917.
[51] 周会明, 柴红梅, 赵静, 魏云林, 赵永昌. 基于SPSS的杨柳田头菇菌丝生长速度与交配型相关性分析. 西南农业学报, 2010, 23(6): 1992-1998.
ZHOUH M, CHAIH M, ZHAOJ, WEIY L, ZHAOY C. Correlation analysis between mycelial growth rate and mating type ofbased on SPSS statistics., 2010, 23(6): 1992-1998. (in Chinese)
The Extracellular Enzymes Activity of F1Generations and Single-spore Isolations inStrain YAAS711
ZHOU HuiMing1,2, ZHAO YongChang2, CHAI HongMei2, ZHANG YanZhen1,2
(1School of Biotechnology and Engineering, West Yunnan University, Lincang 677000, Yunnan;2Institute of Biotechnology and Germplasmic Resource, Yunnan Academy of Agricultural Sciences, Kunming 650205)
【】The objective of this study was to explore the changes in activities of extracellular enzymes (EEA) of single-spore isolations and its self-crossing individuals fromYAAS711 and to provide evidence for its genetic breeding.【】Eighteen single-spore monokaryons and 22 dikaryons from self-crossing progeny ofYAAS711 were used as the test materials. The activities of CMCase, filter paper cellulase, β-glucanase, hemicellulase, amylase, protease, laccase, polyphenolase and peroxidase of all test strains were determined by 3,5-dinitrosalicylic acid (DNS), Folin methods and guaiacol method, and correlation analysis were carried out between the 9 EEs with mycelial growth rate, polarities and mating factors.【】The results of 9 EEs showed that most of the both monokaryons and dikaryons had higher activities of amylase, filter paper cellulase, hemicellulose, β-glucanase, CMCase and protease, but their activities of peroxidase, polyphenolase and laccase were low. The mycelial growth rate of monokaryons and dikaryons had a certain degree of correlation with the average activity of 9 EEAs. Compared with the dikaryons derived from the combination of “fast-fast” growth rate of monokaryons, the dikaryons derived from the combination of “fast-slow” growth rates of monokaryons had higher EEAs, except hemicellulase, protease and polyphenol oxidase activities. However, there were no rules to follow, when it came to the combination of dikaryons from the cross of type II monokaryons. The indirect effect of polyphenolase on the mycelial growth rate of monokaryons was greater than that of laccase, but the combined effect of laccase on the mycelial growth rate of monokaryons was the largest. The synergistic effect among EEs had little effect on the mycelial growth rate of dikaryons, among them, laccase had the greatest direct effect on its mycelial growth rate. Multiple comparisons showed that the effect of polarity on EEs was greater than that of mating factors at a significant level of 0.05.【】In short, there was a significant correlation between the anomalies of the mycelial growth rate of the monokaryons from same polarity single spore isolations and the EEAs of F1 generations deriverd from these monokaryons instrain YAAS711. The EEAs of type I strains had same rule, but the differences were existed in some type II monokaryons and the dikaryons. There were certain correlation between the growth rate of monokaryons, EEAs and polarity, there were no direct correlation between mating factors and EEAs.
; self-crossing F1generations; extracellular enzyme activity; monokaryon; dikaryon
10.3864/j.issn.0578-1752.2019.20.017

2019-04-08;
2019-08-03
云南省教育厅科学研究基金(2018JS522)、国家食用菌产业技术体系(CARS-20)
周会明,E-mail:632243530@qq.com。
赵永昌,E-mail:yaasmushroom@aliyun.com
(责任编辑 赵伶俐)

