植物脱落酸受体PYR/PYL/RCAR的研究进展
赵雷
摘要:脱落酸(Abscisic acid,ABA)是一种重要的植物抗胁迫激素,其受体的筛选和鉴定为植物中ABA信号转导通路的阐明奠定了重要基础。目前发现了几种ABA受体,大多数都受到质疑,但PYR/PYL/RCAR被普遍认为是真正的ABA受体蛋白。简略介绍了发现PYR/PYL/RCAR之前ABA受体的研究概况,重点介绍了目前国内外对于PYR/PYL/RCAR蛋白的研究进展。
关键词:脱落酸(Abscisic acid,ABA)受体;PYR/PYL/RCAR;信号转导;生理功能
中图分类号:S184 文献标识码:A
文章编号:0439-8114(2019)18-0014-05
DOI:10.14088/j.cnki.issn0439-8114.2019.18.003 开放科学(资源服务)标识码(OSID):
Advances in plant abscisic acid receptor PYR/PYL/RCAR
ZHAO Lei
(College of Bioengineering and Biotechnology,Tianshui Normal University,Tianshui 741000,Gansu,China)
Abstract: Abscisic acid (ABA) is an important plant stress-resistant hormone. The screening and identification of ABA receptors lay an important foundation for elucidating ABA signal transduction pathways in plants. Several kinds of ABA receptors have been found, most of which are questioned, but PYR/PYL/RCAR is generally considered to be the true ABA receptor protein. The research progress of ABA receptors before the discovery of PYR/PYL/RCAR was briefly introduced,and the research progress of PYR/PYL/RCAR protein at home and abroad were detailed introduced.
Key words: abscisic acid receptors; PYR/PYL/RCAR; signal transduction; physiological function
脫落酸(Abscisic acid,ABA)可以调节植物生长发育过程中的许多方面,包括胚的成熟、种子的休眠及萌发,细胞的分裂和伸长,成花诱导等。除此之外,还能响应逆境胁迫,例如干旱胁迫、低温胁迫、盐胁迫、病菌侵害、紫外辐射等[1,2]。ABA在逆境胁迫的应答中起着重要作用,研究ABA对提高植物抗逆性、促进现代农业发展具有重要意义。近些年来ABA信号转导途径成为研究的热点,ABA信号转导途径源于ABA受体与信号转导途径中关键成分的相互作用,所以ABA受体的研究是信号转导途径研究的重点和关键点。
截至目前,已经有几种ABA结合蛋白被报道。例如,G蛋白偶联受体[3]和镁离子螯合酶H亚基[4]。尽管这些蛋白一度被认为在响应ABA过程中起重要作用,但是它们和目前公认的信号因子(如PP2C和SnRK2)之间的联系仍然不清楚。之后,一种新的可溶性的ABA受体PYR/PYL/RCAR被两个不同的研究组运用两种不同的方法(分别为遗传学和生物化学的方法)鉴别出来[5,6]。这一发现是ABA信号转导研究进程中的一个突破。本文就目前PYR/PYL/RCAR的研究进展做一综述。
1 PYR/PYL/RCAR之前的ABA受体研究概况
ABA受体是处于ABA信号通路最上游的ABA信号调节因子,承担着识别ABA信号和启动信号转导原初过程的使命[7]。早在20世纪末的研究中表明,在种子萌发和基因表达试验中使用ABA类似物,可以检测到多种ABA受体的存在[8]。
2006年FCA被报道为ABA受体。它是一种RNA结合蛋白,参与拟南芥开花时间和根部发育调控,通过与FLC mRNA的结合发挥作用[9]。但是Risk等[10]利用3H-ABA与FCA的体外结合试验证明,FCA并不能结合ABA,之前的试验结果不能重复出来,所以FCA是ABA受体这一结论受到质疑。
Shen等[4]利用放射性ABA的测定系统证明
ABAR/CHLH可以结合ABA,而且ABAR-ABA结合的动力学符合受体-配体结合的所有特征。之后又用植物生理学试验证明了ABAR/CHLH可以正向调节ABA信号转导。但是ABAR/CHLH是ABA的受体这一结论多次遭受质疑[11,12]。尽管张大鹏课题组对该质疑做出过回应,并提出ABAR-WRKY40相偶联的ABA信号级联通路模型[7,13],随后的研究又对该模型做出了补充[14,15]。但是仍不能确定ABAR/CHLH一定为ABA的受体。
有研究发现拟南芥中的一种G蛋白偶联受体GCR2能与ABA特异性结合,调控拟南芥ABA信号应答反应,被认为是ABA受体[16]。但是对GCR2是ABA受体的争论不断[17-19],所以目前对于GCR2是否以ABA受体的形式行使功能还没有定论。
2009年Pandey 等[20]提出,GTGs(GPCR-type G proteins,一种具有G蛋白偶联受体特征的G蛋白)是ABA受体,但该受体相关的研究同样存在许多疑问[21,22]。因此,GTG1/GTG2是否为ABA受体仍有待进一步研究。
2 ABA受体PYR/PYL/RCAR的发现及分类
2009年Park等[6]利用Pyrabactin筛选到了
Pyrabactin resistance 1(PYR1)。试验结果表明,Pyrabactin小分子(一种人工合成的ABA选择性激动剂)通过PYR1起作用,继而他们在拟南芥中鉴定出了 PYR/PYL 蛋白家族,这个蛋白家族成员对于体内 ABA、Pyrabactin 及其他植物激素分子的信号传递都起着重要作用。而另外一个研究组利用酵母双杂交的方法分离得到了一个ABI2的互作蛋白并命名为Regulatory Component of ABA receptor1 (RCAR1)[5]。等温量热滴定的结果(Isothermal titration calorimetry,ITC)显示,RCAR1可以在体外直接结合ABA,并抑制下游ABI1和ABI2的活性[5]。PYR1和RCAR1同属START/Betv1超家族蛋白成员,具有保守的疏水性的配体口袋[23]。
在拟南芥中,START/Betv1基因家族具有14个成员,分别命名为PYR1、PYR1-like(PYL)1-13或者RCAR1-14,这其中的13个成员(PYL13除外)的序列和结构具有高度保守性,并能与ABA相结合抑制蛋白磷酸酶PP2Cs的活性[24]。PYL13是比较特殊的START/Betv1家族成员,其他成员均具有保守的ABA结合结构域,但是PYL13在此结构域上发生了3个氨基酸残基的突变,并且不能与HAB1(一种PP2C)结合[25],但又有研究表明,在ABA存在时,PYL13可与A类PP2C相结合,再结合其他研究最终确定PYL13具有作为ABA受体的功能[26]。
根据序列相似性,拟南芥的14个受体蛋白分为3个亚类。I类包括PYL7/8/9/10,II类包括PYL4/5/6/11/12/13,III类包括PYR1和PYL1/2/3[5]。在拟南芥中,PYR1、PYL1、PYL2、PYL4、PYL5和PYL8在调控种子萌发、气孔关闭以及ABA信号途径相关基因的表达方面均起着重要的作用[27]。但PYL8还可以增强生长素响应基因的转录,调控侧根的生长,而其他受体蛋白不具有此功能[28]。这说明该家族的受体在功能方面既有重叠又有差异。
3 ABA受体PYR/PYL/RCAR的结构及构象变化
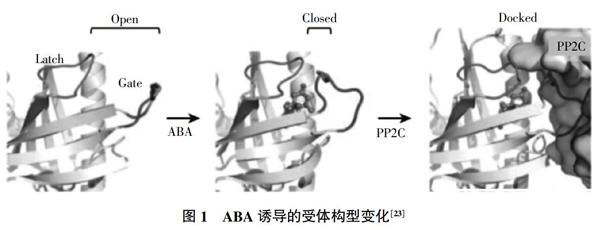
ABA 受體 PYR/PYL/RCAR 蛋白的4个α螺旋和7个β折叠共同形成Gate-Latch-Lock结构。当ABA与其受体结合时,ABA进入受体蛋白的空腔,诱导受体构象改变,空腔关闭,ABA被固定在空腔内,受体与ABA相互作用的表面可以招募PP2C,然后受体蛋白上关闭的门环(gate loop)将PP2C的催化位点封闭,使PP2C的蛋白磷酸酶活性丧失。具体的构型变化见图1。
该受体家族蛋白上的保守氨基酸对于受体与ABA的结合至关重要。有试验证明,拟南芥PYL13受体蛋白中的几个关键氨基酸残基发生变异后,导致PYL13不能结合ABA[29]。还有研究证明该受体家族和ABA的结合有两种形式:一种在没有结合ABA时以同源二聚体形式存在,结合后以单体形式存在,PYR1和 PYL1/2/3属于该类,对于PP2C活性的抑制依赖于ABA的结合;另一种无论是否结合ABA均以单体的形式存在,对于PP2C活性的抑制不依赖于ABA的结合,PYL4/5/6/8/9/10属于该类[30]。
2014年,He等[31]利用计算机比较基因组学鉴别了水稻(Oryza sativa)12种OsPYLs ABA受体,发现这些受体抑制PP2Cs时呈现不同的结合状态和寡聚状态,通过研究ABA-OsPYL2-OsPP2C06三元复合物揭示了OsPYLs的分子作用机制,即当ABA与OsPYL2 相互结合后,OsPYL2的CL2环与OsPP2C06 相互作用并且占据了OsPP2C06部分的催化位点,与此同时,OsPP2C06 也与OsPYL2和ABA产生了相互作用,OsPP2C06磷酸酶作用就被抑制了。2016年,Fan等[32]研究了玉米(Zea mays L.)在ABA作用或脱水胁迫下ZmPYL家族的表达情况,发现在根和叶片基因表达是有区别的,推测单体形式的ABA受体主要参与了根部ABA信号的转导,而二聚体形式的ABA受体主要在叶片中行使功能。
4 PYR/PYL/RCAR介导的ABA信号通路
根据有关PYR/PYL/RCAR参与的ABA信号通路的试验结论[33,34],建立了PYR/PYL/RCAR为受体的ABA信号转导通路模型:当植物所处环境正常时,ABA的含量很低,从而使得ABA不能和其受体PYR/PYL/RCAR相结合;这时PP2C发挥其磷酸酶的作用使得SnRK2去磷酸化,去磷酸化之后的SnRK2无法发挥其作用。这就使得下游转录因子(ABA-responsive Element Binding Pro teins/ABA-responsive Element Binding Factors) ABF/AREB无法被激活。当植物处于逆境中时,细胞内ABA的含量就会增加,ABA与其受体PYR/PYL/RCAR相结合。ABA-PYR/PYL/RCAR复合体与PP2C相结合,抑制其磷酸酶的作用。SnRK2处于磷酸化的活性状态,从而发挥激酶活性激活下游转录因子ABF/AREB,如AREB1/ABF2、AREB2/ABF4和ABF3,正向调控ABA信号应答基因的表达[35-37]。
此外,PYR /PYL/RCAR还可与细胞内其他蛋白互相作用,调控ABA信号通路或参与植物的生长发育及胁迫应答。研究表明,PYL9能够与MYB44蛋白相互作用,可以减弱PYL9对ABI1的抑制作用[38]。而PYR1和PYL4能够与E3泛素连接酶RSL1相互作用,从而减弱ABA的信号转导[39]。
近几年的研究对于PYR/PYL/RCAR介导的ABA信号通路又有所补充。2012年,Li等[40]研究证明,一种小G蛋白ROP11可直接结合ABI1,从而保护ABI1的磷酸酶活性不被RCAR1/PYL9所抑制。又有研究显示,ABI1和其他PP2Cs反过来可以保护RopGEF1,避免其遭受ABA引发的降解,从而形成Rop GEF-ROP-PP2C控制回路,有效地避免了ABA信号转导的部分泄露[41]。有酵母双杂交试验显示PYL6与JA应答的关键转录因子MYC2存在相互作用,并且这种相互作用会在ABA存在时加强,正是两者之间的相互作用连接了ABA和JA信号途径[42]。一个由MAP3Ks MAP3K17/18、MAP2K MKK3和MAPKs MPK1/2/7/14组成的MAPK级联可能与PYR/PYL/RCAR介导的ABA信号通路激活相关,MPK1和MPK2也可能磷酸化许多ABA的效应蛋白[43]。
另有报道称,NO可能抑制ABA信号转导,因为NO缺乏的植株对ABA超敏感,而经NO处理后,有些受体活性减弱。原因可能是NO处理后植物PYR/PYL/RCAR蛋白受体酪氨酸残基硝基化,引发受体泛素化,从而导致这些受体被蛋白酶降解所致[44]。
5 PYR/PYL/RCAR在植物体内发挥的生理功能
有关于PYR/PYL蛋白的功能是通过研究突变体以及过表达试验来证明的。Park等[6]2009年已经构建了pyr1pyl1pyl4三突變体和pyr1pyl1pyl2pyl4四突变体。上述两种突变体均在根的生长和种子萌发方面表现出对ABA的不敏感。四突变体甚至表现出了对于ABA诱导的气孔关闭功能的损坏[45]。对于ABA诱导的RD29a、NCED3和P5CS1的转录功能,四突变体也表现出敏感度下降。更重要的是,ABA对于SNF1-related protein ki-nases(SnRK2s)的激活能力在四突变体中也减弱了[6]。而过表达PYL9以及对PYL9进行RNAi处理则分别表现出ABA超敏和ABA不敏感[5]。过表达PYL5则使得拟南芥对于干旱的耐受性增强[49],这个结论将该受体家族与植物抗胁迫生理功能联系起来。
将RCAR6在拟南芥中过表达,发现该过表达体的WUE(水分利用效率)有所提高。同时与正常水分条件下生长的植株相比,RCAR6过表达体生长状况并未受到显著影响,气孔的大小和密度也和野生型没有差别,推测其过表达体蒸腾作用会减小,与ABA信号通路引发的气孔开合度变化有关[46]。
将棉花GhPYL10、 GhPYL12和 GhPYL26基因导入拟南芥中进行过表达,发现这些植株在幼苗生长和种子萌发中均表现为ABA超敏感。过表达转基因植株比对照植株耐旱能力更高[47]。从木薯栽培种KU50中克隆得到MePYL8基因,利用荧光定量PCR对MePYL8进行多种处理下的表达分析,结果表明MePYL8在转录水平受到ABA、 高盐胁迫和干旱胁迫的诱导作用, 同时受到氧化胁迫的抑制作用,表明MePYL8在多种非生物胁迫下的信号转导通路中可能具有重要的功能[48]。克隆得到葡萄的6个PYL基因,并对其进行生物信息学及非生物胁迫下的响应分析,发现它们高度保守,可分为3个亚组,能够响应不同非生物胁迫[49]。不仅如此,研究还表明PYL家族基因可以调节植物果实成熟,随着草莓果实的成熟,FaPYL9基因的表达量会随之升高; 若干扰草莓果实中的FaPYL9基因,则草莓果实成熟期会延迟3~5d,同时与草莓果实着色相关的FaCHS 和FaUFGT基因的表达量也会降低,并且果实中的蔗糖含量以及花青素含量也随之降低,ABA含量和果实硬度增加。所以FaPYL9基因在草莓果实成熟发育过程中起重要作用[50]。
综合生理学、遗传学以及结构学方面的研究,PYR/PYL/RCARs是ABA受体,并且控制ABA信号转导和植物生理表现的很多方面。
6 小结
当植物面对各种非生物胁迫时,其自身可通过ABA信号通路诱发一系列生理效应从而有效抵抗干旱、高盐等胁迫环境。而通过调控植物ABA信号通路来提高植物抗胁迫能力,成为近年来培育抗胁迫植物的新思路[51]。从PYR/PYL/RCAR受体着手培育抗胁迫植物主要有两个思路:①构建PYR/PYL/RCAR过表达体,如前所述,很多研究都表明在植物体内过表达PYR/PYL/RCAR可以提高植物抗旱能力;②多研究以单体形式存在,不依赖ABA就能抑制PP2C活性的受体,提高该类受体与PP2C结合的活性,从而提高植株ABA信号通路本底表达能力,进而提高抗旱能力。
参考文献:
[1] FINKELSTEIN R. Abscisic acid synthesis and response[J].The arabidopsis book/American society of plant biologists,2013,11.
[2] CUTLER S R,RODRIGUEZ P L,FINKELSTEIN R R,et al. Abscisic acid:Emergence of a core signaling network[J].Annual review of plant biology,2010,61:651-679.
[3] LIU X,YUE Y,LI B,et al. AG protein-coupled receptor is a plasma membrane receptor for the plant hormone abscisic acid[J].Science,2007,315(5819):1712-1716.
[4] SHEN Y Y,WANG X F,WU F Q,et al. The Mg-chelatase H subunit is an abscisic acid receptor[J].Nature,2006,443(7113):823-826.
[5] MA Y,SZOSTKIEWICZ I,KORTE A,et al. Regulators of PP2C phosphatase activity function as abscisic acid sensors[J].Science,2009,324(5930):1064-1068.
[6] PARK S Y,FUNG P,NISHIMURA N,et al. Abscisic acid inhibits type 2C protein phosphatases via the PYR/PYL family of START proteins[J].Science,2009,324(5930):1068-1071.
[7] 張大鹏.始于质体/叶绿体的ABA信号通路[J].植物学报,2011, 46(4):361-369.
[8] WALKER-SIMMONS M K,HOLAPPA L D,ABRAMS G D,et al. ABA metabolites induce group 3 LEA mRNA and inhibit germination in wheat[J].Physiologia plantarum,1997,100(3): 474-480.
[9] RAZEM F A,EL-KEREAMY A,ABRAMS S R,et al. The RNA-binding protein FCA is an abscisic acid receptor[J].Nature,2006,439(7074):290-294.
[10] RISK J M,MACKNIGHT R C,DAY C L. FCA does not bind abscisic acid[J].Nature,2008,456(7223):E5-6.
[11] M?譈LLER A H,HANSSON M. The barley magnesium chelatase 150-kD subunit is not an abscisic acid receptor[J].Plant physiology,2009,150(1):157-166.
[12] TSUZUKI T,TAKAHASHI K,INOUE S,et al. Mg-chelatase H subunit affects ABA signaling in stomatal guard cells,but is not an ABA receptor in Arabidopsis thaliana[J].Journal of plant research,2011,124(4):527-538.
[13] SHANG Y,YAN L,LIU Z Q,et al. The Mg-chelatase H subunit of Arabidopsis antagonizes a group of WRKY transcription repressors to relieve ABA-responsive genes of inhibition[J].The plant cell,2010:1909-1935.
[14] ZHANG X F,JIANG T,WU Z,et al. Cochaperonin CPN20 negatively regulates abscisic acid signaling in Arabidopsis[J].Plant molecular biology,2013,83(3):205-218.
[15] ZHANG X F,JIANG T,YU Y T,et al. Arabidopsis co-chaperonin CPN20 antagonizes Mg-chelatase H subunit to derepress ABA-responsive WRKY40 transcription repressor[J].Science China life sciences,2014,57(1):11-21.
[16] LIU X,YUE Y,LI B,et al. A G protein-coupled receptor is a plasma membrane receptor for the plant hormone abscisic acid[J].Science,2007,315:1712-1716.
[17] GAO Y,ZENG Q,GUO J,et al. Genetic characterization reveals no role for the reported ABA receptor,GCR2,in ABA control of seed germination and early seedling development in Arabidopsis[J].The plant journal,2007,52(6):1001-1013.
[18] JOHNSTON C A,TEMPLE B R,CHEN J G,et al. Comment on" AG protein-coupled receptor is a plasma membrane receptor for the plant hormone abscisic acid"[J].Science,2007, 318(5852):914-914.
[19] RISK J M,DAY C L,MACKNIGHT R C. Reevaluation of abscisic acid-binding assays shows that G-protein-coupled receptor2 does not bind abscisic acid[J].Plant physiology,2009,150(1):6-11.
[20] PANDEY S,NELSON D C,ASSMANN S M. Two novel GP-CR-type G proteins are abscisic acid receptors in Arabidopsis[J].Cell,2009,136:136-148.
[21] PENNISI E. Stressed out over a stress hormone[J].Science,2009,324(5930):1012-1013.
[22] CHRISTMANN A,GRILL E. Are GTGs ABA's biggest fans?[J].Cell,2009,136(1):21-23.
[23] CUTLER S R,RODRIGUEZ P L,FINKELSTEIN R R,et al. Abscisic acid:emergence of a core signaling network[J].Annual review of plant biology,2010,61:651-679.
[24] YUAN X,YIN P,HAO Q,et al. Single amino acid alteration between valine and isoleucine determines the distinct pyrabactin selectivity by PYL1 and PYL2[J].Journal of biological chemistry,2010:jbc.M110.160192.
[25] BHASKARA G B,NGUYEN T T,VERSLUES P E. Unique drought resistance functions of the highly ABA-induced clade Aprotein phosphatase 2Cs[J].Plant physiol,2012,160:379-395.
[26] FUCHS S,TISCHER S V,WUNSCHEL C,et al. Abscisic acid sensor RCAR7/PYL13,specific regulator of protein phosphatase coreceptors[J].Proc Natl Acad Sci USA,2014,111:5741-5746.
[27] GONZALEZ-GUZMAN M,PIZZIO G A,ANTONI R,et al. Arabidopsis PYR/PYL/RCAR receptors play a major role in quantitative regulation of stomatal aperture and transcriptional response to abscisic acid[J].Plant cell,2012,24(6):2483-2496.
[28] ZHAO Y,XING L,WANg X,et al. The ABA receptor PYL8 promotes lateral root growth by enhancing MYB77-dependent transcription of auxin-responsive genes[J].Science signaling,2014,7(328):ra53.
[29] ZHAO Y,CHAN Z,XING L,et al. The unique mode of action of a divergent member of the ABA-receptor protein family in ABA and stress signaling[J].Cell research,2013,23(12):1380-1395.
[30] MIYAKAWA T,FUJITA Y,YAMAGUCHI S K,et al. Structure and function of abscisic acid receptors.[J].Trends in plant science,2013,18(5):259-266.
[31] HE Y,HAO Q,LI W,et al. Identification and characterization of ABA receptors in Oryza sativa[J].PloS One,2014,9(4):e95246.
[32] FAN W,ZHAO M,LI S,et al. Contrasting transcriptional responses of PYR1/PYL/RCAR ABA receptors to ABA or dehydration stress between maize seedling leaves and roots[J].Bmc plant biology,2016,16(1):99.
[33] UMEZAWA T,SUGIYAMA N,MIZOGUCHI M,et al. Type 2C protein phosphatases directly regulate abscisic acid-activated protein kinases in Arabidopsis[J].Proceedings of the national academy of sciences,2009,106(41):17588-17593.
[34] VLAD F,RUBIO S,RODRIGUES A,et al. Protein phosphatases 2C regulate the activation of the Snf1-related kinase OST1 by abscisic acid in Arabidopsis[J].The plant cell,2009, 21(10):3170-3184.
[35] FUJITA Y,NAKASHIMA K,YOSHIDA T,et al. Three SnRK2 protein kinases are the main positive regulators of abscisic acid signaling in response to water stress in Arabidopsis[J].Plant and cell physiology,2009,50(12):2123-2132.
[36] Sirichandra C,Davanture M,Turk B E,et al. The Arabidopsis ABA-activated kinase OST1 phosphorylates the bZIP transcription factor ABF3 and creates a 14-3-3 binding site involved in its turnover[J].PloS One,2010,5(11):e13935.
[37] YOSHIDA T,FUJITA Y,SAYAMA H,et al. AREB1,AREB2,and ABF3 are master transcription factors that cooperatively regulate ABRE-dependent ABA signaling involved in drought stress tolerance and require ABA for full activation[J].The plant journal,2010,61(4):672-685.
[38] LI D,LI Y,ZHANG L,et al. Arabidopsis ABA receptor RCAR1/PYL9 interacts with an R2R3-type MYB transcription factor,AtMYB44[J].International journal of molecular sciences,2014, 15(5):8473-8490.
[39] BUESO E,RODRIGUEZ L,LORENZO-ORTS L,et al. The single-subunit RING-type E3 ubiquitin ligase RSL 1 targets PYL 4 and PYR 1 ABA receptors in plasma membrane to modulate abscisic acid signaling[J].The plant journal,2014,80(6):1057-1071.
[40] LI Z,LI Z,GAO X,et al. ROP11 GTPase negatively regulates ABA signaling by protecting ABI1 phosphatase activity from inhibition by the ABA receptor RCAR1/PYL9 in Arabidopsis[J].Journal of integrative plant biology,2012,54(3):180-188.
[41] LI Z,WAADT R,SCHROEDER J I. Release of GTP exchange factor mediated down-regulation of abscisic acid signal transduction through ABA-induced rapid degradation of RopGEFs[J].PLoS Biology,2016,14(5):e1002461.
[42] ALEMAN F,YAZAKI J,LEE M,et al. An ABA-increased interaction of the PYL6 ABA receptor with MYC2 transcription factor:A putative link of ABA and JA signaling[J].Scientific reports,2016,6:28941.
[43] AXEL DE Z,JEAN C,HERIBERT H.The role of MAPK modules and ABA during abiotic stress signaling[J].Trends in plant science,2016,21(8):677-685.
[44] CASTILLO M C,LOZANO-JUSTE J,GONZ?魣LEZ-GUZM?魣N M,et al. Inactivation of PYR/PYL/RCAR ABA receptors by tyrosine nitration may enable rapid inhibition of ABA signaling by nitric oxide in plants[J].Sci Signal,2015,8(392):ra89-ra89.
[45] NISHIMURA N,SARKESHIK A,NITO K,et al. PYR/PYL/RCAR family members are major in-vivo ABI1 protein phosphatase 2C-interacting proteins in Arabidopsis[J].The plant journal,2010,61(2):290-299.
[46] YANG Z,LIU J,TISCHER S V,et al. Leveraging abscisic acid receptors for efficient water use in Arabidopsis[J].Proceedings of the national academy of sciences,2016,113(24):6791-6796.
[47] CHEN Y,FENG L,WEI N,et al. Overexpression of cotton PYL genes in Arabidopsis enhances the transgenic plant tolerance to drought stress[J].Plant physiology & biochemistry,2017,115:229-238.
[48] 顏 彦,铁韦韦,丁泽红,等.木薯mepyl8基因克隆及表达分析[J].分子植物育种,2018,16(14):4498-4504.
[49] 马宗桓,陈佰鸿,李文芳,等.葡萄PYL基因家族的鉴定与表达分析[J].果树学报,2018,35(3):265-274.
[50] 颜志明,王全智,冯英娜,等.FaPYL9基因调控草莓果实成熟的分子机理[J].西北植物学报,2015,35(12):2379-2384.
[51] PARK S Y,PETERSON F C,MOSQUNA A,et al. Agrochemical control of plant water use using engineered abscisic acid receptors[J].Nature,2015,520:545-548.

