基于质谱技术分析补骨颗粒对软骨细胞蛋白质组学的影响
余光书 林焱斌 许宏滨 李杰辉 张寿雄
【摘 要】目的:通過定量观察补骨颗粒对大鼠膝关节软骨细胞蛋白质表达的影响,探讨补肾活血中药对软骨细胞的作用机制。方法:将软骨细胞经补骨颗粒含药血清传代培养后通过定量蛋白质组学串联质谱标签标记技术进行检测,使用Maxquant(v1.5.2.8)进行检索。选择UniProt-GOA数据库注释工具对差异蛋白进行基因功能聚类GO分析;采用KEGG在线服务工具KAAS对提交的蛋白进行注释,之后通过KEGG mapper将注释过的蛋白匹配入数据库相应的通路中进行检索分析;使用预测亚细胞定位的软件wolfpsort对所提交的蛋白进行亚细胞定位注释。结果:通过数据库检索,补骨颗粒含药血清及空白血清干预软骨细胞后共鉴定到5028个蛋白质,包含25 423个肽段,其中4297个蛋白质包含定量信息。以1.3倍为变化阈值,t检验中P < 0.05为标准,空白血清组中163个蛋白表达发生上调,188个蛋白表达发生下调;补骨颗粒含药血清干预后有164个蛋白表达发生上调,58个蛋白表达发生下调。其中,具有生物学信息的目标差异蛋白有腺苷酸转位酶1、热休克蛋白27、肌浆/内质网钙ATP酶1、钠/钾转运ATP酶、果糖二磷酸醛缩酶A、3-磷酸甘油醛脱氢酶、磷酸甘油酸变位酶1、β-烯醇化酶、L-乳酸脱氢酶、糖原合成酶、肉碱棕榈酰转移酶1。结论:补骨颗粒能够影响软骨细胞的腺苷酸转位酶1、热休克蛋白27、醛缩酶A、β-烯醇化酶及肉碱棕榈酰转移酶1等表达,对于揭示软骨细胞的凋亡机制具有重要意义。
【关键词】 补骨颗粒;蛋白质组学;含药血清;软骨细胞;细胞凋亡;大鼠
【ABSTRACT】Objective:By quantitatively observing the effects of Bugu Keli(补骨颗粒)on the expression of protein in knee joint chondrocyte of rats,to explore the mechanism of medicinals of nourishing kidney and activating the circulation of blood.Methods:Chondrocytes were subcultured in medicated serum with Bugu Keli and detected by quantitative proteomics tandem mass spectrometry tagging technology.Maxquant(v1.5.2.8)was used to retrieve.UniProt-GOA database annotation tool was selected to perform gene function clustering GO analysis of differentially expressed proteins;KEGG online service tool KAAS was used to annotate the submitted proteins,and then KEGG mapper was used to match the annotated proteins into the corresponding pathways in the database for retrieval and analysis.Wolfps was used to predict subcellular localization.Results:A total of 5028 proteins,including 25 423 peptide segments were identified after the intervention of medicated serum and blank serum on chondrocyte.Among them,4297 proteins contained quantitative information.With 1.3 times as the change threshold and P < 0.05 as the standard in the t test,163 protein expressions were up-regulated and 188 protein expressions were down-regulated in the blank serum group.One hundred and sixty-four protein expressions were up-regulated and 58 protein expressions were down-regulated after the intervention of the drug-containing serum.Among them,the target differential proteins with biological information are adenylate translocatase 1,heat shock protein 27,Sarcoplasmic/endoplasmic reticulum calcium ATPase 1,sodium/potassium transporter ATPase,fructose diphosphate aldolase A,3-phosphate glyceraldehyde dehydrogenase,phosphoglycerol mutase 1,β-enolase,L-lactate dehydrogenase,glycogen synthase,and carnitine palmitoyltransferase 1.Conclusion:Bugu Keli can affect the expression of adenylate transposase 1,heat shock protein 27,aldolase A,β-enolase and carnitine palmitoyltransferase 1 in chondrocyte,which is of great significance in revealing the apoptotic mechanism of chondrocyte.
【Keywords】 Bugu Keli(补骨颗粒);proteomics;medicated serum;chondrocyte;apoptosis;rats
膝骨关节炎(knee osteoarthritis,KOA)是一种以膝关节软骨退行性变为主要病理特征的慢性骨关节疾病。目前有研究认为,软骨细胞的代谢紊乱、衰老及凋亡是KOA的主要发病机制,阻止或延缓软骨细胞凋亡是防治骨关节炎(osteoarthritis,OA)的有效途径;但是具体作用机制仍不明确,也缺乏特效治疗药物[1-2]。近年来,随着细胞衰老及凋亡机制研究的不断深入,以及蛋白质组学的不断发展,应用蛋白质组学技术研究疾病机制越来越受到重视。其中串联质谱标签(TMT)是目前主流的定量蛋白标记技术,不仅定量结果重复性高,而且可以定位线粒体蛋白、膜蛋白和核蛋白等,是目前研究疾病发生机制的重要手段。笔者基于既往临床观察发现,补骨颗粒能够有效预防KOA发展进程,因此拟应用串联质谱技术分析补骨颗粒对软骨细胞的作用机制,以期为进一步研究OA的防治机制提供参考。
1 实验材料
1.1 实验动物 成年清洁型SD大鼠40只,体质量(180±20)g,雌雄各半,动物许可证号SCXK 2016-0002,由福建医科大学实验动物中心提供。
1.2 实验试剂及药物 胶原酶Ⅱ(编号C8150)(北京市普京康利科技有限公司);DMEM培养基(编号180-500)、质量分数为0.25%的胰蛋白酶(编号TE2004Y)、胎牛血清(編号TBD11HT)(北京孚博生物科技有限公司);软骨细胞(武汉普诺赛生命科技有限公司);补骨颗粒(厦门大学附属福州第二医院药剂科)。
2 方 法
2.1 药物制备 补骨颗粒药物组成:骨碎补20 g、鹿衔草12 g、淫羊藿12 g、潞党参15 g、茯苓20 g、三七3 g、川牛膝9 g、当归9 g、川芎6 g、女贞子15 g、枸杞子9 g、生地黄15 g、甘草3 g。原药材由四川新绿色药业科技发展有限公司提供,厦门大学附属福州第二医院药剂科负责加工制备,每克颗粒药含原生药9.8 g,生理盐水加热溶解使用。
2.2 含药血清的制备 将40只成年SD大鼠随机分为空白血清组和含药血清组,每组20只。按成人与大鼠体表面积折算的等效剂量比值(系数为6.25)换算用量,空白血清组予生理盐水
2 mL·kg-1灌胃,含药血清组予补骨颗粒3.08 g·kg-1灌胃,在灌胃时将补骨颗粒用生理盐水加热溶解成1 g·mL-1的水溶液,每日1次,连续14 d。末次给药2 h后处死大鼠,并在无菌条件下腹主动脉采血5 mL,静置2 h,低温2000 r·min-1离心15 min后分离血清,于56 ℃恒温水浴灭活30 min,-80 ℃冰箱保存。
2.3 软骨细胞的培养 取第3代SD大鼠软骨细胞,消化后接种于培养皿,置于37 ℃,体积分数为5%的CO2恒温培养箱培养至贴壁,更换含血清培养基,设空白血清组及质量分数为20%的含药血清组[3],于37 ℃,体积分数为5%的CO2恒温培养箱继续孵育,直至铺满培养皿。
2.4 蛋白质提取、消化和TMT肽段标记 收集空白血清组软骨细胞及质量分数为20%的含药血清组软骨细胞,分别加入4倍体积裂解缓冲液,经超声裂解后于4 ℃环境下的离心机中以12 000 r·min-1离心10 min,将上清液转移至新的离心管中。往上清液中加入二硫苏糖醇至其浓度改变为5 mmol·L-1,并于56 ℃热水浴中还原30 min,然后加入碘代乙酰胺调整浓度为11 mmol·L-1。在室温避光条件下孵育15 min,并将溶液中的尿素浓度稀释至低于2 mol·L-1。以1∶50(胰酶∶蛋白)的质量比例加入胰酶,于37 ℃环境下酶解过夜;然后以1∶100的质量比例加入胰酶,继续于37 ℃环境下酶解4 h。待试剂解冻后用乙腈溶解,并与肽段混合后置于条件下室温孵育2 h,经除盐后将标记的肽段真空冷冻干燥保存。
2.5 HPLC分级与液相色谱-质谱联用分析 应用高pH反向HPLC法分级肽段,将分级梯度设置为8%~32%乙腈,pH调整为9,在60 min内分离为60个组分,然后将其合并为18个组分,经真空冷冻干燥后用液相色谱流动相A溶解后使用EASY-nLC 1000超高效液相系统进行分离。流动相A为含体积分数为0.1%的甲酸和体积分数为2%的乙腈水溶液;流动相B为含体积分数为0.1%的甲酸和90%的乙腈水溶液。液相梯度设置:0~26 min,9%~25% B;26~34 min,25%~36% B;34~37 min,36%~80% B;37~40 min,80% B,流速维持在700 nL·min-1。将分离后的肽段注入NSI离子源中进行电离,然后进行Q Exactive TM质谱分析。
2.6 数据库搜索及生物信息学分析 应用Maxquant (v1.5.2.8)软件检索Proteome Rat数据库中的二级质谱数据,其中酶切方式设置为Trypsin/P,漏切位点数设为2,肽段最小长度设置为7个氨基酸残基,肽段最大修饰数设为5。选择UniProt-GOA数据库注释工具对差异蛋白进行基因功能聚类GO分析。采用KEGG在线服务工具KAAS对提交的蛋白进行注释,然后通过KEGG mapper将注释过的蛋白匹配入数据库相应的通路中;使用预测亚细胞定位的软件wolfpsort对所提交的蛋白进行亚细胞定位注释。
3 结 果
3.1 蛋白质组鉴定结果 通过数据库检索,补骨颗粒含药血清及空白血清干预软骨细胞后共鉴定到5028个蛋白质,包含25 423个肽段,其中4297个蛋白质包含定量信息。以1.3倍为变化阈值,t检验以P < 0.05为标准,空白血清组中163个蛋白表达发生上调,188个蛋白表达发生下调;补骨颗粒含药血清干预后有164个蛋白表达发生上调,58个蛋白表达发生下调。
3.2 生物信息学分析 基因本论(Gene Ontology,GO)是对生物过程(biological process)、细胞位置(cellular component)和分子功能(molecular function)进行分类。在发生变化的222个蛋白中主要参与生物过程的有13种,其主要为单生物过程(15%)、细胞过程(15%)、生物调节(12%)、代谢过程(10%)及应激反应(9%);细胞位置9个,所占比例较高的前5个是细胞质(27%)、细胞器(23%)、细胞溶质(14%)、细胞膜(13%)及蛋白质复合体(9%);分子功能有8个,其中占比例较高的有离子结合(54%)、激酶活性(25%)、分子活性(6%)、转运活性(5%)与分子功能调节剂(3%)。
使用wolfpsort软件对差异表达蛋白进行亚细胞结构的预测和分类发现,细胞质中占34%,胞外基质中占23%,细胞核中占19%,线粒体中占10%,胞膜中占9%。通过KEGG代谢通路分析表明,差异蛋白共参与198个信号转导通路,其中排名前5位的代谢通路为糖酵解通路(5.73%)、碳代谢通路(5.18%)、氨基酸的生物合成通路(4.94%)、淀粉和蔗糖代谢通路(3.96%)、内质网蛋白加工通路(3.46%)。
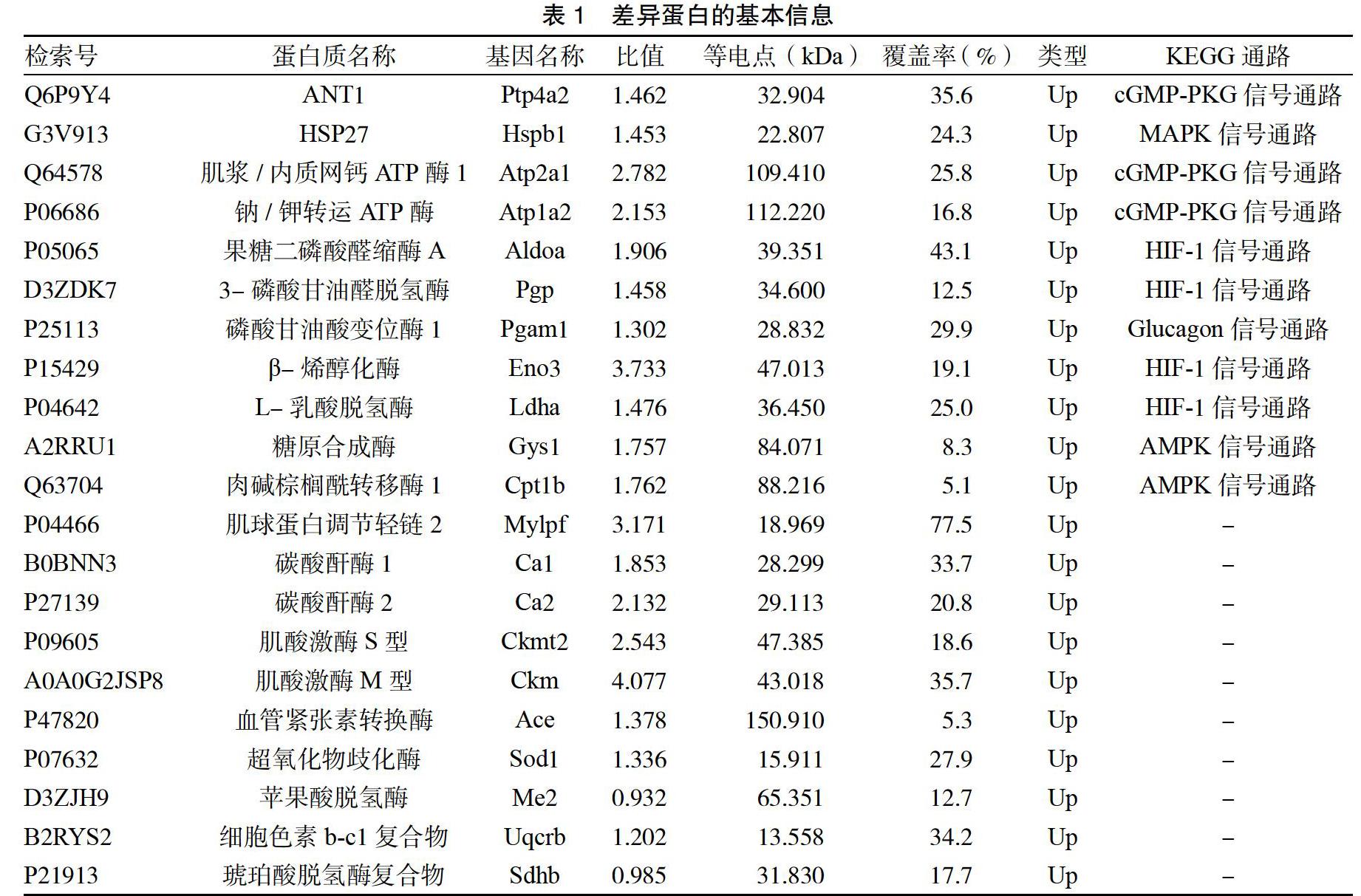
根据差异蛋白的表达量、分子功能、代谢通路和网络通路,筛选出41个差异蛋白,主要分为氧化还原酶、水解酶、裂解酶、转移酶、异构酶、大亚基结合蛋白、热休克蛋白等类别,其中筛选出的目标差异蛋白有腺苷酸转位酶1(ANT1)、热休克蛋白27(HSP27)、肌浆/内质网钙ATP酶1、钠/钾转运ATP酶、果糖二磷酸醛缩酶A、3-磷酸甘油醛脱氢酶、磷酸甘油酸变位酶1、β-烯醇化酶、L-乳酸脱氢酶、糖原合成酶、肉碱棕榈酰转移酶1,可能参与其中的蛋白有肌球蛋白调节轻链2、碳酸酐酶1、碳酸酐酶2、肌酸激酶S型、肌酸激酶M型、血管紧张素转换酶、超氧化物歧化酶、苹果酸脱氢酶、细胞色素b-c1复合物及琥珀酸脱氢酶复合物等。见表1。
4 讨 论
OA属中医学“痹证”范畴,外因多归于风、寒、湿三邪侵袭,内因多为肝肾亏损。中老年以后多有肝肾亏损,肝虚则血不养筋,筋不能维持骨节之张弛而关节失滑利;肾虚则髓减,致使筋骨均失所养,骨赘形成,关节囊纤维变性和增厚,限制关节的活动;在外邪的作用下,关节周围的肌肉因疼痛而产生保护性痉挛,使关节活动进一步受到限制,增加了退行性变的进程,关节发生纤维性强直。所以治疗上以补益肝肾、强筋壮骨为主,同时结合老年患者多瘀的特点而辅以活血化瘀中药。基于此,笔者既往选用补骨颗粒治疗肾虚血瘀型老年性OA,取得了较好疗效[4]。但是,目前仍缺乏补骨颗粒治疗OA的具体作用机制,笔者拟通过蛋白质组学方法從整体蛋白质表达的水平上阐明OA肾虚血瘀发生的本质,从而寻找补肾活血方药的作用靶点。
现代药理学研究表明,补骨颗粒中骨碎补、淫羊藿、鹿衔草、三七、当归、川芎等补肾活血中药含有的异补骨脂素、淫羊藿苷Ⅱ、蛇床子素等可以促进成骨细胞的增殖、抑制破骨细胞的吸收及炎症因子的表达,对防治OA疼痛及退行性变具有重要作用[5-7]。笔者在此基础上应用串联质谱技术分析补骨颗粒复方对软骨细胞的整体蛋白质表达情况,发现补骨颗粒能够促进软骨细胞中ANT1、HSP27及糖酵解过程相关酶等的表达,这对进一步研究KOA发病机制提供了重要线索。
ANT1是线粒体内膜的重要腺苷酸载体,是构成线粒体通透性转运孔道的主要成分,在调控线粒体内ATP协调变化及细胞凋亡方面有着重要意
义[8-9]。有文献报道,当机体处于缺氧环境时,可以通过ANT1表达减少活性氧的产生起到保护作用[10-11],并且ANT1可以降低胰岛素抵抗现象,对代谢性疾病具有重要的防护作用[12]。通过蛋白质组学研究发现,补骨颗粒干预后软骨细胞内的ANT1表达将明显增多,这或许与党参、茯苓、三七及当归等药物有关[13-15];但是补骨颗粒的成分复杂,需要今后进一步的药理学研究。
HSP27属于低分子量热休克蛋白家族之一,具有阻止应激因素引起损伤细胞的作用。在缺血、缺氧等条件下HSP27表达量将增加,并发生磷酸化与其他蛋白相互作用,在细胞的抗凋亡过程中起促进作用[16-17]。线粒体是细胞内发生氧化磷酸化的细胞器,也是介导细胞凋亡通路的重要场所,有文献报道HSP27将会抑制线粒体内氧化酶活性而降低细胞中活性氧水平,从而抑制线粒体凋亡相关蛋白的表达,在抑制细胞凋亡方面具有重要意义[18]。补骨颗粒中的骨碎补、淫羊藿、鹿衔草等补益肝肾中药可以促进成骨细胞的增殖、抑制破骨细胞的吸收[6-7],三七、当归等活血药物可以通过调控线粒体信号通路控制细胞的凋亡[14-15],这些药物合用起到抑制软骨细胞凋亡的作用;同时笔者研究也发现,补骨颗粒能够促进HSP27的表达,因此补骨颗粒可能通过HSP27表达以对抗氧化应激的保护作用而抑制软骨细胞凋亡[19]。
糖酵解过程是细胞获取能量的最重要过程,其中醛缩酶A、3-磷酸甘油醛脱氢酶、磷酸甘油酸变位酶1、β-烯醇化酶、L-乳酸脱氢酶、肉碱棕榈酰转移酶1等是糖酵解过程的重要催化酶类。笔者通过补骨颗粒含药血清干预软骨细胞后发现,这些酶类的表达较前明显增加,这或许与党参、茯苓等补气健脾中药可以提高抗氧化酶的活性、抑制脂质过氧化物的产生及增强运动能力等有关[13]。另外,糖酵解酶除了影响能量生成,还对细胞的乏氧环境具有一定的调控作用[20],可以通过增强糖酵解过程触发血管内皮生长因子生成及促进肌动蛋白丝束形成等而促进细胞增殖、分化及迁移[21],这或许与三七、当归等活血药物调控细胞的相关信号通路有关[14-15],但仍需今后进一步的研究。
综上所述,本实验通过iTRAQ定量蛋白质组学技术分析补骨颗粒对软骨细胞蛋白质表达的影响,对于揭示软骨细胞的凋亡机制具有重要意义。另外,研究还发现了可能与软骨细胞凋亡相关的蛋白质有ANT1、HSP27、醛缩酶A、β-烯醇化酶及肉碱棕榈酰转移酶1等,为KOA发病机制的研究提供了重要线索。
5 参考文献
[1] WANG GL,WU YB,LIU JT,et al.Upregulation of miR-98
Inhibits Apoptosis in Cartilage Cells in Osteoarthritis[J].
Genet Test Mol Biomarkers,2016,20(11):645-653.
[2] GON?ALVES FB,ROCHA FA,ALBUQUERQUE RP,et al.Reproducibility assessment of different descriptions of the Kellgren and Lawrence classification for osteoarthritis of the knee[J].Rev Bras Ortop,2016,51(6):687-691.
[3] 秦梦,王和鸣,娄玉钤.不同浓度骨痹舒片含药血清对体外培养软骨细胞增殖的影响[J].中国骨伤,2011,24(10):841-844.
[4] 余光书,乐立盛,卓杰,等.补骨颗粒治疗骨关节炎慢性疼痛的机制研究[J].风湿病与关节炎,2019,8(3):33-37.
[5] SUN D,YAN Q,XU X,et al.LC-MS/MS analysis and evaluation of the anti-inflammatory activity of components from BushenHuoxue decoction[J].Pharm Biol,2017,55(1):937-945.
[6] LI F,SUN X,MA J,et al.Naringin prevents ovariectomy-induced osteoporosis and promotes osteoclasts apoptosis through the mitochondria-mediated apoptosis pathway[J].Biochem Biophys Res Commun,2014,452(3):629-635.
[7] PAN L,ZHANG Y,CHEN N,et al.Icariin Regulates Cellular Functions and Gene Expression of Osteoarthritis Patient-Derived Human Fibroblast-Like Synoviocytes[J].
Int J Mol Sci,2017,18(12):2656.
[8] CARDOUAT G,DUPARC T,FRIED S,et al.Ectopic adenine nucleotide translocase activity controls extracellular ADP levels and regulates the F1-ATPase-mediated HDL endocytosis pathway on hepatocytes[J].Biochim Biophys Acta Mol Cell Biol Lipids,2017,1862(9):832-841.
[9] LI J,YAN Z,FANG Q.A Mechanism Study Underlying the Protective Effects of Cyclosporine-A on Lung Ischemia-Reperfusion Injury[J].Pharmacology,2017,100(1-2):83-90.
[10] KLUMPE I,SAVVATIS K,WESTERMANN D,et al.
Transgenic overexpression of adenine nucleotide translocase 1 protects ischemic hearts against oxidative stress[J].
J Mol Med(Berl),2016,94(6):645-653.
[11] WINTER J,KLUMPE IA,HEGER J,et al.Adenine nucleotide translocase 1 overexpression protects cardiomyocytes against hypoxia via increased ERK1/2 and AKT activation[J].Cell Signal,2016,28(1):152-159.
[12] KENNY HC,RUDWILL F,BREEN L,et al.Bed rest and resistive vibration exercise unveil novel links between skeletal muscle mitochondrial function and insulin resistance[J].Diabetologia,2017,60(8):1491-1501.
[13] ZHENG YS,WU ZS,NI HB,et al.Codonopsis pilosula polysaccharide attenuates cecal ligation and puncture sepsis via circuiting regulatory T cells in mice[J].
(下轉第35页)
(上接第9页)
Shock,2014,41(3):250-255.
[14] ZHOU L,ZHOU C,FENG Z,et al.Triptolide-induced hepatotoxicity can be alleviated when combined with Panax notoginseng saponins and Catapol[J].J Ethnopharmacol,2018,214(1):232-239.
[15] ZHUANG C,XU NW,GAO GM,et al.Polysaccharide from Angelica sinensis protects chondrocytes from H2O2-induced apoptosis through its antioxidant effects in vitro[J].Int J Biol Macromol,2016,87(6):322-328.
[16] XIONG B,LI M,XIANG S,et al.A1AR-mediated renal protection against ischemia/reperfusion injury is dependent on HSP27 induction[J].Int Urol Nephrol,2018,50(7):1355-1363.
[17] HE K,XIA L,ZHANG J,et al.LPS ameliorates renal ischemia/reperfusion injury via HSP27 up-regulation[J].
Int Urol Nephrol,2018,50(3):571-580.
[18] ZHANG HL,JIA KY,Sun D,et al.Protective effect of HSP27 in atherosclerosis and coronary heart disease by inhibiting reactive oxygen species[J].J Cell Biochem,2019,120(3):2859-2868.
[19] ZOU S,LIAO M,YANG J,et al.Heat shock protein 27 plays a protective role in thoracic aortic dissection by promoting cell proliferation and inhibiting apoptosis[J].Cell Mol Biol Lett,2017,22(1):24-28.
[20] WEN YA,ZHOU BW,LV DJ,et al.Phosphoglycerate mutase 1 knockdown inhibits prostate cancer cell growth,migration,and invasion[J].Asian J Androl,2018,20(2):178-183.
[21] ZHANG D,JIN N,SUN W,et al.Phosphoglycerate mutase 1 promotes cancer cell migration independent of its metabolic activity[J].Oncogene,2017,36(20):2900-2909.
收稿日期:2019-02-09;修回日期:2019-05-11

