食管鳞癌组织中miRNAs差异表达谱的筛选及研究
杨雅娟 李静 朱琳 石俊杰 乔冠恩

摘要:目的 筛选并鉴定在食管鳞癌(ESCC)及癌旁组织中miRNAs的差异表达,为进一步阐明其在ESCC发病机制中的作用奠定基础。方法 选取在邯郸市第一医院行食管癌切除术患者新鲜的鳞癌组织及癌旁正常组织,各3例,抽提总RNA,利用miRNAs芯片筛选其中差异表达的miRNAs,并对miR-106b-3p通过进一步RT-qPCR 技术进行验证。结果 miRNAs芯片從配对组织中共筛检出62个差异表达的miRNAs,其中41个miRNAs表达上调,21个miRNAs表达下调,鳞癌组织与癌旁正常组织中差异表达的miRNAs比较,差异有统计学意义(P<0.05)。miR-106b-3p在ESCC组织中的表达高于癌旁组织,差异有统计学意义(P<0.05),与芯片结果一致。结论 食管鳞癌组织中miRNAs的差异表达为进一步研究miRNAs在ESCC发病中的作用奠定了基础;miR-106b-3p的高表达可能与ESCC的发生、发展有关。
关键词:食管鳞癌;miRNAs芯片;microRNAs
中图分类号:R735.1 文献标识码:A DOI:10.3969/j.issn.1006-1959.2019.20.018
文章编号:1006-1959(2019)20-0063-04
Screening and Study of Differential Expression Profiles of miRNAs in
Esophageal Squamous Cell Carcinoma
YANG Ya-juan1,LI Jing1,ZHU Lin2,SHI Jun-jie3,QIAO Guan-en1
Abstract:Objective To screen and identify differential expression of miRNAs in esophageal squamous cell carcinoma (ESCC) and adjacent tissues, and to lay the foundation for further elucidation of its role in the pathogenesis of ESCC.Methods Fresh squamous cell carcinoma and adjacent normal tissues were obtained from patients with esophageal cancer resection in the First Hospital of Handan City, 3 cases were extracted, total RNA was extracted, and miRNAs were used to screen differentially expressed miRNAs, and miR-106b-3p was used. Verification by further RT-qPCR technology.Results A total of 62 differentially expressed miRNAs were screened from the paired tissues by miRNAs. Among them, 41 miRNAs were up-regulated, 21 miRNAs were down-regulated, and miRNAs were differentially expressed in squamous cell carcinoma and adjacent normal tissues,the difference was statistically significant (P<0.05). The expression of miR-106b-3p in ESCC tissues was higher than that in adjacent tissues,the difference was statistically significant (P<0.05), which was consistent with the chip results.Conclusion The differential expression of miRNAs in esophageal squamous cell carcinoma lays a foundation for further study of the role of miRNAs in the pathogenesis of ESCC. The high expression of miR-106b-3p may be related to the occurrence and development of ESCC.
Key words:Esophageal squamous cell carcinoma;miRNAs chip;microRNAs
食管鳞癌(esophageal squamous cell carcinoma,ESCC)是我国常见的消化道恶性肿瘤,其发病的机制尚不清楚。microRNAs(miRNAs)是一类长度在22 nt左右的非编码小RNAs,参与了人体内大部分生物学调节途径[1,2]。miRNAs能够通过其碱基序列区域与其相应靶基因mRNA的3'-非翻译区(3'-untranslated region,3'-UTR)中的互补碱基序列进行完全或不完全的互补结合,在基因的转录后阶段调控其相应靶基因mRNA的表达水平[3-5]。miRNAs芯片又称microRNAs微阵列,可同时检测数千个miRNAs的表达量,适用于miRNAs表达谱分析。本研究采用安捷伦miRNAs芯片技术筛选ESCC组织与癌旁正常组织差异表达的miRNAs,并对部分miRNA采用反转录荧光定量PCR(RT-qPCR)进行验证,为进一步研究miRNAs在ESCC发生、发展过程中的作用提供参考。
1材料与方法
1.1材料来源 选取在邯郸市第一医院行食管癌切除术患者新鲜的鳞癌组织及癌旁正常组织,各3例。所有样本均经病理组织学证实,癌组织和癌旁组织一并保存,所有患者术前均无放、化疗史。
1.2主要试剂 miRNAs芯片购自美国安捷伦公司,总RNA提取试剂盒RNAprep Pure Tissue Kit购自北京TIANGEN公司,荧光定量PCR试剂盒购自Roche Applied Science公司,反转录试剂盒购自美国Applied Biosystems公司,引物由南京金斯瑞生物公司合成。
1.3方法
1.3.1组织总RNA的提取 从液氮中取出样本,称取约0.5 g组织放入钵中研磨(先用液氮预冷),边研磨边加液氮,待组织成粉末状后转到1.5 ml离心管中,按照RNA提取试剂盒操作说明书提取总RNA。
1.3.2芯片杂交及数据分析 采用安捷伦miRNAs芯片(V21.0)及配套的检测仪器及试剂盒检测,该芯片覆盖2549个人源miRNAs。步骤如下:取100 ng 总RNA 经Cy3 荧光标记后,在杂交仪中与miRNAs芯片于55℃、20 r/min杂交 20 h,随后用GE洗脱液1和2各洗5 min,最后用芯片扫描仪扫描。扫描完成后通过Feature Extraction软件进行數据的提取,原始数据文件经Genespring标准化后进行数据分析。筛选差异表达的miRNAs,并对其进行非监督层次聚类,用热图的形式显示差异miRNAs在不同样本间的表达情况。
1.3.3反转录反应 按照试剂盒操作说明进行反转录反应,RNA量为200 ng,加反转录引物1 μl,加双蒸水至体积为11 μl,65℃孵育5 min,冰上预冷 5 min,加入反转录酶1.0 μl,RNA酶抑制剂1 μl,dNTPs 2.0 μl,5× Reaction缓冲液 4.0 μl,至总体积为19 μl,42°C孵育60 min,70°C反应10 min后立即取出冰浴冷却,合成cDNA。
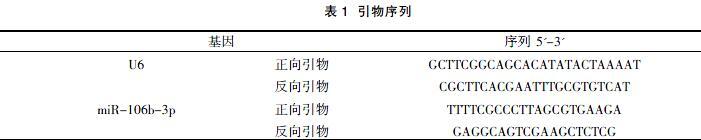
1.3.4 RT-qPCR 合成cDNA 后,以Fast Start Universal SYBR Green Master (Rox)PCR试剂盒扩增目的基因,U6为内参基因,miR-106b-3p、U6 引物序列见表1。反应体系为: cDNA 产物 1.0 μl,qPCR Mix10 μl,上游引物、下游引物各0.4 μl,余用双蒸水补齐至20 μl。扩增条件: 94 ℃预变性5 min,94℃30 s、60℃30 s、72℃30 s,40 个循环,设立 3 个复孔。根据扩增曲线得到Ct值,miRNAs含量采用相对表达量 2- △△Ct表示。
1.4统计学方法 采用GraphPad 5.0软件分析数据,计量资料用(x±s)表示,两组间比较采用t检验,P<0.05表示差异有统计学意义。
2结果
2.1组织样本总RNA质量控制 3对送检组织样本检测发现,各样本RNA在18、28 s处见明显峰值,A260/A280在1.9~2.1,表明RNA质量和纯度符合miRNAs芯片的检测要求。
2.2芯片中差异表达的miRNAs 芯片从配对组织中共筛检出62个差异表达的miRNAs,其中表达上调有:miR-106b-3p、miR-193a-5p、miR-342-5p、miR-21-3p、miR-18a-5p、miR-500a-3p、miR-186-5p、miR-148b-5p、miR-123-5p、miR-3651、miR-128、miR-29b-1-5p、miR-523-3p、miR-505-3p、miR-18b-5p、miR-361-3p、miR-664b-3、miR-26a-5p、miR-181a-3p、miR-4286、let-7d-5p、miR-29c-3p、miR-107、miR-320b、miR-320d、miR-425-5p、miR-320e、miR-92a-3p、let-7f-5p、miR-181a-5p、miR-25-3p、miR-17-5p、miR-26b-5p、miR-155-5p、miR-16-5p、miR-30b-5p、miR-15b-5p、let-7g-5p、let-7a-5p、miR-30d-5p、miR-93-5p;表达下调的有:miR-3910-5p、miR-5787、miR-6126、miR-6722-3p、miR-4631、miR-4270、miR-150-3p、miR-4327、miR-4459、miR-6090、miR-30d-5p、miR-4166、miR-1290、miR-3196、miR-6087、miR-4530、miR-4687-3p、miR-1216、miR-1275、miR-1234-5p、miR-4665-3p,对差异表达的miRNAs进行聚类分析,差异无统计学意义(P>0.05);鳞癌组织与癌旁正常组织差异表达的miRNAs比较,差异有统计学意义(P<0.05),见图1。
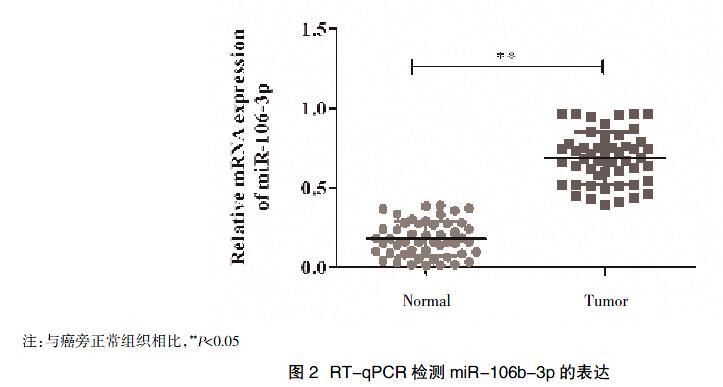
2.3 RT-qPCR技术验证 对表达上调的miR-106b-3p进行进一步验证,结果显示miR-106b-3p在ESCC组织中的表达高于癌旁组织,差异有统计学意义(P<0.05),与芯片结果一致,见图2。
3讨论
miRNAs在肿瘤中的表达与在正常组织或细胞的表达存在差异,疾病的不同阶段以及不同组织或细胞中,miRNAs的表达和作用均不同。一个miRNA能调控多个靶mRNAs的表达,多个miRNAs也能共同调控一个靶mRNA发挥作用[6]。有研究显示,通过PCR、芯片及测序等方法可发现肿瘤相关的miRNAs[7-9]。安捷伦miRNAs芯片为目前较为先进的miRNAs表达谱芯片,具有高特异性、高灵敏性及可重复性,能与高通量测序相媲美,安捷伦 HumanmiRNAs V21.0芯片能检测2549个成熟的miRNAs。
本研究通过对ESCC组织和癌旁组织中的miRNAs检测,筛选出62个差异表达的miRNAs,其中上调的有41个,下调的有21个。进一步对表达异常的miR-106b-3p采用RT-qPCR技术进行验证,结果显示miR-106b-3p在ESCC组织的表达要高于癌旁组织,与芯片结果一致,说明miRNAs 芯片能够较准确的反映各miRNA 在肿瘤样本中的表达情况。
利用miRNAs芯片技术筛选癌组织miRNAs表达谱是发现异常miRNAs的常见手段。周萍[10]的研究选取了10例ESCC新鲜冻存组织及对应的正常食管粘膜组织,采用上海康成生物有限公司代理的Exiqon公司的miRNAs表达谱芯片检测,结果显示有淋巴结转移组与无淋巴结转移组ESCC患者相比较,差异表达的miRNAs共16个,其中表达上调的miRNAs有9个,表达下调的miRNAs有7个,经RT-PCR验证,与正常黏膜组织相比,ESCC组织中miR-612表达上调,且淋巴结转移组高于无淋巴结转移组。姚丽[11]的研究对ESCC组织及正常食管黏膜组织的miRNAs表达谱统计分析,结果则显示miRNAs差异表达共43个,其中27个miRNAs表达下调,16个miRNAs表达上调;Okumura T[12]等通过芯片技术检测了多种miRNAs的差异表达,确定了miR-574-3p和miR-106b的高表达与肿瘤无复发及良好的总生存率有关,miR-106b被认为具有肿瘤抑制作用。本研究显示有41个表达上调的miRNAs,其中miR-106b-3p表达明显上调,说明通过miRNAs芯片能较好的筛选出有意义的差异表达miRNA,与上述研究结果不完全一致,分析原因可能与取材方法、疾病分期、试剂产地、异常表达标准及miRNAs的时序性等有关。
总之,食管鳞癌组织中miRNAs的差异表达为进一步研究miRNAs在食管鳞癌发病中的作用奠定了基础,miR-106b-3p的高表达可能与食管鳞癌的发生、发展有关。
参考文献:
[1]Liu B,Li J,Cairns MJ.Identifying miRNAs,targets and functions[J].Briefings in Bioinformatics,2014,15(1):1-19.
[2]Ameres SL,Zamore PD.Diversifying microRNA sequence and function[J].Nature Reviews Molecular Cell Biology,2013,14(8):475-488.
[3]Orom UA,Nielsen FC,Lund AH.MicroRNA-10a binds the 5′MUTR of ribosomal protein mRNAs and enhances their translation[J].Molecular cell,2008,30(4):460-471.
[4]Qin W,Shi Y,Zhao B,et al.miR-24 Regulates Apoptosis by Targeting the Open Reading Frame (ORF)Region of FAF1 in Cancer Cells[J].PLoS One,2010,5(2):e9429.
[5]Singh NK.miRNAs target databases:developmental methods and target identification techniques with functional annotations[J].Cellular and Molecular Life Sciences,2017,74(12):2239-2261.
[6]Fassan M,Baffa R,Palazzo JP,et al.MicroRNA expression profiling of male breast cancer[J].Breast Cancer Research,2009,11(4):R58.
[7]Syed P,Gidwani K,Kekki H,et al.Role of lectin microarrays in cancer diagnosis[J].Proteomics,2016,16(8):1257-1265.
[8]Hu B,Niu X,Cheng L,et al.Discovering cancer biomarkers from clinical samples by protein microarrays[J].Proteomics Clin Appl,2015,9(1-2):98-110.
[9]Willier S,Butt E,Grunewald TGP.Lysophosphatidic acid(LPA)signalling in cell migration and cancer invasion:A focussed review and analysis of LPA receptor gene expression on the basis of more than 1700 cancer microarrays[J].Biology of the Cell,2013,105(8):317-333.
[10]周萍.食管鳞状细胞癌转移相关miRNa-612调控P53的功能和机制研究[D].山东大学,2017.
[11]姚麗.miR-1在食管鳞状细胞癌发生中的作用及其机制的初步研究[D].第四军医大学,2015.
[12]Okumura T,Kojima H,Miwa T,et al.The expression of microRNA 574-3p as a predictor of postoperative outcome in patients with esophageal squamous cell carcinoma[J].World Journal of Surgical Oncology,2016,14(1):228.
收稿日期:2019-8-4;修回日期:2019-8-12
编辑/肖婷婷

