基因工程改造植物乳杆菌生产光学纯D-乳酸
张媛 王小艳 陈博 李义 佟毅
摘 要: 为获得高产高光学纯D-乳酸生产菌,本研究从筛选得到的一株耐高温耐高糖的植物乳杆菌出发,利用基因工程技术,敲除其中与L-乳酸合成相关的基因,引入或增强D-乳酸脱氢酶活性,构建了一株基因工程菌Lp-DA。该菌株可45℃发酵,产乳酸近200 g/L,D-乳酸光学纯度达到99.9%,为光学纯D-乳酸工业生产提供了新的菌株选择。
关 键 词:D-乳酸;植物乳杆菌;光学纯;基因敲除;基因敲入
中图分类号:TQ 78 文献标识码: A 文章编号: 1671-0460(2019)04-0674-06
Abstract: In order to obtain high-yield and high-optical pure D-lactic acid producing strain, a strain of Lactobacillus plantarum with high temperature and sugar tolerance was screened out. Starting from this strain, a genetically engineered strain Lp-DA was constructed by knocking out the genes related to L-lactic acid synthesis and introducing or enhancing the activity of D-lactic acid dehydrogenase. This strain can be fermented at 45 ℃ to produce nearly 200 g/L of lactic acid, and the optical purity of D-lactic acid can reach 99.9%. It provides a new strain option for industrial production of optical pure D-lactic acid
Key words: D-lactic acid; Lactobacillus plantarum; optical pure; gene knockout; gene knockin
聚乳酸(Poly-lactic acid,PLA)是一種以乳酸为主要原料聚合得到的聚合物,利用生物质资源作为原料,来源丰富而且可再生。聚乳酸的生产过程无污染,其产品可以生物降解,实现在自然界中的循环,与有限的石油和化石资源相比,生物质资源的优势在于不会有释放到大气中的净二氧化碳[1],因此是理想的绿色高分子材料,具有广阔的市场前景。近年来聚乳酸技术的突破提高了其力学、耐热、耐久性能及生物相容性,促进了聚乳酸在高性能、高附加值材料领域的应用拓展[2]。国内外许多研究表明聚L-乳酸和聚D-乳酸的共聚可提高其机械性能、热稳定性等,实现聚乳酸材料的改性[3,4],拓宽了聚乳酸的应用范围。
乳酸(Lactic acid)又叫α-羟基丙酸、丙醇酸,根据其结构中的手性碳原子划分为L-乳酸和D-乳酸。聚乳酸的合成需使用高光学纯度的乳酸单体作为前体。高光学纯度的D-乳酸,因其可被用来提高聚乳酸材料的性能而备受关注。利用发酵法生产乳酸具有生产成本低、产物光学纯度和安全性高、生产条件温和、污染小等优点。然而,大多数乳酸菌只能同时生产L-乳酸和D-乳酸,只有极少数的天然乳酸菌和一些模式工程菌可用于专门生产D-乳酸,这些菌株D-乳酸产量和光学纯度仍需要进行大幅度的提升,因此,在通过微生物发酵法大规模工业生产D-乳酸时,目前可选择的菌株仍然十分有限。由此,高产高光学纯度D-乳酸的发酵菌株成为该领域的研究热点。
本研究从大曲样品中筛选获得耐高温高糖的乳酸菌,并利用基因工程技术,敲除其中与L-乳酸合成相关的基因,并引入或增强D-乳酸脱氢酶的活性,构建一株高产高光学纯度的D-乳酸工程菌,达到提高D-乳酸产量和光学纯度的目的。为光学纯D-乳酸工业生产发酵菌株提供了新的选择。
1 实验部分
1.1 实验材料
1.1.1 菌株及培养条件
大肠杆菌DH5α菌株为购于全式金公司的Trans5α感受态,培养使用LB培养基,37 ℃培养,筛选用抗生素浓度为25 μg/mL 氯霉素或250 μg/mL红霉素。
植物乳杆菌Lp43#筛选自大曲样品,培养使用MRS培养基。37~45 ℃培养,筛选用抗生素浓度为10 μg/mL 氯霉素或10 μg/mL红霉素。
1.1.2 酶和试剂
EasyTaq Mix,DNA Assembly Mix,DNA marker,凝胶回收试剂盒、质粒提取试剂盒等购于全式金公司;PrimeStar DNA聚合酶购于TaKaRa公司;基因组提取试剂盒购于TIANGEN公司;限制性内切么、DNA连接酶购于NEB公司;红霉素、氯霉素等购于Solarbio公司。
1.1.3 培养基
LB培养基:胰蛋白胨10 g/L、酵母粉5 g/L、NaCl 10 g/L,pH 7.0。
MRS液体培养基:蛋白胨10.0 g/L、酵母浸粉5.0 g/L、牛肉膏10.0 g/L、葡萄糖20.0 g/L、磷酸氢二钾2.0 g/L、柠檬酸二铵2.0 g/L、无水乙酸钠5.0 g/L、硫酸锰0.25 g/L、硫酸镁0.58 g/L、吐温80 1.0 mL/L,pH 6.5;MRS固体培养基:在上述MRS液体培养基中添加琼脂20 g/L;MRS-CaCO3平板:MRS固体培养基中再加入CaCO3 10 g/L;发酵培养基:葡萄糖180~200 g/L、酵母提取物10 g/L、乙酸钠2 g/L、KH2PO4 0.5 g/L、MgSO4·7H2O 0.5 g/L、MnSO4·H2O 0.25 g/L、吐温80 1 ml/L、CaCO3 90~100 g/L,pH 6.5。
1.2 实验方法
1.2.1 菌株的分离筛选
将1 g大曲样品捣碎后用10 mL无菌生理盐水溶解,充分混匀30 min;取上述稀释液10倍梯度稀释后涂布于MRS-CaCO3平板,37 ℃培养24 h,挑取透明圈较大的菌落接种MRS培养基,37 ℃ 150 r/min培养1 h,取5 μL培养液点在MRS-CaCO3平板上,将平板放置于45 ℃培养箱中培养40 h;挑选平板中菌落生长较快并且溶钙圈较大的几个单菌落再次转接MRS培养基,37 ℃ 150 r/min培养1 h,取5 μL培养液点在MRS-CaCO3固体平板上,将平板放置于48 ℃培养箱中培养。挑选其中溶钙圈比较明显的备选菌株保存并进行发酵摇瓶实验。
将备选菌株接种MRS培养基,37 ℃ 150 r/min过夜培养获得種子液,在30 mL发酵培养基中按照10%(v/v)的比例接种上述种子液,37 ℃ 150 r/min摇床培养3~5 h让菌株生长,然后升温到45 ℃或48℃,继续以150 r/min摇床培养72 h获得发酵液。发酵结束后通过高效液相色谱检测发酵产物中的乳酸,筛选出高温高糖条件下产乳酸较快、乳酸产量较高的菌株。
1.2.2 菌株鉴定
筛选获得的菌株通过显微镜检测菌株形态,并结合16S rDNA 测序方法,鉴定菌株分类。
1.2.3 重组质粒构建
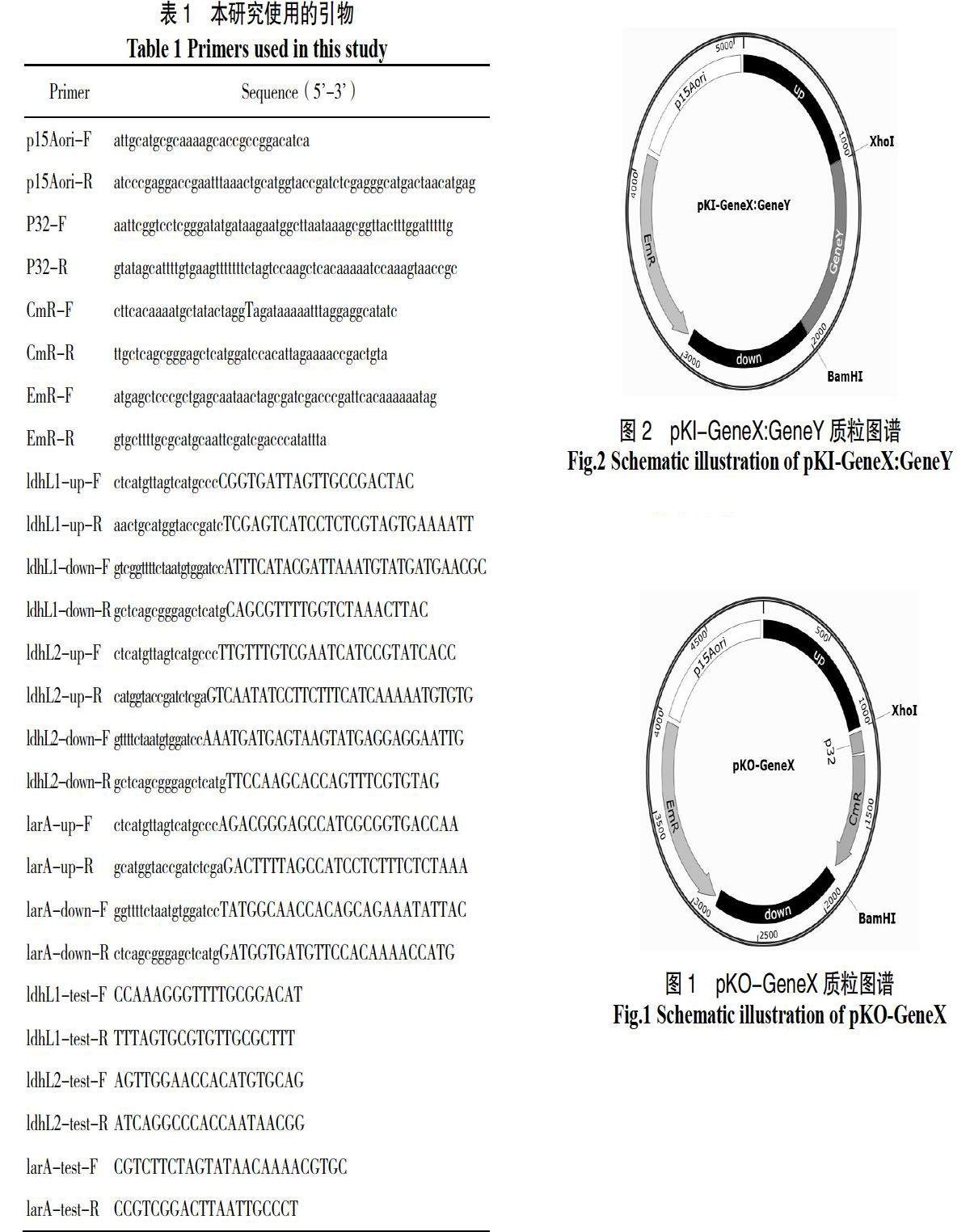
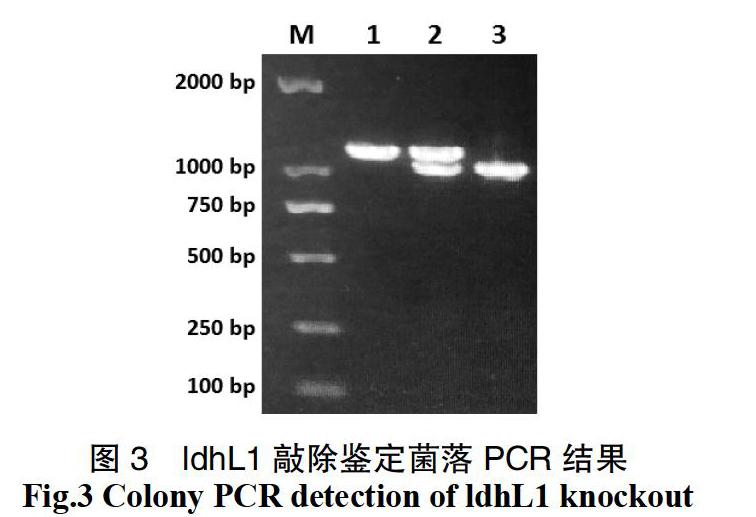
基因敲除质粒构建:使用对应引物(表1)分别扩增大肠杆菌复制子p15Aori(来自商业载体pACYC)、红霉素抗性基因EmR(来自商业载体pMG36e)、待敲除基因CDS上游1 000 bp序列(扩增自Lp43#基因组)、氯霉素启动子P32、氯霉素抗性基因CmR(来自商业载体pNZ8148)和待敲除基因CDS下游 1000 bp序列(扩增自Lp43#基因组),使用DNA Assembly重组试剂盒组装成为基因敲除质粒,转入Trans5α感受态,氯霉素和红霉素抗性,经测序鉴定,获得pKO-GeneX系列质粒,GeneX为ldhL1、ldhL2或larA(图1)。
基因插入质粒构建:分别合成待插入基因植物乳杆菌的ldhD(Gene ID:1061762)和德氏乳杆菌ldhA(Gene ID:4085369)基因的CDS序列,并在起始密码子之前和终止密码子之后分别加入XhoI和BamHI酶切位点,双酶切获得待插入基因的片段;将前面构建的pKO质粒同样用XhoI和BamHI双酶切获得去除了氯霉素抗性基因的载体片段,将经过同样双酶切并纯化后的载体和基因片段用DNA连接酶连接后,转入Trans5α感受态,红霉素抗性,经测序鉴定,获得基因插入质粒,命名为pKI-X:GeneY,GeneY为ldhD或ldhA(图2)。
1.2.4 植物乳杆菌电转化
接种平板活化的植物乳杆菌单菌落于4 mL MRS培养基中37 ℃ 150 r/min过夜培养,按初始OD600= 0.2转接至100 mL含1%甘氨酸的MRS培养基中,37℃摇床培养至OD600= 0.6;菌液冰浴20 min,4 ℃、8 000×g离心15 min收集菌体;用100 mL 4℃预冷的1 mM MgCl2和30% PEG1000依次冲洗菌体1次;用1 mL 4 ℃预冷的30% PEG1000重悬菌体,每份分装100 μL感受态。
每份感受态细胞加入5 μg重组质粒,冰浴10 min,使用0.2 cm电转杯,1.5 kV、25 F、200 Ω电击,迅速加入0.8 mL MRS-SM培养基(在MRS培养基中加入0.5 M蔗糖和0.1 M MgCl2),37 ℃培养2 h,离心1 min,去掉部分上清后重悬涂布于含抗生素的MRS平板上,37 ℃培养2 d获得单菌落。
1.2.5 基因敲除菌株筛选
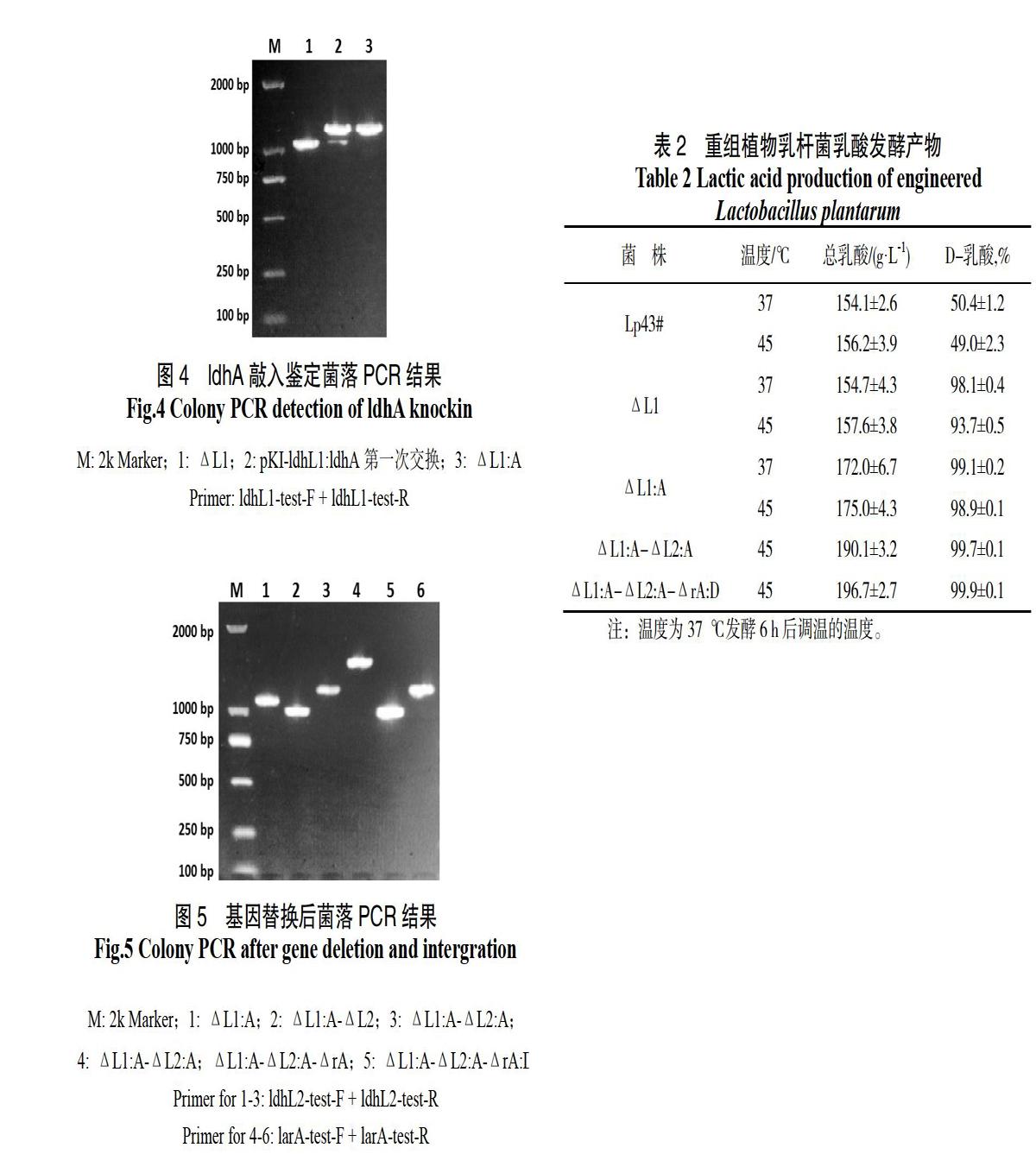
植物乳杆菌中电转化导入基因敲除质粒,氯霉素抗性筛选,并使用对应鉴定引物菌落PCR,获得有2条条带的发生了第一次交换的阳性转化子,挑选1~2个阳性转化子用含氯霉素的MRS液体培养基传代培养,每2代划线并菌落PCR筛选仅剩较小一条条带,即为第二次交换成功的菌株,经测序确认目标基因已敲除,即获得目标基因敲除的植物乳杆菌菌株。
1.2.6 基因插入菌株筛选
在植物乳杆菌敲除菌株中转入对应的基因插入质粒,红霉素抗性筛选,并使用对应鉴定引物菌落PCR,获得有2条条带的发生了第一次交换的阳性转化子,挑选1~2个阳性转化子用无抗MRS液体培养基传代培养用于筛选第二次交换的菌株,成功发生基因插入的菌株菌落PCR结果应仅剩一条偏大条带,经测序确认目标基因已插入到基因组中对应位置,即获得目标基因敲入的植物乳杆菌菌株。
1.2.7 发酵方法
将菌株接种20 mL MRS培养基,37 ℃ 150 r/min过夜培养获得种子液。然后,在100 mL产酸发酵培养基中按照10%(v/v)的比例接种上述种子液,37 ℃ 150 r/min培养6 h让菌株生长,然后维持37 ℃或升温至45 ℃,继续以150 r/min转速培养66 h获得发酵液,发酵过程中定期取样检测发酵产物。
1.2.8 产物分析
乳酸、葡萄糖等浓度检测方法:色谱仪为Agilent Technologies 1260 Infinity II;检出器RID;分离柱为Aminex HPX-87H Column 300 mm×7.8 mm;流动相0.005 M硫酸;流量0.5 mL/min;进样量20 μL。
乳酸的光学纯度检测方法:色谱仪为Agilent Technologies 1260 Infinity;检出器波长254 nm,灵敏度0.32AUFS;分离柱为MCI GEL-CRS10 W(3u)4.6 ID×50 mm;流动相0.002 M硫酸铜;流量0.5 mL/min;进样量20 μL。根据峰面积计算L-乳酸和D-乳酸的比例。
增強乳酸发酵菌株对环境胁迫的抵抗力是提高乳酸发酵能力的方向之一,本研究通过筛选,获得了耐高温、高糖的乳酸发酵菌株。利用耐高温菌株进行发酵可以缩短生产周期、减少温控所需的能耗以及减少杂菌污染的风险;而耐高糖的性能有助于简化发酵工艺,提高乳酸总产量。
采用基因工程手段对乳酸高产菌株进行改造,能进一步提高其产酸效率和乳酸的光学纯度。本研究使用同源重组的基因工程手段,敲除了植物乳杆菌中可能与L-乳酸合成相关的基因,并在同一位点替换了外源或内源的D-乳酸脱氢酶基因,进一步提高其活性。发酵结果分析认为,敲除菌株ldhL1、ldhL2、larA基因后,阻断了代谢途径中可能的L-乳酸代谢,同时,菌株的乳酸积累不受这几个基因缺失的影响,表明该植物乳杆菌的乳酸代谢过程中,乳酸脱氢酶的种类不是乳酸产量的限制因素。并且增加的D-乳酸脱氢酶活性更有助于提高D-乳酸的合成能力。改造后菌株与野生菌株相比,在乳酸产量和乳酸光学纯度方面均有大幅提升。
同源重组方法是基因组改造的常用手段,产生的变化仅存在于基因组中,因此构建的突变体具有较高的遗传稳定性。并且最终的菌株没有选择标记和质粒残留,可避免常规基因工程菌培养体系复杂等问题,安全性较高,也便于对菌株进行进一步的代谢途径改造。
最终获得的菌株Lp-DA可在45 ℃条件下发酵大量生产乳酸,并且仅合成D-乳酸,该重组D-乳酸生产植物乳杆菌提供了满足光学纯D-乳酸工业生产的新选择。当然,新菌株的工业应用还需要与菌株特性相适应的高效发酵工艺和低能耗的提取精制工艺,才能让D-乳酸的发酵生产更具竞争力。
参考文献:
[1] Hofvendahl, K, Hahn-Hagerdal B. Factors affecting the fermentative lactic acid production from renewable resources[J]. Enzyme Microb.Technol, 2000, 26:87–107.
[2] Lasprilla AJ, Martinez GA, et al. Poly-lactic acid synthesis for application in biomedical devices-A review[J]. Biotechnology Adv., 2012, 30(1):321–328.
[3] Ouchi T, Ichimura S, Ohya Y. Synthesis of branched poly(lactide) using polyglycidol and thermal, mechanical properties of its solution-cast film[J]. Polymer,2006, 47(1):429–434.
[4] Tsuji H. Poly(lactide) stereocomplexes: formation, structure, properties, degradation, and applications[J]. Macromolecular Bioscience, 2005, 5(7): 569–597.
[5] Zheng Z, Sheng B, et al. Relative catalytic efficiency of ldhL- and ldhD–encoded products is crucial for optical purity of lactic acid produced by Lactobacillus strains[J]. Appl Environ Microbiol, 2012, 78:3480-3.
[6] Siezen RJ, Francke C, et al. Complete resequencing and reannotation of the Lactobacillus plantarum WCFS1 genome[J]. J Bacteriol, 2012, 194:196-6.
[7] Okano K, Zhang Q, et al. Efficient production of optically pure D-lactic acid from raw corn starch by using a genetically modified L-lactate dehydrogenase gene-deficient and alpha-amylase-secreting Lactobacillus plantarum strain[J]. Appl Environ Microbiol, 2009, 75:462-7.
[8] Desguin B, Goffin P, et al. Lactate racemase is a nickel-dependent enzyme activated by a widespread maturation system[J]. Nat Commun,2014, 5:3615.
[9] Razeto A, Kochhar S, et al. Domain closure, substrate specificity and catalysis of D-lactate dehydrogenase from Lactobacillus bulgaricus[J]. J Mol Biol,2002, 318

