基于高通量测序的不同窖龄窖泥微生物结构与多样性分析
张应刚,邓 宇
(农业部沼气科学研究所,农业部农村可再生能源开发利用重点实验室,成都 610041)
浓香型白酒是指以高粱、大米、玉米等粮谷为原料,经固态发酵、蒸馏、陈酿、勾兑而成,具有以己酸乙酯为主体香的白酒。浓香型白酒的风格特征主要为“窖香浓郁,绵甜醇厚,香味协调,回味悠长”[1],其产量占据了我国每年白酒总产量的70%以上[2]。浓香型白酒的香气成分主要来源与大曲微生物、糟醅微生物、窖泥微生物以及生产环境中微生物代谢产生,其中浓香型白酒中的窖香主要来源于窖泥微生物产生[3]。窖泥作为浓香型白酒发酵过程中微生物栖息的主要生态环境之一,常年处于低pH值、高水分、高静压、兼性厌氧的窖池中,这给窖泥微生物的生长、优化提供了特殊的栖息环境[4]。
近年来,随着现代生物技术的快速发展,研究者们大量利用DGGE指纹图谱技术[5]、荧光定量PCR[6-8]、,16S rRNA基因克隆测序和高通量测序技术等多种技术手段[9-11]对不同产区、同一窖泥的不同位置以及不同窖龄的窖泥微生物进行微生物多样性和生态学研究。不同窖龄、不同产区以及同一产区的环境因子与微生物的群落结构有明显不同[12-14],这些不同能够影响窖泥中的微生物的相互作用关系,也能影响浓香型白酒的香味物质成分和含量。本章通过利用高通量测序技术对不同窖龄窖泥样品(5年、25年、70年)进行分析,进一步的了解不同窖龄窖泥细菌和古菌的微生物的组成和微生物多样性变化。
1 材料与方法
1.1 材料与试剂
材料(只标注主要的):四川成都某酒厂不同窖龄窖泥样品(5年、25年、70年);QIAGEN PowerSoil®DNA Isolation Kit,German;无水乙醇,化学纯,国药;Na2HPO4,KH2PO4,NaCl,KCl,SIGMA-ALDRICH。
1.2 仪器与设备
HVE-50高压灭菌锅:Hirayama;Centrifuge 5418 台式离心机:eppendorf;PowerPac 电泳仪:Bio-Rad;QL-901 微型漩涡混合器:江苏南海市某仪器制造有限公司;GL150 金属浴:江苏南海市某仪器制造有限公司;LX-200 手掌型离心机:江苏南海某仪器制造有限公司;NanoDrop ND-1000 微量紫外可见分光光度计:Nanodrop。
1.3 方法
1.3.1 DNA提取
窖泥样品的DNA的提取采用QIAGEN PowerSoil®DNA Isolation Kit,具体的实验步骤参见说明书。对提取的DNA纯度和浓度检测利用nano测定仪进行测定,直接读出DNA的浓度,主要对260 nm,280 nm处的吸光值进行分析,以A260/A280的比值作DNA纯度的衡量标准。
1.3.2 PCR扩增以及高通量测序
用检测后的合格的基因组DNA稀释后作为模板,PCR 扩增采用细菌16S V3+V4可变区的引物341F (5’-CCTAYGGGRBCGASCAG-3’)和806R (5’-GGACTACNNGGGTATCTAAT-3’),古菌的V4+V5的可变区的引物519F (5’-CAGCCGCCGCCGCGGTAA-3’)和915R (5’-GTGCTCCCCCGCCAATT CCT-3’),并且使用带Barcode的特异引物,New England Biolabs 公司的 Phusion®High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR,确保扩增效率和准确性。PCR 扩增反应程序:98 ℃预变性1 min;30个循环包括(98 ℃变性10 sec;50 ℃退火30 sec;72 ℃扩增30 sec);72 ℃再延伸5 min。采用Bio-rad T100 梯度PCR 仪扩增,根据PCR 产物浓度进行等浓度混样,充分混匀后使用1×TAE 浓度2%的琼脂糖胶电泳纯化PCR 产物,割胶回收目标条带。使用TruSeq®DNA PCR-Free Sample Preparation Kit 建库试剂盒进行文库的构建,构建好的文库经过Qubit 定量和文库检测,合格后,使用HiSeq进行上机测序。
1.3.3 数据分析
使用Cutadapt软件过滤和按barcode拆分样本后,进行OTUs(Operational Taxonomic Units)聚类和物种分类分析。根据OTUs聚类结果,一方面对每个OTU的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况。同时,对OTUs进行丰度、Alpha多样性计算、Venn图和花瓣图等分析,得到样品内物种丰富度和均匀度信息、不同样品或分组间的共有和特有OTUs信息等。另一方面,对OTUs进行多序列比对并构建系统发生树,并进一步得到不同样品和分组的群落结构差异,通过PCoA和PCA,NMDS等降维图和样品聚类树进行展示。通过Simper定量分析物种对组间差异的贡献度。为进一步挖掘分组样品间的群落结构差异,选用T-test,MetaStat,LEfSe,Anosim和MRPP等统计分析方法对分组样品的物种组成和群落结构进行差异显著性检验。
2 结果与分析
2.1 窖泥样品微生物多样性分析
对3个不同窖龄的窖泥的OUT数、Chao1指数和Shannon指数进行比较分析(见表1),在5年,25年,70年3个不同年代的窖池窖泥中分别检测到507,443,530个细菌OUT和19,15,17个古菌OUT,随着窖龄的增加,窖泥微生物的OUT数呈现一个先降低再增加的趋势。
在不同的窖龄的窖池中,菌群的shannon index有比较明显的差异,并与窖龄的变化趋势呈负相关,随着窖龄的增加,窖泥的细菌和古菌多样性降低。而从chao 1数据来看,随着窖泥窖龄的增加,窖泥中细菌的总物种数增加,古菌的总物种数先降低后增加。窖泥在经过长时间的周期性的开窖、封窖发酵的周期性过程,窖泥中的物种多样性降低,细菌的总物种数有一定的增加,古菌的总物种数会降低而后轻微增加。这跟邓杰[15-16]、施思[4]等结果有差异。新窖泥中含有很多杂菌,随着窖泥老化过程的进行,杂菌减少,微生物多样性降低,而适应窖泥环境的优势物种被大量富集。老窖出好酒,老窖酿造的浓香型白酒香气成分协调,本结果表明随着窖泥的长时间的驯化,优势细菌的富集可能跟窖泥质量和白酒香气成分的种类和含量有密切的联系。
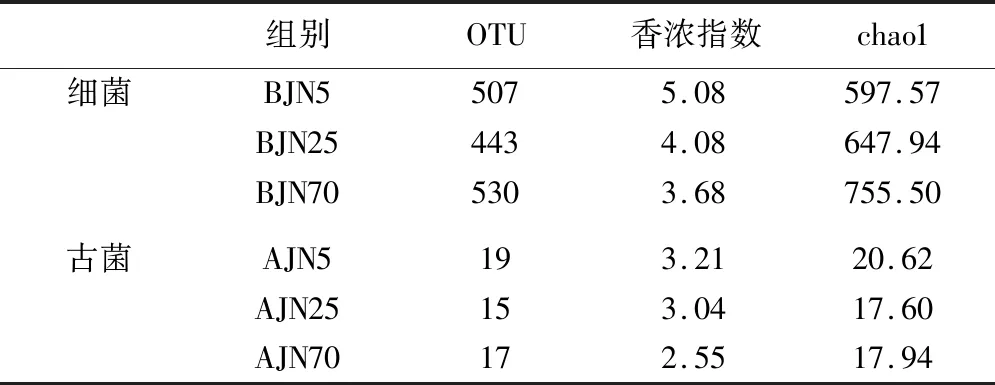
表1 不同窖龄窖泥的细菌和古菌群落多样性指数
2.2 Beta 多样性
根据聚类分析显示,细菌的主成分1(PC1)和主成分2(PC2)的样品差异性贡献率分别达到了22.1%和14.4%(见图1)。3个不同窖龄窖泥的细菌均分布在PC1和PC2的区域内,并且每个年代窖泥样品的细菌很好的集中在一个簇,3个年代窖泥的细菌分布在3个不同的簇中。古菌的主成分1(PC1)和主成分2(PC2)的样品差异性贡献率分别达到了29.3%和15.33%(见图2)。同样的,不同窖龄窖泥的古菌分布在3个不同的簇中,并且相对集中。结果表明同意窖龄窖泥的微生物能够很好的集中在一个簇中,组内群落结构相似。不同窖龄窖泥的微生物分布在不同的3个簇中,组间的主成分差异显著,细菌和古菌的群落结构发生了显著的变化。窖泥的微生物群落结构跟窖泥的窖龄有显著的关系。
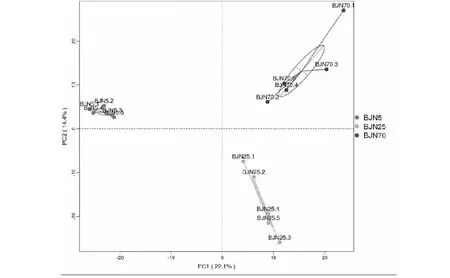
图1 细菌群落的主成分分析
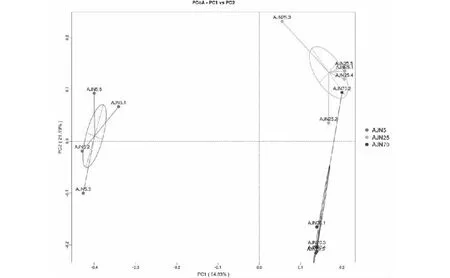
图2 古菌群落的主成分分析(3D-PCA)
2.3 细菌群落分布特征分析
2.3.1 不同窖龄窖泥细菌群落在门水平上的组成
基于16s高通量测序的序列数据分析表明,3个不同年代,15个窖泥样品中细菌主要分布在28个门,40个纲,86个目,159个科和349个属。这些细菌主要分布在厚壁菌门(Firmicutes)、变形杆菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、Cloacimonetes、放线菌门(Actinobacteria)、柔膜菌门(Tenericutes)、互养菌门(Synergistetes)、生氧光细菌门(Oxyphotobacteria)、疣微菌门(Verrucomicrobia)和 Armatimonadetes等多个门类。在5年窖龄窖泥中,占优势的微生物主要分布在厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria),其相对丰度分别为53.17%,41.89%和3.6%。在25年窖龄窖泥中,占优势的物种主要分布在厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和Cloacimonetes,相对丰度分别为70.88%,22.91%和3.86%。而在70年窖龄窖泥中,主要的微生物分布在厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria),相对丰度分别为88.75%,4.14%和2.77%(见图3)。
结果表明,从门的分类水平来看,伴随着窖泥老化的过程,厚壁菌门(Firmicutes)的相对丰度增加,相对丰度从53.17%增加到88.75%。在5年窖龄窖泥中占有非常高的丰度的变形杆菌门(Proteobacteria)随着窖泥老化的过程,相对丰度降低,在25年和70年丰度仅仅只有0.56%和0.9%。在窖泥中,变形杆菌门(Proteobacteria)随着时间的增长,逐渐被淘汰。而在25年中相对丰度较高的拟杆菌门(Bacteroidetes),在窖泥老化的前期相对丰度有很明显的富集,伴随着窖泥的老化完成,在70年窖泥中,相对丰度逐渐变化为4.14%。窖泥的老化主要是厚壁菌门(Firmicutes)不断富集的过程。
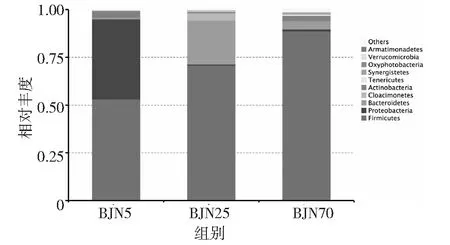
图3 不同窖龄样品细菌门水平分布
2.3.2 不同窖龄窖泥细菌群落在属水平上的组成
为了对不同窖龄窖泥功能微生物的变化进一步的分析,对3个年代的样品的细菌的相对丰度进行统计。结果显示,在3个不同窖龄窖泥样品中,主要的优势物种为产己酸菌属(Caproiciproducens)、阿姆莫利菌属(Ampullimonas)、三角菌属(Petrimonas)、乳酸杆菌属(Lactobacillus)、Anaerocella、产乙酸嗜蛋白菌属(Proteiniphilum)、曲杆菌属(Curvibacter)、高温放线菌属(Thermoactinomyces)(见图4),这些微生物主要代谢产生乙酸、丁酸、乳酸、乙醇、己酸以及精氨酸等白酒重要的风味物质或者风味物质的前体物质[17-24]。5年窖龄窖泥中主要的细菌为阿姆莫利菌属(Ampullimonas)、乳酸杆菌属(Lactobacillus)和曲杆菌属(Curvibacter),相对丰度分别为27.66%、13.94和5.98%。而在25年窖龄窖泥中,主要的优势细菌为产己酸菌属(Caproiciproducens)(40.40%)、理研菌属(Petrimonas)(12.70%)和产乙酸嗜蛋白菌属(Proteiniphilum)(5.06%)。在70年窖龄窖泥中,优势细菌为产己酸菌属(Caproiciproducens)(24.49%)和乳酸杆菌属(Lactobacillus)(2.78%)。
在5年窖龄中绝对的优势物种Ampullimonas、Lactobacillus,随着窖龄的增加,相对丰度显著减少,在25年窖泥中丰度仅有0.15%和1.17%,随着窖龄进一步增加,丰度略微有所提升,丰度为0.24%和2.77%。Ampullimonas为好氧菌,Ampullimonas丰度的降低,跟窖泥的厌氧环境有关。乳杆菌是窖泥中的重要微生物,代谢产生的乳酸浓香型白酒的香味物质和香味物质的前体物质。并有研究认为,在早期窖泥中,高丰度的Lactobacillus及其代谢产物可能在维护与保持窖泥低 pH 环境,抑制杂菌,驯化有益菌方面发挥重要作用[25]。值得注意的是,5年窖龄窖泥中丰度仅有2.53%的Caproiciproducens随着窖龄的增加,丰度增加,在25年和70年窖龄中都是绝对的优势物种,在25年和70年窖龄窖泥中,相对丰度为40.40%和 24.49%。Caproiciproducens是一株代谢能够产生氢气、丁酸和己酸的一类细菌,在成熟窖泥中如此高的丰度,可能为浓香型白酒提供了最重要的香味物质己酸乙酯提供前体物质己酸[19]。一般和产甲烷古菌互营的Syntrophomonas随着窖泥窖龄的增加,丰度也有明显的增加,丰度从0.07%增加到了1.29%,随着窖龄进一步的增加,丰度又减少到了0.47%。Syntrophomonas能够降解长链脂肪酸或丁酸产生氢气、乙酸、丙酸[26]。
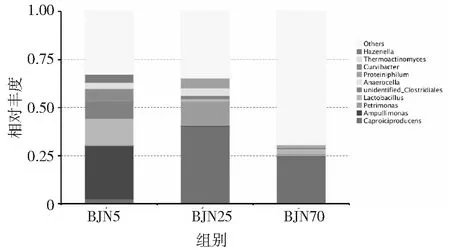
图4 不同窖龄样品细菌属水平分布
2.4 古菌群落分布特征分析
2.4.1 不同窖龄窖泥古菌群落在门水平上的组成
在窖泥样品中,古菌的微生物群落变化相对简单。3个不同年代,15个窖泥样品中古菌主要分布在3个门,8个纲,11个目,14个科和21个属。这些古菌主要分布在广古菌门(Euryarchaeota)、奇古菌门(Thaumarchaeota)、泉古菌门(Crenarchaeota)和未分类的门内。5年窖龄窖泥中的古菌多样性相对比较丰富,除了分布在广古菌门(Euryarchaeota)外,还分布在奇古菌门(Thaumarchaeota)、泉古菌门(Crenarchaeota)和一些未分类的门内。25年窖龄窖泥中的古菌多样性很单一,只分布在广古菌门(Euryarchaeota)内。而70年窖龄窖泥中的古菌分布在广古菌门(Euryarchaeota)和泉古菌门(Crenarchaeota)。其中在3个年代的窖龄样品中都占有最高丰度的广古菌门(Euryarchaeota)在5年、25年和70年窖龄窖泥中分别占了96.50%,100%和99.81%(见图5)。
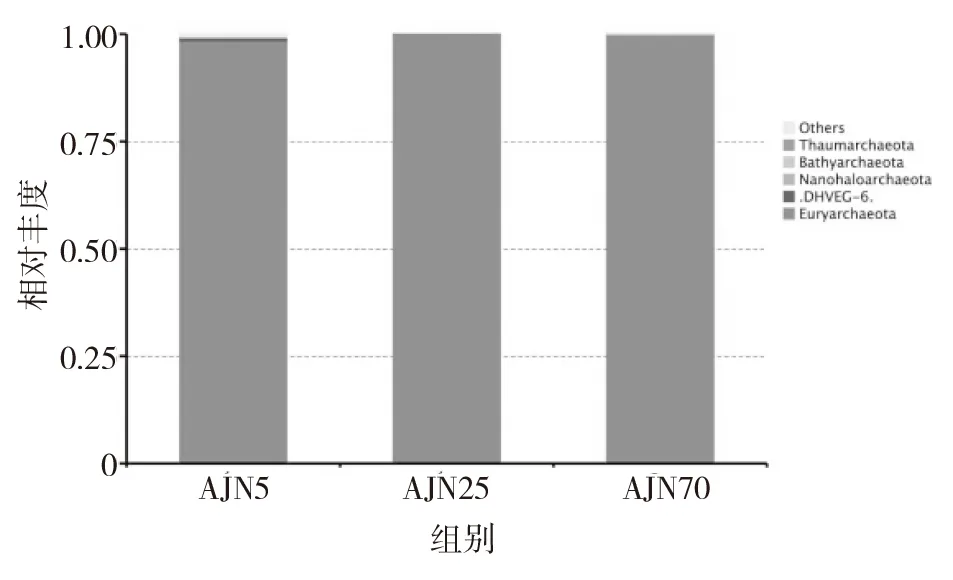
图5 不同窖龄样品古菌门水平分布
2.4.2 不同窖龄窖泥古菌群落在属水平上的组成
在属的水平上,采用细菌多样性的分析方法,得到了3个不同样品的古菌的相对丰度图,结果表明,古菌的优势物种主要有Candidatus_Methanoplasma,Methanobacterium,Methanobrevibacter,Methanosarcina,Methanoculleus,Methanocorpusculum,Methanosaeta和Methanocella。5年窖龄窖泥中优势古菌微生物为Methanobacterium,Methanobrevibacter,Methanosarcina和Methanoculleus,相对丰度分别为13.06%,26.39%,22.56%和9.36%。在25年窖龄窖泥中,优势古菌微生物为Candidatus_Methanoplasma,Methanobacterium和Methanoculleus,相对丰度分别为27.71%,30.15%和23.48%。而在70年窖龄窖泥中,优势古菌微生物主要为Candidatus_Methanoplasma,Methanobacterium和Methanobrevibacter,相对丰度分别为36.97%,25.94%和21.67%(见图6)。
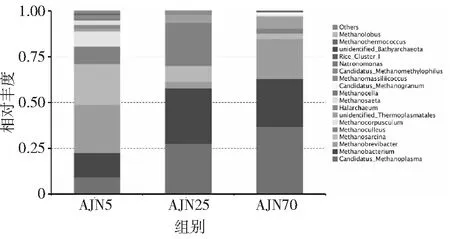
图6 不同窖龄样品细菌属水平分布
随着窖泥窖龄的增加,Candidatus_Methanoplasma不断富集,在70年窖龄窖泥中,丰度高达36.97%,Candidatus_Methanoplasma丰度显著提高,表明其可能在老窖泥中的重要地位。在5年窖龄窖泥中的优势物种Methanosarcina随着窖龄的增加丰度逐渐降低,在25年和70年窖龄的窖泥中丰度仅有8.90%和3.25%。Methanocorpusculum和Methanocella随着窖龄增加,丰度逐渐降低,到70年窖龄中,基本被淘汰。从代谢水平上看,窖泥中的主要优势产甲烷古菌都是多种营养类型的产甲烷古菌,主要利用氢气和甲基类化合物,而只能以乙酸作为底物的Methanosaeta在所有窖龄窖泥中都不是优势古菌[27],丰度极低。值得注意的是,窖泥中的优势产甲烷古菌大多还能利用甲醇作为底物,窖泥中甲基营养型产甲烷古菌还可能对浓香型白酒的质量有着重要的关系。Candidatus_Methanoplasma和Methanosarcina在随着窖龄的增加有明显的正负相关性,或许可以作为新老窖泥判断的标准。
笔者发现窖泥中的Caproiciproducens是丰度最高的具有产己酸能力的细菌,H2是其的主要代谢副产物,并且窖泥中的氢营养型的Methanobacterium与Caproiciproducens在窖泥中随年代的增加有同步变化的趋势。这为前人提出的甲烷古菌常和产己酸菌互营,并通过种间“氢转移”作用解除氢抑制,从而使反应向有利于产生己酸的方向进行的假说提供了有力的证据[28]。
3 结论
通过 16S r RNA 高通量测序解析四川成都某酒厂的3个不同年代的窖泥样品的细菌和古菌的群落结构,研究结果表明:
(1)窖泥微生物主要分布28个细菌门和3个古菌门,厚壁菌门、变形杆菌门和放线菌门为优势的细菌门,古菌主要分布在广古菌门。
(2)窖泥的优势微生物随着窖龄的增加发生明显的变化。随着窖龄的增加,优势微生物从Ampullimonas和Lactobacillus变为具有产己酸能力的Caproiciproducens。
(3)窖泥中主要都是利用H2、甲酸、甲醇的产甲烷古菌,而利用乙酸的乙酸营养型产甲烷菌不是窖泥中的优势物种。甲基营养型的产甲烷古菌可能对浓香型白酒的质量有着非常重要的关系。Candidatus_Methanoplasma和Methanosarcina在随着窖龄的增加有明显的正负相关性,或许可以作为新老窖泥判断的标准。
(4)窖泥中的氢营养型的Methanobacterium与Caproiciproducens在窖泥中随年代的增加有同步变化的趋势。这为前人提出的甲烷古菌常和产己酸菌互营,并通过种间“氢转移”作用解除氢抑制,从而使反应向有利于产生己酸的方向进行的假说提供了有力的证据。

