不同年龄HR-HPV病检结果在宫颈癌筛查中的价值
戈文舜,钱洁芳,任丽芳,李美平,蔡红光,杨惠英,包 磊
(绍兴市妇幼保健院病理科,浙江 绍兴 312000)
高危型人乳头瘤病毒(HR-HPV)持续感染是引起子宫颈癌及癌前病变的主要因素,其中HPV16和/或18型(HPV16/18)在世界范围内引起70%的子宫颈癌[1]。为促进我国子宫颈癌防控工作的开展,2015年国家卫生计生委妇幼健康服务司委托中华预防医学会妇女保健分会组织制定了《子宫颈癌综合防控指南》,并于2017年8月出版发行。该《指南》内容涵盖子宫颈癌的一、二、三级预防策略。作为我国二级预防的宫颈癌筛查方法,包括细胞学筛查方法、醋酸染色肉眼观察法和HPV检测技术,各地区有所不同。2017年浙江地区宫颈癌筛查中初筛策略已经从液基细胞学转变为HPV分型检测,对HPV16/18型阳性患者直接行阴道镜检查,其它HPV阳性者用细胞学分流[≥意义不明的非典型鳞状细胞(ASCUS)者行阴道镜检查]。本研究旨在评估不同年龄组HR-HPV阳性者阴道镜病理检查结果,研究其在宫颈癌筛查中的价值,从而为本地区女性宫颈癌筛查策略提供理论依据。
1资料与方法
1.1临床资料
2017年1月至12月在绍兴市妇幼保健院门诊就诊检测HR-HPV者16 510例(阳性者2 323例,阴性者14 187例),HPV16/18型阳性者742例,其他12型HR-HPV阳性者1 581例,有阴道镜组织学活检病例908例(HPV16型220例、HPV18型82例、其他12型HR-HPV 472例、HR-HPV阴性134例),年龄为18~77岁,平均年龄为(40.5±10.3)岁。所有研究对象均知情同意参与研究。
1.2研究方法
1.2.1 HPV分型检测
采用罗氏公司生产的cobas 4800HPV检测系统,检测原理是基于PCR反应结合不同荧光染料的探针检测高危型,可检出HPV16、18型及其他12型高危型HPV(31、33、35、39、45、51、52、56、58、59、66、68)。试剂全部来自罗氏公司生产的配套试剂盒,按照试剂盒说明书进行操作。
1.2.2阴道镜下宫颈组织学病理检查
HPV16/18型阳性者或其他12型HR-HPV阳性且≥ASCUS[除未见上皮内病变或恶性细胞(NILM)外所有细胞学异常病例]者行阴道镜检查,并对有可疑病变患者行子宫颈多点活检和/或宫颈管内膜搔刮术。根据组织学病理检查结果,诊断为炎症、低级别鳞状上皮内病变(LSIL)、高级别鳞状上皮内病变(HSIL)、原位腺癌(AIS)、腺癌(AC)、鳞癌(SCC),≥HSIL包括后四者。在不同年龄组(≤30岁、31~40岁、41~50岁、51~60岁、≥61岁)下,观察患者感染状况,并与相应病理检查结果进行比较。组织学切片由三位高年资病理医生复阅全部病理切片,至少两位医师意见一致则确定为最后诊断。诊断标准参照2014年WHO女性生殖系统肿瘤病理学和遗传学分类标准。
1.3统计学方法
运用SPSS 13.0统计软件分析数据,计数资料采用χ2检验和χ2分割法,以P<0.05为差异有统计学意义。
2结果
2.1不同年龄组HR-HPV阳性人群感染状态及宫颈病变分布
HR-HPV总感染阳性率为14.07%(2 323/16 510),HPV16型阳性率占3.34%(552/16 510),HPV18型阳性率占1.15%(190/16 510),其他12型阳性率占9.58%(1 581/16 510);病理诊断炎症占47.67%(369/774),LSIL占24.55%(190/774)。高级别及以上病变(≥HSIL)占27.78(215/774)。不同年龄组中HR-HPV阳性率呈“双峰”分布,最高为≤30岁组,占15.16%(502/3 311),各组间比较差异无统计学意义(χ2=4.75,P>0.05);不同年龄组活检人群中比较≥HSIL检出率,最高为41~50岁组,占32.37%(78/241),各组间比较差异有统计学意义(χ2=15.78,P<0.05);不同年龄组(除≥61岁组)活检人群中比较LSIL与≥HSIL的检出率,差异有统计学意义(χ2=22.12,P<0.05),见图1、表1。
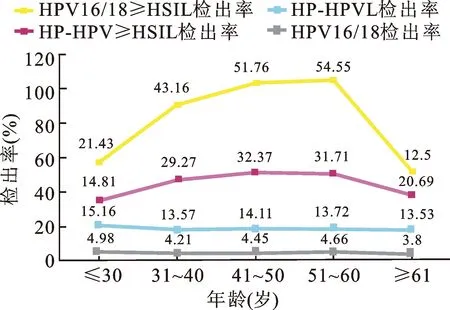
图1 不同年龄组HR-HPV和HPV16/18型检出率及各自≥HSIL检出率的分布
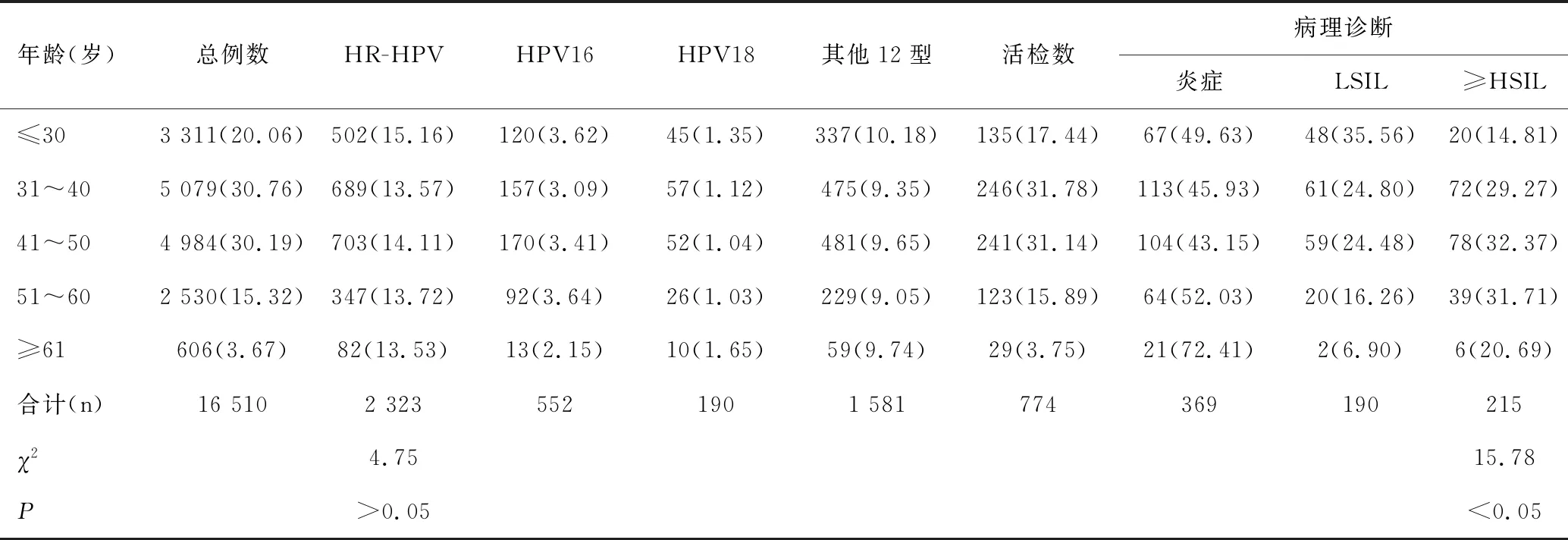
表1 不同年龄组HR-HPV阳性数、活检数和相应病理检查的比较结果 [n(%)]
2.2阴道镜病理检查结果与相应的HR-HPV感染情况
阴道镜病理活检908例,其中炎症485例、LSIL 202例、HSIL 197例、AIS 4例、AC 5例、SCC 15例。在阳性活检人群≥HSIL检出率中,HPV16型占47.27%(104/220)、HPV18型占25.61%(21/82)、其他12型HR-HPV阳性者占19.07%(90/472)、HR-HPV阴性占4.48%(6/134),各组间比较差异有统计学意义(χ2=57.64,P<0.05);在阳性活检人群鳞状上皮病变(HSIL、SCC)检出率中,HPV16型占87.18%(102/117)、HPV18型占12.82%(15/117),宫颈腺上皮病变(AIS、AC)检出率中,HPV16型占25.00%(2/8)、HPV18型占75.00%(6/8),HPV16与18型组间比较差异有统计学意义(χ2=20.71,P<0.05),见表2。
2.3其他12型HR-HPV阳性人群行细胞学分流后的宫颈病变情况
在472例其他12型HR-HPV阳性活检人群中,细胞学诊断NILM者的≥HSIL检出率占6.06%(8/132),≥ASCUS者的≥HSIL检出率占24.12%(82/340),两者差异有统计学意义(P<0.05),见表3。
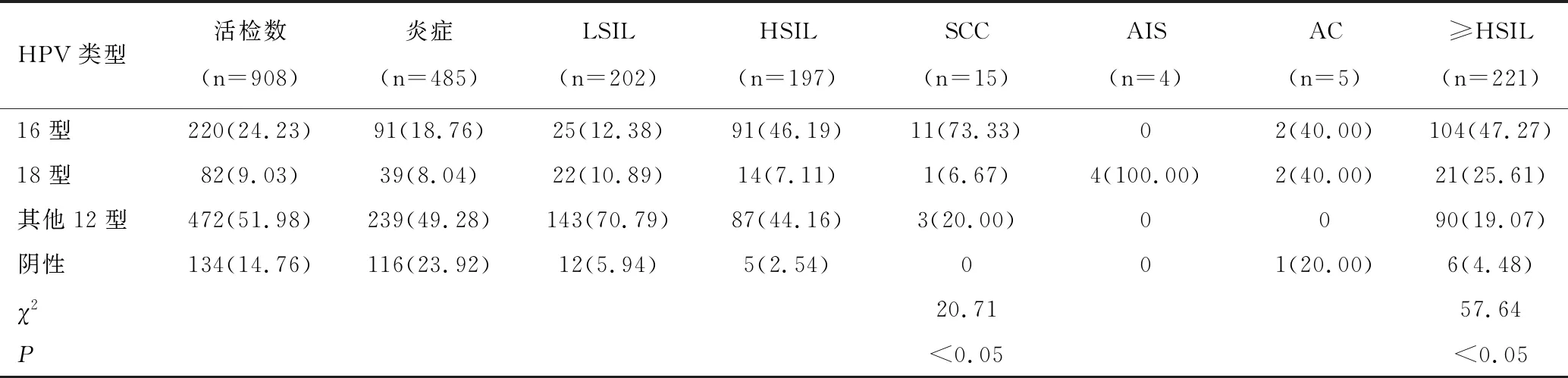
表2 HR-HPV感染类型与相应病理检查的比较结果[n(%)]
表3其他12型HR-HPV人群不同细胞学中≥HSIL检出率的比较结果 [n(%)]
Table 3 Comparison of the detection rate of ≥HSIL in other 12 subtypes of HR-HPV by cervical cytology [n(%)]
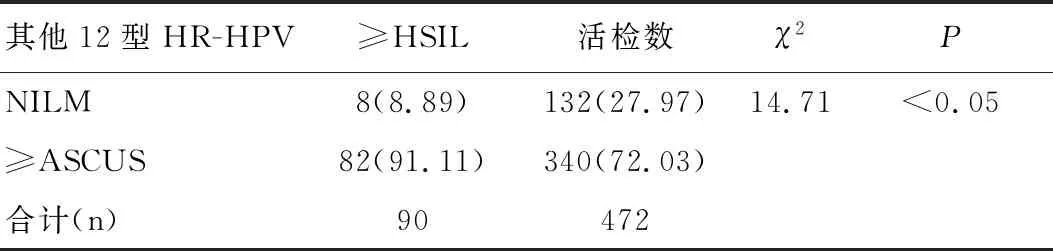
其他12型HR-HPV≥HSIL活检数χ2PNILM8(8.89)132(27.97)14.71<0.05≥ASCUS82(91.11)340(72.03)合计(n)90472
2.4 HPV分型检测筛查子宫颈高级别及以上病变的价值
以阴道镜病理检查结果为“金标准”,HPV16/18阳性活检人群中筛查子宫颈≥HSIL的敏感度为95.42%(125/131),特异度为41.97%(128/305),阳性预测值为41.39%(125/302),阴性预测值为95.52%(128/134)。联合细胞学分流其他12型HR-HPV的检测方法,在活检人群中筛查≥HSIL的敏感度为97.29%(215/221),特异度为18.63%(128/687),阳性预测值为27.78%(215/774),阴性预测值为95.52%(128/134)。
3讨论
3.1宫颈癌筛查现状
子宫颈癌的发生发展是一个渐变的过程,从癌前病变进展为癌大约需要10年或更久,在此期间任何一次有效的检查都可以将病变阻断。在经济条件允许的情况下,宫颈癌筛查方法首推细胞学与HPV联合检查,但是细胞学改变是HPV感染的下游事件,HPV相关的分子生物学改变先于细胞形态学改变出现。同时,HPV阴性者发生子宫颈病变的可能性往往小于细胞学阴性者。由于各地区细胞病理诊断医师匮乏,尤其是基层医院诊断水平不一、培养体制不完善及专业技术人员操作水平(细胞学取样、制片等)、操作环境等因素造成的漏诊,使HPV检测的可操作性优于单纯的液基细胞学检查[2]。2007年,国际癌症研究中心(IARC)提倡HPV分型检测可作为子宫颈癌初筛的手段之一;2012年,美国妇产科医师协会(ACOG)和美国阴道镜及宫颈病理学会(ASCCP)指南指出,细胞学阴性的HPV16/18型阳性者,建议行阴道镜检查;2014年美国FDA批准HPV检测作为子宫颈癌的初筛策略[3]。这一系列指南内容的更新充分体现了HPV检测在宫颈癌筛查中的重要性。
本研究中,HPV16/18联合细胞学分流其他12型HR-HPV的检测方法,在阴道镜检查的人群中筛查≥HSIL的敏感度为97.29%,特异度为18.63%,阳性预测值为27.78%,阴性预测值为95.52%,其高敏感性和阴性预测值,与国内文献[2,4-5]报道一致。本研究显示,其他12型HR-HPV阳性者,经液基细胞学分流后,132例细胞学判读为NILM者中有8例病检为≥HSIL,即细胞学假阴性。经过三位高年资病理医生复核,仍诊断NILM者4例、非典型鳞状上皮-不能除外高度病变(ASC-H)2例、LSIL 1例,HSIL 1例。分析玻片,NILM 4例中有2例因黏液、血液较多经离心震荡预处理后,细胞发生一定程度退变,且有效细胞量较少(<5 000)而未发现病变细胞;另2例NILM玻片中未见病变细胞,也未发现颈管及化生细胞,估计刷检时宫颈(特别是移行区)暴露不佳,未有效取样;LSIL的玻片视野中大部分区域染色欠佳(偏灰暗),边缘可见少量散在挖空细胞,考虑为技术人员转换染液时未完全滤净,影响最终判读;在ASC-H 2例中有1例为宫颈重度炎症患者,玻片背景脏乱,见大量炎症细胞和红细胞混杂、粘附在宫颈细胞表面,掩盖其中少许异型中底层细胞,提高了判读难度;余下2例(ASC-H、HSIL各1例)皆为老年女性,细胞整体呈萎缩反应性改变,夹杂着少量核浆比高、核型不规则的鳞状上皮细胞,隐匿于周围萎缩细胞中,难以鉴别。以上病例后续皆行宫颈锥切术,结果均提示病变范围局限,切缘阴性;其中LSIL者锥切标本仅见低级别病变残留,而2例(ASC-H 1例、HSIL 1例)老年女性,移行区内移,外口大部分为萎缩鳞状上皮,病变部位离外口约1cm,印证了玻片中异型细胞少的原因。
综上,造成假阴性的原因有很多:患者病变范围、临床取样误差、制片方法、染色技巧、阅片水平及阅片速度过快、疲劳阅片等,国内文献[6]亦有报道,因此,宫颈细胞学技术虽然发展快速且应用广泛,但仍难以避免假阴性的判读。尽管美国病理学家协会(College of American Pathologists,CAP)制定了一系列条例控制阅片量和时间:如每人每日阅片量不超过100张,每小时阅片不超过12.5张等,同时研发了计算机辅助阅片系统(成本高、费用昂贵,与人工阅片相比各有优势),以降低假阴性率,但仍不适用于国内大多数基层医院。宫颈癌筛查作为我国惠及民生的重大公共卫生项目,应首先保证对≥HSIL敏感性和阴性预测值的准确评估。故2017年浙江地区宫颈癌筛查初筛策略由液基细胞学转变为HPV分型检测是合理且可行的。
3.2不同年龄组HR-HPV阳性者宫颈病变分析
目前,WHO建议筛查起始年龄为30岁或以上[7]、ACOG建议21岁开始筛查,但HPV检测仅用于25岁以上女性[8],我国推荐为25~30岁[9-10]。本研究中HR-HPV阳性者参与阴道镜检查的活检率,最高为31~40岁组(31.78%,246/774),总体趋势随着年龄增长而降低。可以看出,本地区宫颈癌筛查中年轻女性更有意愿、也更配合,而对于中老年女性,应加强健康教育,提高其对宫颈癌的认知度,做到防癌而不恐癌。
本研究显示,≤30岁组HR-HPV阳性活检人群中≥HSIL检出率为14.81%(20/135)。虽然与其他年龄组差异明显,但仍提示宫颈病变不仅仅局限于>30岁女性,具有年轻化趋势,这与国内文献[4-5,11]报道一致。因此,对该组女性,应结合患者临床病史及经济条件选择性行HR-HPV检测。
尽管不同年龄组中HR-HPV阳性率比较差异无统计学意义,但活检人群各组间≥HSIL检出率差异明显,且趋势随着阳性率变化而变化,随着年龄增长而逐渐升高,其中HPV16/18型在51~60岁达峰值,而总阳性人群则在41~50岁达峰值,之后降低。这提示本地区HR-HPV阳性者需要重点关注41~50岁组人群,建议直接行阴道镜检查。
值得一提的是,各年龄组(除≥61岁组,LSIL检出数较少,有效数据不足)LSIL检出率随年龄升高而下降,虽然组间纵向比较无统计学意义,但与≥HSIL检出率横向比较有显著差异。这从侧面反应了LSIL作为过渡病变与≥HSIL密切相关,但在不同年龄组中的发病特点有待进一步深入研究。
至于HR-HPV阳性率最高的≤30岁组,≥HSIL检出率最低,原因是年轻女性性生活活跃,感染率较高,但自身免疫力强,大多数是一过性感染,病变进展少,转归或消退率高;而≥61岁组人群HR-HPV阳性率和≥HSIL检出率下降,有可能的原因:该组参与宫颈癌筛查及阴道镜活检的人数相对较少,结果有所偏倚;由于HPV感染相关因素为性行为和年龄,≥61岁组人群相较于年轻女性,性伴侣相对固定,性行为频率减少也是感染率降低的原因之一[12]。
3.3 HR-HPV感染状态与阴道镜病理检查结果分析
在908例活检人群中的LSIL检出率和≥HSIL检出率,HPV16型阳性者为11.36%(25/220)和47.27%(104/220)、HPV18型为26.83%(22/82)和25.61%(21/82)、其他12型HR-HPV阳性者为30.30%(143/472)和19.07%(90/472)、HR-HPV阴性为8.96%(12/134)和4.48%(6/134),组间比较差异有统计学意义(P<0.05),说明HR-HPV阳性较阴性者、HPV16型较18型及其他12型者更易发生≥HSIL的病变,从侧面反映了HPV16型较其他型造成的LSIL更容易进展为HSIL,因此HPV16型感染具有更大的危害性。在宫颈鳞状上皮病变(HSIL、SCC)与腺上皮病变(AIS、AC)的比较中,HPV16型与18型之间差异有统计学意义(P<0.05)。与文献报道[4,13]结果相似,鳞状上皮病变最相关亚型是HPV16型,腺上皮病变最相关亚型是HPV18型。本研究中9例腺上皮病变者,4例阴道镜活检证实、3例宫颈管搔刮中伴有异型腺上皮(组化证实),2例为阴道镜活检未见腺上皮病变(后续锥切证实),主要分布于36~51岁年龄段之间(其中36岁1例、37岁2例、38岁1例、47岁2例、48岁1例、49岁1例、51岁1例),且HPV18型阳性者占66.67%(6/9)。因此,本地区高危年龄(36~51岁)女性在筛查时需要重视与HPV18型相关的腺上皮病变。由于宫颈腺上皮病变位置往往较深,单纯阴道镜下活检诊断率不高,而增加宫颈管搔刮术取得管内组织及脱落细胞,能更好地发现宫颈隐蔽病灶及移行带内移致阴道镜检查不满意者。因此,对怀疑腺上皮病变者,建议及时行阴道镜检查及宫颈管内膜搔刮术[14]。
本研究中HR-HPV阴性患者可见5例HSIL及1例AC,这些患者有可能存在感染了未知类型的HPV(包括本身未被发现的HPV亚型和接种HPV疫苗后所产生的变异亚型)、实验误差造成的假阴性及与HPV感染不相关的宫颈病变。有研究证实,HR-HPV阴性的子宫颈癌患者中腺癌的比例明显高于HR-HPV阳性者[15-16]。就目前的筛查策略而言,这部分人群有漏诊的可能。因此,对于HR-HPV阴性及接种过HPV疫苗者,仍建议定期接受宫颈癌筛查,若临床症状、体征出现异常(如性交后出血、异常阴道流血或排液、子宫颈表面柱状上皮外移等),应联合细胞学与HPV检查,必要时亦可行阴道镜及宫颈管内膜搔刮术,防止漏诊。
总之,≤30岁的女性可选择性行HR-HPV检测;>30岁的浙江地区HR-HPV阳性女性,建议直接行阴道镜检查,且应重点关注41~50岁组。若36~51岁伴有HPV18型阳性者,阴道镜检查的同时应注重宫颈管内膜搔刮术。对HR-HPV阴性者,建议应定期接受宫颈癌筛查,若有异常症状体征,可联合细胞学与HPV检查,必要时可行阴道镜及宫颈管内膜搔刮术,以进一步减少漏诊。在政府及各医疗机构推广宫颈癌筛查的同时,应进一步收集我国不同型别HR-HPV感染人群中病变分布的资料,制定和完善有中国特色的宫颈癌筛查策略,以降低宫颈癌的发生。

